Bài giảng Hoá học đại cương: Chương 2.1 - Trường ĐH Phenikaa
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.61 MB, 27 trang )
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC PHENIKAA
BÀI GIẢNG
HỌC PHẦN HÓA HỌC ĐẠI CƯƠNG
GIẢNG VIÊN: TS. PHẠM THỊ LAN HƯƠNG
TS. VŨ THỊ HỒNG HÀ
TS. ĐẶNG VIẾT QUANG 1
1
Cấu tạo nguyên tử
2
3
Liên kết hóa học và cấu tạo phân tử
Trạng thái tập hợp của chất
Nguyên lý I của nhiệt động học
4
5
Nguyên lý II của nhiệt động học
6
7
Dung dịch
8
9
Cân bằng hóa học
Dung dịch chất điện ly
Động hóa học
10
Các quá trình điện hóa
1
Cấu tạo nguyên tử
2
3
Liên kết hóa học và cấu tạo phân tử
Trạng thái tập hợp của chất
Nguyên lý I của nhiệt động học
4
5
Nguyên lý II của nhiệt động học
6
7
Dung dịch
8
9
Cân bằng hóa học
Dung dịch chất điện ly
Động hóa học
10
Các quá trình điện hóa
Khái niệm một số đại lượng
1
2
Các thuyết về liên kết và các loại liên kết hóa học
Độ âm điện χ
Đại lượng cho biết khả năng nguyên tử của một nguyên tố hút electron liên kết
về phía nó
Độ phân cực của liên kết.
• Χ càng lớn ngun tử càng dễ thu electron.
• Thang độ âm điện thơng dụng do Pauling đề xuất
Độ âm điện χ
Độ âm điện χ
•
•
•
•
Chu kỳ: từ trái sang phải độ âm điện của các ngun tố tăng dần
Phân nhóm chính: từ trên xuống dưới độ âm điện giảm dần
Kim loại kiềm có χ ≤ 1
Phi kim có χ > 2
HCl
Độ phân cực của liên kết. Momen lưỡng cực
• Độ phân cực của liên kết
Liên kết
Μ (D)
H-F
1,91
momen lưỡng cực μ (D-Đơ bai)
H-Cl
1,07
H-Br
0,79
H-I
0,38
• Các phân tử phân cực dễ dàng tan trong dung môi phân cực và
ngược lại.
Vd: - PT Phân cực: CO, NO, H2O, SO2, CHCl3…
- PT không Phân cực: CO2, SO3, CCl4…
Liên kết ion
Liên kết kim loại
Liên kết cộng hóa trị
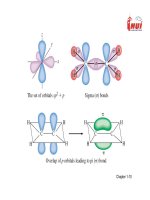
• Thuyết Bát tử của Lewis
• Thuyết tương tác các cặp
electron (VSEPR)
• Thuyết Liên kết Hóa Trị(VB)
• Thuyết Vân đạo Phân tử
(MO)
Thuyết Bát tử của Lewis
Electron hóa trị nằm trong các lớp vỏ ngoài
cùng chưa bão hòa của nguyên tử
Liên kết
hóa học
Luật “Bát tử”
Các nguyên tử có xu hướng cho, nhận, hay
sử dụng chung electron để đạt tới cấu hình
lớp vỏ ngoài cùng bền vững có 8 electron
G.N.Lewis (1875-1946 Mỹ)
Mô tả các electron hóa trị của các nguyên tử
·
Hydro:
H
Natri:
Na ·
··
··
Cl
··
·
Clo:
Sự hình thành liên kết
Sự hình thành NaCl:
··
··
··
+ [ Cl ]
Cl
®
Na
··
··
··
Na +
·
·
··
Sự hình thành HCl:
··
H
Cl
··
··
®
··
·
H · + Cl
··
··
··
Kim loại nhường electron cho phi kim để tạo liên kết ion.
Hai phi kim dùng chung electron để tạo liên kết Cộng Hóa Trò.
Liên kết ion hình thành do sự tương tác tónh điện giữa các ion
trái dấu.
··
··
··
]
Na+ [ Cl
··
Liên kết ion
Liên kết ion hình thành do sự tương tác tĩnh điện giữa các ion trái dấu.
Điện tích của hai
ion là Q1 và Q2:
Q2
Q1
·
·
d
Năng lượng tương tác:
Q1Q2
E
d
Bán Kính Ion
Năng lượng mạng tinh thể
• Là đại lượng thể hiện độ bền của liên kết ion.
• Được định nghĩa là “sự thay đổi entalpy của quá trình
tách 1 mol hợp chất ion ra thành các ion riêng lẻ”
• NaCl(s)
Na+(g) + Cl-(g)
DH = 788 kJ
• Năng lượng mạng tỷ lệ thuận với điện tích ion và tỷ lệ
nghịch với kích thước ion.
• KCl(s)
MgCl2(s)
K+(g) + Cl-(g)
DH = 701 kJ
Mg+2(g) + 2 Cl−(g)
DH = 3795 kJ
Chu trình
Born-Haber
Sắp xếp các chất sau theo thứ tự năng lượng mạng tăng dần:
KCl
701 kJ
NaF
910 kJ
MgO
3795 kJ
KBr
671 kJ
NaCl
788 kJ
Cl−
K+
·
·
d
Br−
K+·
·
d
Liên kết cộng hóa trị Khi hai nguyên tử tương tự nhau hình thành
liên kết, không nguyên tử nào nhường hay nhận hẳn electron.
• Dùng chung cặp electron để đạt cấu hình bền 8 electron.
• Mỗi cặp electron dùng chung tạo thành một liên kết.
··
H
Cl
··
··
®
··
·
H + Cl
··
·
··
··
Các hợp chất cộng hóa trị
Mỗi nguyên tử phải có 8 electron lớp vỏ ngoài cùng (trừ H có 2 electron)
··
··
Cl
Cl
··
··
··
Electron liên kết
··
··
Cl
Cl
·· ··
··
Electron không liên kết
H
··
··
·
Cl
Cl
+
®
··
··
··
··
hay H
··
··
·
Cl2:
H · + ·H ® H H
··
H 2:
Cách biểu diễn các liên kết CHT
• B1: Tính tổng số electron hóa trị của các nguyên tử.
– Ion điện tích n- : cộng thêm n electron hóa trị
– Ion điện tích n+ : trừ đi n electron hóa trị
• B2: Phân bố các nguyên tử quanh nguyên tử trung tâm (NTTT là nguyên
tử có độ âm điện nhỏ hơn, trừ H)
• B3:Vẽ các liên kết đơn từ nguyên tử trung tâm đến các nguyên tử khác.
• B4: Hoàn thành ‘bát tử” cho các nguyên tử ngoài
• B5: Đặt các electron hóa trị còn dư vào nguyên tử trung tâm
• B6: Nếu nguyên tử trung tâm chưa đạt “bát tử”, tạo liên kết bội giữa
nguyên tử trung tâm với các nguyên tử ngoài.
Ví dụ
CH4:
··
··
··
··
H O
H
··
··
··
··
··
hay H F· ·
hay H ·O· H
··
hay H N H
H
H
··
H C
H
··
H
H
hay H C H
H
··
H N H
··
H
··
NH3:
H ·F·
··
H2O:
··
··
HF:
··
··
··
Liên kết đôi
N 2:
N N
Liên kết ba
··
O
O
=
··
··
··
O 2:
Số cặp electron dùng chung được gọi là Bậc liên kết
.
Liên kết Cộng Hóa Trị có cực
Khi cặp electron được phân bố đều giữa hai nguyên tử : liên kết không phân cực
H 2,
Cl2:
Khi có sự phân bố không đồng đều: liên kết cộng hóa trị có cực
HCl: