Bài giảng Hoá học đại cương: Chương 2.2 - Trường ĐH Phenikaa
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (2.42 MB, 68 trang )
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC PHENIKAA
BÀI GIẢNG
HỌC PHẦN HÓA HỌC ĐẠI CƯƠNG
GIẢNG VIÊN: TS. PHẠM THỊ LAN HƯƠNG
TS. VŨ THỊ HỒNG HÀ
TS. ĐẶNG VIẾT QUANG 1
1
Cấu tạo nguyên tử
2
3
Liên kết hóa học và cấu tạo phân tử
Trạng thái tập hợp của chất
Nguyên lý I của nhiệt động học
4
5
Nguyên lý II của nhiệt động học
6
7
Dung dịch
8
9
Cân bằng hóa học
Dung dịch chất điện ly
Động hóa học
10
Các quá trình điện hóa
1
Cấu tạo nguyên tử
2
3
Liên kết hóa học và cấu tạo phân tử
Trạng thái tập hợp của chất
Nguyên lý I của nhiệt động học
4
5
Nguyên lý II của nhiệt động học
6
7
Dung dịch
8
9
Cân bằng hóa học
Dung dịch chất điện ly
Động hóa học
10
Các quá trình điện hóa
Khái niệm một số đại lượng
1
2
Các thuyết về liên kết và các loại liên kết hóa học
Liên kết ion
Liên kết kim loại
Liên kết cộng hóa trị
• Thuyết Bát tử của Lewis
• Thuyết tương tác các cặp
electron (VSEPR)
• Thuyết Liên kết Hóa Trị(VB)
• Thuyết Vân đạo Phân tử
(MO)
• Thuyết Bát tử của Lewis
• Thuyết tương tác các cặp electron (VSEPR)
• Thuyết Liên kết Hóa Trị(VB)
• Thuyết Vân đạo Phân tử (MO)
Lý do
Tính chất của các chất có liên kết cộng hóa trị (CHT) phụ thuộc vào hình dạng phân tử:
• Nhiệt độ nóng chảy
• Nhiệt độ sơi
• Khả năng solvat hóa
Cơng thức Lewis
•
Khơng cho biết hình dạng của phân tử của các hợp chất CHT.
•
Ví dụ: Phân tử CCl4 (góc liên kết ClCCl đều bằng 109o)
Phân tử CCl4
Thuyết tương tác các cặp electron
Valence Shell Electron Pair Repulsion theory(VSEPR).
• Liên kết cộng hóa trị được hình thành do sự ghép đơi hai electron độc
than có số lượng tử ms ngược dấu nhau của 2 nguyên tử tham gia liên
kết vào 1 ơ lượng tử của phân tử.
• Trong phân tử cộng hóa trị các cặp electron quanh nguyên tử sẽ sắp
xếp sao cho sự tương tác là nhỏ nhất.
• Trong phân tử cộng hố trị ABn các cặp điện tử hóa trị liên kết (σ) và cặp điện
tử hố trị tự do cuả A (nếu có) phải xa nhau ở mức tối đa sao cho lực đẩy giữa
các cặp electron đó có giá trị nhỏ nhất.
Áp dụng thuyết VSEPR
• B1: Vẽ cơng thức Lewis.
• B2: Đếm số vị trí có electron quanh ngun tử
– Một cặp electron khơng liên kết tính là 1 vị trí
– Một liên kết (Đơn, Đơi hoặc Ba) tính là một vị trí.
• B3: Sắp xếp các vị trí có electron sao cho tương tác là nhỏ nhất
Cách sắp xếp Số vị trí Cách xếp
2
180
Thẳng hàng
120
3
Tam Giác
109.5
4
Tứ diện
Cách sắp xếp Số vị trí Cách xếp
5
Lưỡng Tháp
Tam Giác
90
120
90
90
6
Bát diện
CO2
SO2
••
••
O
=C=O
••
••
••
••
••
••
••
••
O
S =O
••
••
góc LK
2 - Thẳng hàng
180
3 - Tam Giác
120
3 - Tam Giác
120
••
O
C O
••
••
-2
••
••
O
••
CO3-2
••
••
O
=S O
••
••
••
Các
dạng
phân
tử
vị trí e – cách xếp
CT Lewis
••
Phân tử
Phân tử
.
Các
dạng
phân
tử
CT Lewis
vị trí e – cách xếp
góc
Liên kết
H
CH4
H C H
4 - Tứ diện
109.5
4 - Tứ diện
109.5
H
NH3
••
H N H
H
Phân tử
.
vị trí e – cách xếp
góc
Liên kết
••
••
••
F
S •F•
••
Lưỡng tháp
5 - Tam giác
••
••
SF4
••
••
••
F
••
F
••
90,
120
F
••
F
Xe F
••
••
••
••
F
••
XeF4
••
••
••
••
••
Các
dạng
phân
tử
CT Lewis
••
6 - Bát diện
90
Các
biến
dạng
• Cặp electron khơng liên kết tương tác mạnh hơn
các cặp electron liên kết.
• Liên kết đa có tương tác mạnh hơn liên kết đơn
• Ví dụ: H2O
O
Cl
111.4
o
Cl
C O
124.3o
H
H
104.5
Liên kết cho nhận
NH3 + H+
•
•
NH4+
Liên kết hình thành nhờ cặp electron không phân chia của 1 nguyên tử và
ô lượng tử trống của nguyên tử kia gọi là LK cho nhận, hay phối trí/bán
cực
Số các liên kết cộng hóa trị mà nguyên tử có khả năng tạo thành bằng số
ơ lượng tử (orbital) của ngun tử có khả năng tham gia tạo liên kết
Thuyết liên kết hóa trị (Valence Bond Theory)
• Thuyết Lewis và VSEPR khơng giải thích được độ bền của các liên kết cộng hóa trị.
• Thuyết Liên kết hóa trị dựa trên kết quả của cơ học lượng tử để giải thích sự tạo thành
liên kết.
• Liên kết hóa học tạo thành do sự xen phủ của các orbital của các nguyên tử.
• Các orbital chỉ xen phủ với nhau khi:
– Hai orbital, mỗi orbital chứa 1 electron
– Một orbital chứa 2 electron và 1 orbital trống (liên kết cho nhận hay liên
kết phối trí)
Có hai kiểu xen phủ tạo thành hai loại liên kết: và
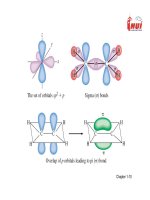
Liên kết
Liên kết s (sigma) tạo thành do sự xen phủ đối xứng theo trục của
hai orbital.
Sự xen phủ của 2 orbital pz trong phân tử O2:
E
0.08
0.16
0.24
0.32 nm
Liên kết p
Liên kết p (pi) hình thành do sự xen phủ đối xứng theo mặt phẳng
Sự xen phủ của 2 orbital py trong phân tử O2
Độ bền liên kết
Liên kết càng bền khi mức độ xen phủ các Orbital càng lớn
(mật độ nguyên tử giữa hai hạt nhân là lớn nhất)
1. Mức độ xen phủ phụ thuộc vào: hình dạng, kích thước, năng lượng của các
orbital, hướng xen phủ và kiểu xen phủ giữa chúng.
2. Các orbital có năng lượng tương đương nhau sẽ xen phủ tốt
3. Xen phủ theo trục hữu hiệu hơn xen phủ theo mặt phẳng.
Ví dụ
H 2:
1s
1s
HF:
2p
1s
F2 :
2p
2p
Xét phân tử H2O :
Nguyên tử trung tâm O:
2s
2p
1s
Góc liên kết dự
đoán 90.
2p
1s
2s
2p
Thực nghiệm : 104 o
Sự lai hóa (tạp chủng)
• Trước khi tạo liên kết, các orbital của nguyên tử sẽ tổ hợp với nhau tạo ra các
orbital tạp chủng. VD: CH4
• Số orbital tạp chủng hình thành đúng bằng số orbital tham gia tổ hợp.
s
+
p
sp
sp