Hướng Dẫn Thí Nghiệm Hoá Vô Cơ - Đại Học Thuỷ Lợi.pdf
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (7 MB, 74 trang )
TRƯỜNG ĐẠI HỌC THUỶ LỢI
BỘ MƠN KỸ THUẬT HỐ HỌC
PGS. TS. ĐẶNG THỊ THANH LÊ
HƯỚNG DẪN THÍ NGHIỆM
HỐ VƠ CƠ
Hà Nội – 2018
LỜI NĨI ĐẦU
Sách hướng dẫn Thí nghiệm Hóa Vơ cơ được dùng làm tài liệu giảng dạy chính thức
cho mơn học Thí nghiệm Hóa Vơ cơ, ngành Kỳ thuật Hóa học - Trường Đại học Thủy lợi.
Thí nghiệm Hóa Vồ cơ là mơn học thí nghiệm cơ sở ngành đầu tiên của sinh viên
ngành Kỹ thuật Hóa học. Vì vậy ngồi mục đích minh họa, củng cố kiến thức lí thuyết Hóa
Vơ cơ mơn học này cịn nhằm mục đích hướng dẫn, rèn cặp cho sinh viên kĩ năng thực
hành hóa học.
Sách hướng dẫn Thí nghiệm Hóa Vơ cơ có thời lượng 15 tiết (1 tín chỉ) gồm 5 bài:
Bài 1: H1ĐR0 - HALOGEN - 0X1 - LƯU HUỲNH
Bài 2: NHÓM VA
Bài 3: NHÓM IVA - IIIA - IIA - IA
Bài 4: KIM LOẠI CHUYỂN TIẾP d: CROM - MANGAN
Bài 5: KIM LOẠI CHUYỂN TIẾP d (TIẾP): SẮT - COBAN - NIKEN - ĐỒNG BẠC - KẼM - CADIMI - THỦY NGÂN
Các bài thực hành đều được tham khảo từ các giáo trình thí nghiệm trong và ngồi
nước và đã được làm thực nghiệm kiểm tra cẩn thận.
Số lượng các thí nghiệm trong các bài thí nghiệm cũng được biên soạn nhiều hơn so
với số thí nghiệm có thể thực hiện trong chương trình nhằm mục đích để phịng thí nghiệm
lựa chọn, thay đối một số thí nghiệm cho phù hợp với điều kiện của từng năm học.
Nội dung tùng bài thí nghiệm khồng nhắc lại phần lý thuyết trên lớp và cũng không
lặp lại phần hướng dẫn những thao tác thí nghiệm cơ bản mà sinh viên đã được học ở phần
thí nghiệm Hóa đại cương. Do vậy, để làm thí nghiệm được tốt sinh viên cần phải chuẩn bị
bài trước ở nhà: xem lại phần lý thuyết, tính toán trước các số liệu cần thiết của từng bài thí
nghiệm và dự kiến chiều hướng, mức độ xảy ra của phản ứng sẽ tiến hành.
Cuốn Sách hướng dẫn Thí nghiệm Hóa Vồ cơ gồm 2 phần: phần I đề cập đến nội
dung các bài thí nghiệm, phần II đề cập đến hướng dẫn chuân bị và viết báo cáo thí
nghiệm, nhằm giúp sinh viên chuẩn bị tốt và nắm vững các bài thí nghiệm.
Trong q trình biên soạn Sách hướng dẫn Thí nghiệm Hóa Vơ cơ, chúng tơi đã được
sự góp ý của nhiều cán bộ ở Viện Kỹ thuật Hóa học - Trường Đại học Bách khoa Hà Nội
và Khoa Hóa học - Trường Đại học Khoa học Tự nhiên - Đại học Quốc gia Hà Nội, cùng
nhiều cán bộ ở Bộ mơn Kỹ thuật Hóa học - Trường Đại học Thủy lợi. Chúng tôi xin chân
thành cảm ơn sự chỉ bảo, góp ý tận tình của các thầy cô và các bạn đồng nghiệp.
Tuy vậy Sách hướng dẫn Thí nghiệm Hóa Vơ cơ cũng khơng tránh khỏi thiếu sót về
nội dung và hình thức. Vì vậy chúng tơi rất mong được sự góp ý chân thành của các thầy,
cơ giáo, các bạn sinh viên đế hồn thiện thêm Sách hướng dẫn Thí nghiệm Hóa Vơ cơ
trong thời gian tới.
Hà Nội, ngày 25 tháng ỉ ỉ năm 2017
Các tác giả
3
MỤC LỤC
Trang
LỜI NÓI ĐÀU
3
MỤC LỤC
4
PHÀN I: NỘI DƯNG CÁC BÀI THÍ NGHIỆM
5
BÀI 1: HIĐRO - HALOGEN - OXI - Lưu HUỲNH
6
BÀI 2: NHÓM VA
16
BÀI 3: NHÓM IV A - IIIA - IIA - IA
22
BÀI 4: KIM LOẠI CHUYÊN TIẾP d: CROM - MANGAN
32
BÀI 5: KIM LOẠI CHUYỂN TIẾP d (TIẾP): SẮT - COBAN - NIKEN - ĐÒNG BẠC - KẼM - CAĐIMI - THỦY NGÂN
38
PHẢN II: HƯỚNG DẪN CHUẲN BỊ VÀ VIẾT BÁO CÁO THÍ NGHIỆM
45
BÀI 1: HIĐRO - HALOGEN - 0X1 - Lưu HUỲNH
46
BÀI 2: NHÓM VA
52
BÀI 3: NHÓM IVA - IIIA - IIA - IA
56
BÀI 4: KIM LOẠI CHUYÊN TIẾP d: CROM - MANGAN
62
BÀI 5: KIM LOẠI CHUYỂN TIẾP d (TIẾP): SẮT - COBAN - NIKEN - ĐÔNG BẠC - KẼM - CAĐIMI - THỦY NGÂN
67
TÀI LIỆU THAM KHẢO
75
4
PHẢN I
NỘI DUNG CÁC BÀI THÍ NGHIỆM
5
BÀI 1. HIĐRO - HALOGEN - OXI - Lưu HUỲNH
TN1. Điều chế và sự cháy của hiđro
1. Hóa chất, dụng cụ
a- Hóa chất:
kẽm Zn hạt;
axit clohiđric HC1 đặc
b- Dụng cụ
ống nghiệm có nhánh:
1
giá sắt (kèm 1 con bọ):
1
ống thủy tinh vuốt nhọn:
1
đèn cồn:
1
nút cao su:
1
phễu thủy tinh:
1
ống nối silicon:
1
2. Cách tiến hành thí nghiệm
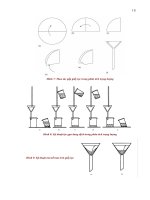
Lấy axit HC1 đặc vào khoảng 1/4 ống nghiệm có nhánh. Bỏ vào vài hạt kẽm rồi nút
chặt bằng nút cao su. Lắp thí nghiệm như hình vẽ 1.
Quan sát, chờ 2-3 phút cho hiđro đấy hết khơng khí ra khỏi ống nghiệm rồi châm lửa
đốt khí hiđro ở đầu ống thuỷ tinh vuốt nhọn.
Nhận xét màu ngọn lửa. Lấy phễu khô úp lên đầu ngọn lửa.
Quan sát và giải thích hiện tượng. Viết phương trình phản ứng?
Chú ỷ: Cấn thận khi làm việc với HCl đặc.
Hình 1. Điêu chê khí hiđro
6
TN2. So sánh tính oxi hố của các halogen
1. Hóa chất, dụng cụ
a- Hóa chất:
natri clorua NaCl 0,5M;
benzen đặc;
kali bromua KBr 0,5M;
nước clo;
kali iođua KI 0,5M;
nước brom
b- Dụng cụ:
ống nghiệm:
kẹp gỗ:
3
3
2. Cách tiến hành thí nghiệm
Lấy vào ba ống nghiệm:
- Ống 1:3-5 giọt dung dịch NaCl 0,5M
- Ống 2: 3 - 5 giọt dung dịch KBr 0,5M
- Ống 3:3-5 giọt dung dịch KI 0,5M
Thêm vào mỗi ống vài giọt dung môi hữu cơ benzen đặc, lắc đều và quan sát.
Sau đó tiếp tục cho vào:
- Ống 1:3-5 giọt nước brơm
- Ống 2: 3 - 5 giọt nước clo
- Ông 3:3-5 giọt nước brôm
Lắc đều và nhận xét màu của dung môi hữu cơ. Halogen nào đã tách ra ở dạng tự do?
Viết các phương trình phản ứng và so sánh tính oxi hóa của các halogen.
xếp các halogen thành một dãy theo chiều giảm dần khả năng oxi hoá? Giải thích?
TN3. Tính chất của nước Javen
1. Hóa chất, dụng cụ
a- Hóa chất:
nước Javen;
mangan (II) sunfat MnSƠ4 0,25M
b- Dụng cụ:
ống nghiệm:
1
giấy trắng:
1
kẹp gỗ:
1
mặt kính đồng hồ:
1
7
2. Cách tiến hành thí nghiệm
a) Viết vài chữ trên mảnh giấy trắng rồi đặt lên mặt kính đồng hồ. Nhỏ vào đó vài
giọt nước Javen. Quan sát, giải thích hiện tượng xảy ra?
b) Lấy vào ống nghiệm 3-5 giọt dung dịch MnSƠ4 0,25M, thêm vài giọt nước
Javen và lắc đều. Quan sát và giải thích hiện tượng xảy ra? Viết phương trình phản ứng?
Từ các thí nghiệm trên hãy rút ra kết luận về tính chất của nước Javen.
TN4. Tính oxi hố của kali clorat KCIO3 và kali iođat KIO3 trong mơi trường trung
tính và mơi trường axit
1. Hóa chất, dụng cụ
a- Hóa chất:
kali iođat KIO3 O,1M;
kali clorat KCIO3 O,1M;
kali iođua KI 0,5M;
axit sunfuric H2SO4 đặc
b- Dụng cụ:
ống nghiệm:
kẹp gỗ:
4
4
2. Cách tiến hành thí nghiệm
a) Tính oxi hố của KIO3:
Lấy vào 2 ống nghiệm:
- Ống 1:3-5 giọt dung dịch KIO3 O,1M
- Ống 2: 3 - 5 giọt dung dịch KIO3 O,1M, thêm 1-2 giọt axit H2SO4 đặc
Nhở từ từ từng giọt dung dịch KI 0,5M vào hai ống nghiệm trên và lắc đều.
Quan sát và giải thích hiện tượng. Viết các phương trình phản ứng?
Hãy rút ra kết luận về tính oxi hố của KIO3 trong mơi trường axit và mơi trường
trung tính?
b) Tính oxi hố của KCIO3:
Lấy vào 2 ống nghiệm:
- Ống 3: 3 - 5 giọt dung dịch KCIO3 O,1M
- Ống 4: 3 - 5 giọt dung dịch KCIO3 O,1M, thêm 1 - 2 giọt axit H2SO4 đặc
Nhỏ từ từ từng giọt dung dịch KI 0,5M vào hai ống nghiệm trên và lắc đều.
Quan sát và giải thích hiện tượng. Viết các phương trình phản ứng?
Rút ra kết luận về tính oxi hố của KCIO3 trong mơi trường axit và mơi trường
trung tính?
8
TN5. Sự hấp thụ iot trong hồ tinh bột
1. Hóa chất, dụng cụ
a- Hóa chất:
hồ tinh bột 0,1%
dung dịch iot bão hòa;
b- Dụng cụ:
ống nghiệm:
1
đèn cồn:
1
kẹp gỗ:
1
2. Cách tiến hành thí nghiệm
Lấy vào ống nghiệm vài giọt dung dịch iot bão hịa, thêm vào đó từ từ 2 - 3 giọt hồ
tinh bột và lắc đều. Quan sát sự thay đổi màu của dung dịch.
Đun nhẹ ống nghiệm vừa thêm hồ tinh bột 0,1%.
Đe nguội, quan sát và giải thích hiện tượng.
Rút ra tính chất đặc trưng của iot trong hồ tinh bột?
TN6. Tính ăn mịn thuỷ tinh của axit flohidric HF
1. Hóa chất, dụng cụ
a- Hóa chất:
parafin;
dung dịch axit flo hiđric HF
b- Dụng cụ:
tấm kính:
que nhọn:
1
1
2. Cách tiến hành thí nghiệm
Tráng một lớp mỏng parafin lên một tấm kính. Dùng một que nhọn viết chữ lên lớp
parafin sao cho phần kính dưới chữ khơng cịn lớp parafin.
(phần này sinh viên chuẩn bị trước khi vào buổi thí nghiệm).
Nhỏ dung dịch HF vào chữ viết này, đậy kín.
Chờ hết buổi thí nghiệm cạo sạch hết lóp parafin, quan sát.
Viết phưong trình phản ứng?
Rút ra nhận xét về tính chất đặc trưng của axit ílohiđric HF?
Chú ỷ: Cẩn thận khi làm việc với dung dịch axitflo hydric HF.
9
TN7. Điều chế oxi và thử tính chất của oxi
1. Hóa chất, dụng cụ
a- Hóa chất:
que đóm
kali pemanganat KMnƠ4 bột;
b- Dụng cụ:
ống nghiệm có nhánh
1
giá sắt (kèm 1 kẹp sắt):
1
ống thủy tinh cong:
1
nút cao su:
1
ống nghiệm:
1
đèn cồn:
1
chậu thủy tinh 30cm:
1
kẹp gỗ:
1
ống nối silicon
1
2. Cách tiến hành thí nghiệm
a) Điểu chế oxi bằng phương pháp phân huỷ nhiệt họp chất chứa oxi:
Cho 5g KMnƠ4 vào ống nghiệm có nhánh, rồi đậy bằng nút cao su, dùng đèn cồn
đun duới đáy ống nghiệm có nhánh. Thu khí oxi vào ống nghiệm để thử tính chất (thu qua
nước, thí nghiệm lăp như hình vẽ 2).
Viết phuơng trình phản ứng. Quan sát và giải thích hiện tuợng?
Hình 2. Điều chế khí oxi
b) Thử tính chất của oxỉ:
Đua tàn đóm dở vào ống nghiệm chứa oxi thu ở trên.
Nhận xét sự cháy của than trong oxi nguyên chất. Viết phuơng trình phản ứng?
10
TN8. Tính chất của hiđropeoxit H2O2
1. Hóa chất, dụng cụ
a- Hóa chất:
kali iođua KI 0,5M;
kali pemanganat KMnƠ4 0,02M
axit sunfuric H2SO4 IM;
hồ tinh bột 0,1%;
hiđropeoxit H2O2 10%;
b- Dụng cụ:
ống nghiệm:
kẹp gỗ:
2
2
2. Cách tiến hành thí nghiệm
a) Tính oxi hố của hiđropeoxit H2O2:
Lấy vào ống nghiệm 3-5 giọt dung dịch KI 0,5M và 3 - 5 giọt axit H2SO4 IM.
Nhỏ từ từ từng giọt dung dịch H2O2 10% vào ống nghiệm và lắc đều.
Quan sát sự biến đổi màu của dung dịch. Dùng chỉ thị hồ tinh bột 0,1% xem có iốt
tự do sinh ra trong dung dịch hay khơng?
Đun nóng dung dịch trong vài phút và quan sát hiện tượng xảy ra.
Giải thích và viết các phương trình phản ứng?
b) Tính khử của hỉđropeoxit H2O2:
Lấy vào ống nghiệm 3-5 giọt dung dịch KMnƠ4 0,02M và 3 - 5 giọt dung dịch
H2SO4 IM. Thêm từ từ từng giọt dung dịch H2O2 10% vào và lắc đều.
Quan sát sự thay đổi màu sắc của dung dịch.
Giải thích hiện tượng và viết các phương trình phản ứng?
Rút ra kết luận về tính chất của hiđropeoxit H2O2?
TN9. Tác dụng của lưu huỳnh s với axit nitric HNO3 đặc
1. Hóa chất, dụng cụ
a- Hóa chất:
lưu huỳnh S;
bari clorua BaCỈ2 0,25M
axit nitric đặc HNO3;
b- Dụng cụ:
ống nghiệm:
1
đèn cồn:
1
kẹp gỗ:
11
1
2. Cách tiến hành thí nghiệm
Cho một ít lưu huỳnh (bằng nửa hạt gạo) vào một ống nghiệm chứa sẵn HNO3 đặc
(khoảng 1/8 ống nghiệm). Đun sôi dung dịch trong vài phút (trong tủ hút). Sau đó thêm
vào 2-3 giọt dung dịch BaCh 0,25M và lắc đều.
Quan sát hiện tượng và viết các phương trình phản ứng?
Rút ra kết luận về tác dụng của lưu huỳnh s với axit đặc nitric đặc?
TN10. Tính chất của họp chất lưu huỳnh ở trạng thái số oxi hố +4 (NazSCh, NaHSCh)
X. Hóa chất, dụng cụ
a- Hóa chất:
giấy đo pH;
axit sunfuric H2SO4 IM;
natri hidrosunfit NaHSCh 0,25M;
natri sunfua Na2S 0,5M;
natri sunfit Na2SƠ3 0,25M;
kali pemanganat KMnƠ4 0,02M
b- Dụng cụ:
ống nghiệm:
2
mặt kính đồng hồ:
1
kẹp gỗ:
2
2. Cách tiến hành thí nghiệm
a) Tính axit - bazơ: Dùng giấy đo pH xác định môi trường của các dung dịch
Na2SƠ3 0,25M và NaHSCh 0,25M. Cách làm cụ thể như sau:
Cho mảnh giấy pH lên mặt kính đồng hồ, nhỏ 1 - 2 giọt dung dịch Na2SƠ3 0,25M
vào mảnh giấy pH. So sánh màu trên thang pH đế xác định độ pH của dung dịch.
Làm tương tự như trên để xác định độ pH của dung dịch NaHSƠ3 0,25M.
Giải thích tại sao 2 dung dịch trên lại có pH khác nhau. Viết phản ứng thủy phân?
b) Tính oxỉ hố: Lấy vào ống nghiệm 3 - 5 giọt dung dịch Na2SƠ3 0,25M và 3 - 5
giọt dung dịch H2SO4 IM. Sau đó thêm từ từ từng giọt dung dịch Na2S 0,5M.
Lắc đều ống nghiệm và quan sát sự tạo thành kết tủa s.
Giải thích hiện tượng và viết các phương trình phản ứng?
c) Tính khử'. Lấy vào ống nghiệm 3-5 giọt dung dịch KMnƠ4 0,02M, thêm từ từ
từng giọt dung dịch Na2SƠ3 0,25M.
Lắc nhẹ, quan sát sự biến đổi màu của dung dịch.
Giải thích và viết các phương trình phản ứng.
Rút ra kết luận về tính chất của hợp chất lưu huỳnh ở trạng thái số oxi hoá +4?
12
TN11. Tính chất của axit sunfuric H2SO4 đặc và lỗng
1. Hóa chất, dụng cụ
a- Hóa chất:
hạt Zn;
mảnh giấy;
phoi Cu;
mảnh vỏ bào;
đinh sắt;
axit sunfuric H2SO4 IM;
than bột;
axit sunfuric H2SO4 đặc
b- Dụng cụ:
ống nghiệm:
6
kẹp gỗ:
6
đũa thủy tinh:
1
đèn cồn:
1
mặt kính đồng hồ
1
2. Cách tiến hành thí nghiệm
a) Tác dụng của axit sunfuric H2SO4 đặc và loãng với kim loại
Lấy vào 6 ống nghiệm:
- Ống 1, ống 3 và ống 5: mỗi ống 5 giọt dung dịch H2SO4 IM
- Ông 2, ống 4 và ống 6: mỗi ống 5 giọt dung dịch H2SO4 đặc
Bỏ vào ống 1 và ống 2, mỗi ống nghiệm một hạt kẽm và lắc đều. Sau đó đun nóng
các ống nghiệm. Quan sát hiện tượng xảy ra và giải thích. Viết phưong trình phản ứng và
rút ra nhận xét.
Lặp lại thí nghiệm ở ống 3 và ống 4, nhưng thay kẽm bằng đinh sắt. Quan sát hiện
tượng xảy ra và giải thích. Viết phương trình phản ứng và rút ra nhận xét.
- Ông 5: thêm vào một vài mảnh phoi đồng Cu
- Ơng 6: thêm vào một ít than bột
Sau đó đun nóng và lắc đều các ống nghiệm 5 và 6. Quan sát hiện tượng xảy ra và
giải thích. Viết phương trình phản ứng và rút ra nhận xét.
Rút ra kết luận về tác dụng của axit sunfuric H2SO4 đặc và loãng với kim loại và
phi kim?
Chú ý: Cấn thận khỉ làm việc với H2SO4 đặc.
H2SO4 đặc làm rách quân áo, làm bỏng da.
Pha loãng axỉt H2SO4 đặc cần hết sức cấn thận!
13
b) Tác dụng của dung dịch axit sunfuric đặc H2SO4 với các chất hữu cơ
Lấy một mảnh giấy và một mảnh vỏ bào đặt lên mặt kính đồng hồ. Nhúng đầu đũa
thuỷ tinh sạch và khô vào dung dịch H2SO4 đặc rồi viết lên 2 vật này và hơ nóng nhẹ trên
ngọn nửa đèn cồn.
Quan sát hiện tượng xảy ra và giải thích. Viết phương trình phản ứng?
Rút ra nhận xét về tác dụng của axit sunfuric H2SO4 đặc với các chất hữu cơ?
Trong phịng thí nghiệm người ta thường dùng đê H2SO4 đậc làm gì?
TN12. Tính chất của dung dịch natri tiosunfat NazSiCh
1. Hóa chất, dụng cụ
a- Hóa chất:
tinh thể natri tiosunfat Na2S2Ơ3;
dung dịch iot bão hòa
axit clohiđric HC1 2M;
b- Dụng cụ:
ống nghiệm:
kẹp gỗ:
2
2
2. Cách tiến hành thí nghiệm
Hồ tan một ít tinh thể Na2S2Ơ3 vào nước, lắc đều cho tan hết. Chia dung dịch thu
được vào 2 ống nghiệm:
- Õng 1: nhỏ từ từ từng giọt dung dịch HC1 2M và lắc đều
- Ông 2: nhỏ từ từ từng giọt dung dịch iot bão hòa và lắc đều
Quan sát hiện tượng và viết các phương trình phản ứng.
Rút ra kết luận về tính chất của Na2S2Ơ3.
TN13. Tính chất của dung dịch kali disunfat K2S2O8
1. Hóa chất, dụng cụ
a- Hóa chất:
tinh thể kali disunfat K2S2O8;
natri hiđroxit NaOH 2M;
sắt (II) sunfat FeSŨ4 0,25M;
crom (III) sunfat Cr2(SO4)3 O,1M;
kali disunfat K2S2O8 0,5M;
bạc nitrat AgNƠ3 O,1M
axit sunfuric H2SO4 IM;
14
b- Dụng cụ:
ống nghiệm:
3
đèn cồn:
1
kẹp gỗ:
3
2. Cách tiến hành thí nghiệm
a) Tác dụng của kali disunfat K2S2O8 với dung dịch sat (II) sunfat FeS04
Lấy vào 2 ống nghiệm, mỗi ống 3-5 giọt dung dịch FeSƠ4 0,25M.
- Ông 1: giữ nguyên
- Ông 2: thêm vào 3-5 giọt dung dịch H2SO4 IM và 2 - 3 giọt dung dịch K2S2O8
0,5M. Lắc đều.
Sau đó cho thêm vào cả 2 ống 3-5 giọt dung dịch NaOH 2M và lắc đều.
Quan sát hiện tượng. Nhận xét màu của kết tủa tạo thành.
Viết các phương trình phản ứng xảy ra.
b) Tác dụng của kali disunfat K2S2O8 với dung dịch crom (III) sunfat Cv2(SO4)3
Lấy 3-5 giọt dung dịch Cr2(SƠ4)3 O,1M vào ống nghiệm. Thêm 3-5 giọt dung
dịch H2SO4 IM và 2 - 3 giọt AgNƠ3 O,1M, lắc đều. Đun nóng dung dịch và thêm vào đó
một ít tinh thể K2S2O8 rồi lại tiếp tục đun nóng và lắc đều cho tới khi dung dịch chuyển
thành màu da cam.
Giải thích hiện tượng và viết các phương trình phản ứng xảy ra?
Rút ra kết luận về tính chất đặc trưng của K2S2O8?
15
BÀI 2. NHĨM VA
TN1. Điều chế và thủ’ tính chất của nitơ
1. Hóa chất, dụng cụ
a- Hóa chất:
tinh thể natri nitrit NaNƠ2
que diêm
dung dịch amoni clorua NH4CI bão hoà
b- Dụng cụ:
ống nghiệm có nhánh:
1
giá sắt (kèm 1 con bọ):
1
ống nghiệm:
1
đèn cồn:
1
ống thủy tinh cong:
1
nút cao su:
1
chậu thủy tinh
1
ống nối silicon:
1
2. Cách tiến hành thí nghiệm
a) Điểu chế nitơ:
Cho vào ống nghiệm có nhánh 2g tinh thể NaNCh và 5ml dung dịch NH4CI bão hoà.
Đậy nút lại, rồi đun bằng ngọn lửa đèn cồn. Thu khí nito vào ống nghiệm qua chậu nước
(lắp thí nghiệm như hình vẽ 3).
Quan sát hiện tượng và viết phương trình phản ứng.
Hình 3. Sơ đồ điều chế khỉ nỉtơ.
16
b) Tính chat của nitư:
Đưa que diêm đang chảy vào ống nghiệm chứa khi nitơ.
Hãy quan xát hiện tượng xây ra. Nhận xét về khi niu».
TN2. Diều che và thử tính chất cùa amoniac
1.
Hóa chất, dụng cụ
a- Hóa chất:
linh thê amoni clorua NH1CI;
natri hidroxit NaOH 20%;
axit sunfuricH2SO4 IM;
phcnolphtalein 0,1%
b- Dụng cụ:
ống thủy tinh cong:
1
giá sắt (kèm 1 con bọ)
1
õng nghiệm có nhánh:
1
nút cao su:
1
ỏng nghiệm:
4
kẹp gỗ
1
ơng nỏi silicon
1
đèn cồn:
1
2. Cách tiến hành thí nghiệm
a) Điều chế anioniac:
Cho 2g tinh thế NH1C1 và 3ml NaOH 20% vào ống nghiệm có nhánh. Đậy nút ống
nghiệm lại. đun băng ngọn lứa đèn cồn. Thu khí amoniac bay ra ờ phía đầu nhánh (lắp thí
nghiệm nhu hĩnh vè 4).
Hình 4. Sư dị điêu chê và thừ tính chát cũíi amoniac
17
Quan sát hiện tượng và viet phương trinh phán ững.
Rút ra nhận xét vẽ thí nghiệm điêu chẽ amoniac.
Chú ý: Có thè dùng dung dịch NaOH 20% hoặc dung dịch Ca(OHỊĩ hãn hnà.
b) Tinh chất cua anioniac:
Cho vào ông nghiệm dụng amoniac 10ml nước cát và 1+2 giọt chi thi
phenolphtaleỉn 0.1%. Quan sát hiện lượng xây ra và giái thích?
Chia dung dịch trên làm 4 ống nghiệm rồi lần lượt cho vào các ống.
- Õng 1: Một ít linh thế NILCI và lắc đều.
- Óng 2: 5 giọt dung dịch H’SOi 1M và lắc đều
- ỡng 3: Đun sôi.
- ỏng 4: Giữ nguyên
Quan sát hiện tượng và viet phương trình phán ứng. Trong dung dịch amoniac tôn
tại nhùng cân băng nào?
Rút ra kết luận ve lính chat của amoniac?
TN3. Tính chất cùa mi nitrit
1.
Hóa chất, dụng cụ
a- Hóa chất:
kali pemanganat KMnOi 0.02M;
sắt (II) sunfat FcSOl O.25M;
kali đicromat KzCnO? 0.I25M;
natri nitrit NaNO’ O.25M;
kali iođua KI 0.5M;
axil sunfuric H2SO4 1M
h- Dụng cụ: ông nghiệm: 4
2.
Cách tiến hành thi nghiệm
Lây vào 4 ỏng nghiệm 2 - 3 giọt dung dịch các chai sau:
-Óng 1: KMnO-í O.O2M;
- Ĩng 2: K2C1+O7 0.125M;
- Ĩng 3: KI 0.5M;
- Ỏng 4: FeSO« O.25M.
Thêm vào mỗi ổng 3 - 5 giọt H’SOd IM.
Thêm tử lừ từng giọt dung dịch NaNOì O.25M vào mỗi ổng và lấc đều
Quan sát hiện tượng và viết các phương trình phán ứng xây ra?
Tử các thí nghiệm trcn rút ra kct luận gì vê tính chât cùa các mi nitrit?
18
TN4. Khả nâng tạo phức cúa dung dịch amoniac
1.
Hóa chất, dụng cụ
a- Hóa chất:
bạc nitrat AgNOiO.lM,
nalri hiđroxit NaOH 2M;
natn clorua NaCl 0.5M;
dung dịch amoniac đặc NH'
đồng (II) sunfat CuSOí O.25M;
I)- Dụng cụ: ỏng nghiệm: 2
2.
Cách liên hành thí nghiệm
Chuắn bị 2 ống nghiệm:
- Ĩng 1:2-3 giọi dung dịch AgN 0,1M và 2 - 3 giọt dung dịch NaCI 0,5M
- ỏng 2:2-3 giọt dung dịch CuSOi O.25M vã 2 - 3 giọt dung dịch NaOH 2M
Lắc đều các ống nghiệm. Sau đỏ thêm tử từ tửng giọt dung dịch NH1 đặc vào timg
ống nghiệm và lúc đều cho tới khi tan hết kẽt tủa.
Quan sát và giãi thích hiện tiụmg xảy ra. Viết các plnnmg trinh phàn ứng?
Rút ra két luận vẻ khá nàng tạo phúc cùa dung dịch amoniac?
TN5. Tinh chất của axit nitric HNOj
1.
Hóa chất, dụng cụ
a- Hóa chất:
axil nitric đặc HNOi;
phoi đóng Cu;
axit nitric HNO> 2M;
sắt (II) sunfat FcSO«0,5M
11- Dụng cụ:
2.
ống nghiệm:
3
đèn con
1
kẹp gỗ
Cách tiên hành thí nghiệm
a) Tác dụng cùa axit nitric HN0.I dặc và loãng với các kim loại:
Lây 2 óng nghiệm:
- Ơng I: Cho 5 giọt axit HNO< đặc.
- Ỏng 2: Cho 5 giọt dung dịch HNO? 2M.
19
1
Cho vào cá hai ống nghiệm mỏi ống 1 mánh phoi đồng vả lắc đều.
Đun nhẹ ống nghiệm 2 (chúa IlNO.i 2M và phoi đỏng) trẽn ngọn lứa đẻn cồn
Quan sát màu các khí thốt ra. Viết các phương trình phán ứng.
Rút ra két luận vé khá nâng oxi hoá cùa các dung dịch axil nitric đặc và loãng.
Chú ý: Các khi bay ra lừ khi dộc cân làm trong ui hút, quan sát xong phai rửa ngay
b) Tác dụng cùa dung dịch axil nitric HNO.t dặc với dung dịch sắt (II) sunfat FeSỉh
Lấy vào ống nghiệm 2-3 giọt dung dịch FeSOi 0.5M. Thêm vào tir tử cùng giọt
dung dịch axil HNOi đặc và lác đều. Quan sát hiện tượng.
Viet phương trinh phàn ứng xây ra?
TN6. Sự thuỳ phân cũa muối photphat
1.
Hóa chất, dụng cụ
a- Hóa chất:
giẩypH;
natri hiđrophotphat Na.'HPOl 0.02M;
nalri pholphat Na.POi 0.02M;
natri dihiđrophotphat NaH’PC>4 0,02M
I)- Dụng cụ: mật kinh đồng hồ: I
2.
Cách tiên hành thí nghiệm
Dùng giấy pll đo dộ pH cùa các dung dịch Na.iPO-1 0.02M; NaiHPOí 0.02M;
NaH’POi 0.02M. Cách làm cụ thế như sau:
Cho mánh giấy pH lên mặt kinh đồng hồ. nhó I - 2 giọt dung dịch NaiPO.1 0.02M
vào mánh giấy pll. So sành mâu trẽn thang pH để xác định độ pH cùa dung dịch.
Làm tương tự như trẽn đề xác định độ pH cua 2 dung dịch cịn lại.
Giải thích, viet phương trình thủy phân ion.
Kèt luận vẽ (inh chát cùa các muôi trên'’
TN7. Diều chế và tính chất của antimon hiđroxit Sb(()II)i; bitmut hiđroxit Bi(OH).<
1.
Hóa chất, dụng cụ
a- Hóa chat:
antimon clorua SbCl.i 0.2M.
axit clohiđric HCl 2M;
bitmut mtrat Bi(NOộjO,2M;
natri hiđroxit NaOH 2M;
giấy pH
20
b- Dụng cụ:
ống nghiệm:
4
máy li tâm:
1
2. Cách tiến hành thí nghiệm
a) Điều chế và tính chất của antimon hiđroxit Sb(OH)3:
Lấy vào 2 ống nghiệm, mỗi ống 2-3 giọt dung dịch SbCỈ3 0,2M. Thêm vào cả 2
ống nghiệm từ từ từng giọt dung dịch NaOH 2M và lắc đều đến khi xuất hiện kết tủa. Gạn
lấy kết tủa (dùng máy li tâm).
- Ống 1: Thêm từ từ từng giọt dung dịch HC1 2M và lắc đều.
- Ông 2: Thêm từ từ từng giọt dung dịch NaOH 2M và lắc đều.
Quan sát và giải thích hiện tượng xảy ra. Viết các phương trình phản ứng.
b) Điều chế và tính chất của bitmut hiđroxit Bi(OH)3*.
Tiến hành tương tự như trên nhưng thay dung dịch SbCỈ3 0,2M bằng dung dịch
Bi(NƠ3)3 0,2M (đánh số ống 3 và ống 4).
Quan sát và giải thích hiện tượng xảy ra. Viết các phương trình phản ứng.
So sánh tính chất của antimon hiđroxit Sb(OH)3 và bitmut hiđroxit Bi(0H)3?
TN8. Sự thuỷ phân của muối bitmut nitrat Bi(NƠ3)3
1. Hóa chất, dụng cụ
a- Hóa chất:
giấy q;
tinh thể bitmut nitrat Bi(NƠ3)3
b- Dụng cụ:
ống nghiệm:
mặt kính đồng hồ:
1
1
2. Cách tiến hành thí nghiệm
Lấy 1 tinh thể Bi(NO3)3 để lên mặt kính đồng hồ. Hồ tan bằng một vài giọt nước.
Xác định môi trường của dung dịch thu được bằng giấy quì.
Lấy vài tinh thê Bi(NƠ3)3 vào ống nghiệm, thêm nước vào dung dịch và lắc đều
cho tới khi tạo thành kết tủa.
Quan sát và giải thích hiện tượng xảy ra. Viết các phương trình phản ứng.
Rút ra nhận xét về sự thuỳ phân của muối bitmut nitrat Bi(NƠ3)3?
21
BÀI 3. NHÓM IVA - HIA - IIA - IA
TNI. Điểu chề và thử tính chất cùa khí cachonat COi
1.
Hóa chat, dụng cụ
a- Hóa chất:
đá vơi CaCOs;
mctyl da cam 0,1%;
axit clohiđric HCI lỗng;
natri hiđroxít NaOH 2M
I)- Dụng cụ:
ống nghiệm:
3
đèn cồn.
1
hình Kíp:
1
2. Cách tiến hành thi nghiệm
Cho axil HCI lỗng lác dụng với đá vôi CaCOi (phan ứng thực hiện trong bình Kíp
như hỉnh 5). Sục khí CO’ vào ống nghiệm chửa khống 1/3 nước cất trong vịng 2-3 phút
Nhó vào dung dịch thu dược này vài giọt chi thị mctyl da cam 0,1%. Quan sát màu của
dung dịch.
Giái thích và vici các phương trình phàn ứng?
1. Phèn rót chát lịng;
2. Binh trên;
ỉ. Bình dưới:
4. Khố ơng dần khí;
5. Miệng bình tháo chát
lóng sau phán ứng
Hình 5. Hình Kip
22
Chia dung dịch vừa thu được ở trên vào 3 ống nghiệm:
- Ong 1: Giừ nguyên đẽ so sánh.
- Óng 2: Đun sói
■ Ĩng 3: Thêm tử từ từng giọt dung dịch NaOH 2M và lắc đều
Quan sát hiện tượng vã giái thích. Viet các phương trinh phan ứng?
Giái thích vì sao trong thi nghiệm nãy lụi dùng dung dịch axit HCI lỗng?
TN2. Tính tan của muối cachonat
1.
Hóa chất, dụng cụ
a- Hóa chát:
khí CO’ (lấy ớ TN 1)
nước vơi trong Ca(Ol Ih;
b- Dụng cụ:
ống nghiệm:
1
đèn cồn:
I
hình Kíp:
1
2. Cách tiến hành thí nghiệm
Lây nước vơi trong vào khống 1/3 ơng nghiệm, sục khí co? (lây từ bình Kíp) vào
đáy ống nghiệm.
Quan sát sư tạo thành kct lúa trăng, tiếp tục sục khf co? vào, hiện tượng gì xay ra?
Đun nóng dung dịch thu dược, quan sát hiện tượng.
Giái thích và viết các phương trình phán ứng.
Rút ra nhận xét về tinh chất của muối cacbonat
TN3. Tính chất mi ít tan cua axil silicic
3a) Sự thúy phân cùa natri silicat Na’SiOl
1.
Hóa chất, dụng cụ
a- Hóa chất:
natri silicat Na’SiOl O.25M;
phenolphtalein 0.1 %
b- Dụng cụ: ống nghiệm: I
2.
Cách tiền hành thí nghiệm
Lấy vào ống nghiệm 2 - 3 giọt dung dịch NajSiOl 0.25M. Thêm vào 1 - 2 giọt chi
thị phenolphtalein 0.1% và lác đều. Nhận xét và giái thích sự thay đỏi màu cùa chất chi thị.
23
Giãi thích hiện tượng và viet các phương trinh phán ững thủy phân.
Rút ra nhận xét vẻ sự thuỹ phàn cùa muôi natri silicat Na’SiOi?
3hỊ Phàn ứng cứa natri silicat NaỉSiO.i vói một so mi
1.
Hóa chất, dụng cụ
a- Hóa chắt:
natri silicat Na?SiO> 0.25M;
sất (II) sunfat FeSOi 0.25M;
canxi clorua CaClỉ 0.25M.
coban (11) clonia CoCh 0.25M
b- Dụng cụ: õng nghiệm: 3
2.
Cách tiến hành thí nghiệm
Lấy vào 3 ống nghiệm, mỗi ống 2 - 3 giọt dung dịch Na>SiO> O.25M.
- Õng I: Thêm 2 - 3 giọt dung dịch CaCl’ O.25M và lác đều
- Óng 2: Thêm 2 - 3 giọt dung dịch FcSQi 0.25M và lầc đểu
- Óng 3: Thêm 2 - 3 giọt dung djch CoCh 0,25M vả lấc đều
Quan sát hiện tượng, viet các phương trình phan ứng xay ra.
Rút ra nhận xét vê tinh chãi của muối natii silicat NajSiOn?
TN4. Điểu chế và tính chất cua thiếc (II) hidroxit SnlOHh; chì hiđroxit Pb(OH)2
1.
Hóa chất, dụng cụ
a- Hóa chất:
mi Ihicc (lĩ) clorua 0.2M;
natri hiđroxit NaOH 2M;
muối chì (11) nitơrat 0.2M.
axil nitric HNO.I 2M
b- Dụng cụ:
óng nghiệm:
2.
máy h tâm
■
1
Cách lien hành thí nghiệm
Diêu chê các hidroxit Sn(OH)ỉ và PbtOHh từ các hố chất tương ứng:
Lây vào 2 ơng nghiệm:
- Ơng 1:2-3 giọt muối thiếc (II) clorua 0.2M
- Óng 2: 2 - 3 giọt muối chì (II) nitơrat 0.2M
Thèm vào cã 2 ống nghiệm từ từ lừng giọi dung dịch NaOil 2M và lác đêu đen khi
xuắt hiện kết lúa. Gạn lấy kết lùa (dùng máy li lâm).
24
b) Thứ tính chát của các hidraxit Sn(()H)ĩ và Phtott)-:
- Óng 1: Thêm tử từ từng giọt dung dịch I1NO1 2M và lác đều.
- Óng 2: Thèm tử từ từng giọt dung dịch NaOH 2M và lắc đều.
Quan sát và giai thích hiện tượng xây ra. Viet các phưong trinh phàn úng.
So sánh tính chất lưỡng tính cua Sn(OH)? và Pb(OH>2?
TN5. Tính khử của muối Sn2*
1. Hóa chất, dụng cụ
a- Hóa chat:
thiếc (II) clorua SnCh 0.2M.
natri hiđroxit NaOll 2M
bimut nitrat BitNO.O.i 0,2M;
h- Đụng cụ: õng nghiệm: I
2.
Cách tiền hành thí nghiệm
Lảy vào óng nghiệm 2 - 3 giọt dung dịch SnCh 0.2M.
Thêm lữ từ lững giọt dung dịch NaOH 2M vã lác đều cho đen khi kết lúa lan hết.
sau dó nhị dọc thành óng nghiệm 2-3 giọt dung dịch Bí(NOị)j O.2M.
Quan sát và giãi thích hiện tượng. Viết phương trình phan ứng
Rút ra kết luận ve tính khư cùa muối Sn2*?
TN6. Tính chất của chi iođua Pbh
1. Hóa chất, dụng cụ
a- Hóa chất:
kali iođua KI bào hỗ.
chi axetat PbíCHsCOO); 30%
b- Dụng cụ:
ống nghiệm:
máy li tâm
3
1
2. Cách tiến hành thí nghiệm
Lấy vào 3 ống nghiệm, mỗi ổng 2-3 giọt dung dịch chì axetal Pb(CHiCOO)’ 30%.
Thêm lir lừ từng giọt dung dịch KI bào hoà vào cả 3 ống nghiệm và lắc đều cho lới
khi kct tua hoàn toàn. Quan sát màu săc két tua. Gan lây kct tùa ờ ca 3 ơng nghiộm «dùng
máy li tâm)
- Ĩng 1: Sấy khơ kết lúa trên ngọn lưa đèn cồn.
25
Quan sát sự biến đôi mâu dần dần cùa Pbl_' khi đun nống vả khi đe nguội. Giãi
thích hiện tượng xáy ra.
- Óng 2: Thèm 3 - 5 giọt nưởc cắt vào rồi đun nông, sau đỏ đè nguội dần
Quan sát, giải thích hiện tượng xảy ra.
- Ồng 3: Them từng giọt KI bão hoà, vừa them vữa lắc cho tan hết kết tủa Thêm từ
lữ từng giọt nước cất vào dung dịch thu đưọc.
Quan sát vã giãi thích hiện tượng xây ra. Viet phương trinh phán ứng.
Rút ra kết luận về tính chất của iođua Pbl??
TN7. Tác dụng cùa kim loại kiêm vói nước
1. Hóa chắt, dụng cụ
a- Hóa chất:
natri Na kim loại;
canxi Ca kim loại;
kali K kim loại;
phenolphtalein 0,1%;
magie Mg kim loại;
amoni clorua NHíCl dộc
b- Dụng cụ:
dao
1
ống nghiệm:
2
kẹp Niken
1
chậu thúy tinh:
2
2. Cách tiến hành thí nghiệm
Dùng dao căt một miếng nhô Na vã K kim loại (chú ý không được dùng tay cam.
phái dùng kẹp niken đê lấy Na; K kim loại).
Quan sát ngay phần Na, K mõi cal xem có ánh kim cùa kim loại khơng?
Sau I đen 2 phút ánh kim có bị mõ đi khơng?
Sau dỏ bo miêng Na; K vào chậu nước. Quan sát hiện tượng. Thứ mòi trường bãng
chi thị phenolphtalein 0,1%.
Nêu các hiện tượng xây ra vã giái thích? Viết cãc phương trinh phàn ửng?
Tiến hành thí nghiệm tương lự với Mg, Ca (Mg và Ca bõ vào ống nghiệm).
Sau dó cho vào ống nghiệm đựng Mg vài giọt dung dịch NPLCl đặc và lấc đểu.
Quan sát hiện tượng xảy ra? Giai thích? Viet các phương trinh phán ứng'’
Rút ra kct luận vê lính chát cùa các kim loại kiêm vã kiêm thô2
*9
26