Khảo sát một số phương pháp phân tích phenol trong nước và bước đầu phân tích hàm lượng phenol trong một số nguồn thải
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.65 MB, 67 trang )
LỜI CẢM ƠN
Để hồn thành chương trình đào tạo ngành Khoa học mơi trường, khóa học
2013 – 2017, được sự nhất trí của Khoa quản lý tài nguyên rừng và môi trường –
Trường Đại học Lâm Nghiệp Việt Nam, em đã tiến hành thực hiện đề tài tốt nghiệp:
“Khảo sát một số phương pháp phân tích phenol trong nước và bước đầu
phân tích hàm lượng phenol trong một số nguồn thải”
Trong q trình thực hiện khóa luận, em đã nhận được sự giúp đỡ tận tình
của các thầy cơ giáo trong Khoa QLTNR & MT.
Nhân dịp hồn thành khóa luận, em xin bày tỏ lòng cảm ơn sâu sắc đến thầy
giáo Ths. Bùi Văn Năng, người đã tạo mọi điều kiện và tận tình hướng dẫn em thực
hiện đề tài này.
Em xin bày tỏ lòng cảm ơn đến các thầy cô giáo trong Khoa QLTNR &
MT, đặc biệt là các thầy cơ trong Trung tâm Phân tích mơi trường và ứng dụng
công nghệ địa không gian, đã giúp đỡ tận tình và tạo mọi điều kiện thuận lợi trong
suốt quá trình thực tập.
Cuối cùng tơi xin cảm ơn gia đình, người thân và toàn thể bạn bè đã động
viên, giúp đỡ tơi trong suốt q trình học tập và thực hiện khóa luận này.
Mặc dù bản thân đã có rất nhiều cố gắng, song do thời gian và năng lực có
hạn nên khóa luận khơng tránh khỏi những thiếu sót nhất định. Em rất mong nhận
được sự đóng góp, nhận xét của thầy cô giáo và các bạn bè để bài khóa luận hồn
thiện hơn.
Em xin chân thành cảm ơn!
Hà Nội, ngày 14 thàng 5 năm 2017
Sinh viên
Vũ Duy Khánh
TRƯỜNG ĐẠI HỌC LÂM NGHIỆP
KHOA QUẢN LÝ TÀI NGUYÊN RỪNG VÀ MƠI TRƯỜNG
TĨM TẮT KHĨA LUẬN TỐT NGHIỆP
Tên khóa luận: “Khảo sát một số phương pháp phân tích phenol trong nước và
bước đầu phân tích hàm lượng phenol trong một số nguồn thải”.
1. Sinh viên thực hiện: Vũ Duy Khánh
2. Giáo viên hướng dẫn: ThS. Bùi Văn Năng
3. Mục tiêu nghiên cứu
3.1. Mục tiêu chung
Làm cơ sở khoa học để đề xuất giải pháp nghiên cứu, phương pháp phân
tích hợp lý và hiệu quả nhằm đảm bảo chất lượng trong q trình phân tích đánh
giá chất lượng mơi trường
3.2. Mục tiêu cụ thể
- Khảo sát đánh giá được hiệu quả của một số phương pháp phân tích xác
định hàm lượng phenol trong nước và bước đầu áp dụng đánh giá hàm lượng phenol
trong một số nguồn thải.
- Đề xuất được phương pháp phân tích xác định hàm lượng phenol nhằm
nâng cao hiệu quả trong q trình phân tích đánh giá chất lượng môi trường.
4. Nội dung nghiên cứu
Để thực hiện được những mục tiêu đã đề ra khóa luận tiến hành nghiên cứu
những nội dung sau:
- Khảo sát một số phương pháp xác định hàm lượng phenol trong môi trường nước
Phương pháp so màu quang điện
Phương pháp sắc ký khí.
- Đánh giá hàm lượng phenol trong một số nguồn thải.
- Đề xuất phương pháp phân tích phenol phù hợp.
5. Những kết quả đạt được
Sau một khoảng thời gian nghiên cứu và xử lý số liệu khóa luận đã thu được
một số kết quả đáp ứng mục tiêu ban đầu của khóa luận đặt ra.
Kết quả khảo sát quá trình xây dựng đường chuẩn phenol trên các thiết bị
chưng cất khác nhau cho thấy, việc xây dựng đường chuẩn phenol thông qua thiết
bị chưng cất tự động UDK 139 cho phương trình có hệ số tương quan bằng 0,8382
rất thấp và không đáng tin cậy. Việc xây dựng đường chuẩn bằng thiết bị chưng cất
thủy tinh tuy thời gian chưng cất lâu nhưng lại đảm bảo độ tin cậy khi hệ số tương
quan là 0,9923 rất cao có thể tin cậy để tiến hành định lượng hàm lượng phenol.
Để đánh giá đầy đủ phương pháp đề tài đã tiến hành đánh giá độ thu hồi
của phương pháp chưng cất trên 2 thiết bị là thiết bị chưng cất tự động UDK 139
và thiết bị chưng cất thủy tinh. Kết quả cho thấy ở các lần tiến hành mẫu lặp đối
với mẫu nước cất và mẫu nước hồ thì thiết bị chưng cất thủy tinh cho độ thu hồi
cao hơn nhiều so với thiết bị chưng cất tự động. Độ thu hồi trung bình trên 2 mẫu
nước của thiết bị chưng cất thủy tinh đạt 88,3 % trong khi thiết bị chưng cất tự động
chỉ cho khoảng 58,35 %.
Đề tài đã xây dựng được đường chuẩn phenol trên thiết bị sắc ký khí với
đầu dị ion hóa ngọn lửa (GC/FID), kết quả xây dựng đường chuẩn cho thấy hệ số
tương quan mẫu bằng 0,9978 rất cao, các peak phenol được thể hiện rõ trên sắc ký
đồ ứng với từng mức nồng độ.
Việc khảo sát sự ảnh hưởng của quá trình tách chiết mẫu đến độ thu hồi của
phương pháp sắc ký khí cũng đã đưa đến kết luận, việc tiến hành q trình tách
chiết có ảnh hưởng lớn đến độ thu hồi của phương pháp, theo đó cần phải tiến hành
làm sạch mẫu trước khi tiến hành tách phenol ra khỏi mẫu để tiến hành phân tích.
Đề tài đã tiến hành khảo sát nồng độ phenol trên 4 loại nước thải, kết quả cho
thấy rằng nồng độ phenol trong nước thải dược phẩm có nồng độ rất cao 17,72 (mg/L),
nguy cơ gây ô nhiễm lớn nếu không được xử lý. Với các nguồn khác nồng độ phenol
có trong nước thải rất thấp. Điều này phù hợp với loại hình sản xuất của từng ngành.
Đề tài đã đề xuất phương pháp phân tích phenol phù hợp nhằm đảm bảo
các kết quả phân tích phản ánh đúng thực trạng môi trường.
MỤC LỤC
LỜI CẢM ƠN
MỤC LỤC
DANH MỤC CÁC TỪ VIẾT TẮT
DANH MỤC CÁC BẢNG
DANH MỤC CÁC HÌNH
ĐẶT VẤN ĐỀ ....................................................................................................... 1
CHƯƠNG 1 TỔNG QUAN NGHIÊN CỨU ........................................................ 3
1.1. Tổng quan về Phenol ...................................................................................... 3
1.1.1. Giới thiệu chung về phenol ......................................................................... 3
1.1.2. Nguồn gốc phát sinh ................................................................................... 4
1.1.3. Tính chất vật lý của một số hợp chất phenols ............................................. 4
1.1.4. Tính chất hóa học ........................................................................................ 5
1.1.5. Độc tính của phenol và các hợp chất của phenol ........................................ 6
1.1.6. Sự tồn tại và chuyển hóa của các hợp chất của phenol trong mơi trường .. 7
1.1.7. Ứng dụng của phenol .................................................................................. 8
1.2. Một số nghiên cứu về phenol trên thế giới và tại Việt Nam ......................... 9
1.2.1. Trên thế giới ................................................................................................ 9
1.2.2. Tại Việt Nam ............................................................................................. 10
1.3. Các phương pháp xác định phenol .............................................................. 11
1.3.1. Phương pháp so màu quang điện .............................................................. 11
1.3.2. Phương pháp sắc ký khí ............................................................................ 12
CHƯƠNG 2 MỤC TIÊU - ĐỐI TƯỢNG - NỘI DUNG - PHƯƠNG PHÁP
NGHIÊN CỨU .................................................................................................... 17
2.1. Mục tiêu nghiên cứu.................................................................................... 17
2.1.1. Mục tiêu chung .......................................................................................... 17
2.1.2. Mục tiêu cụ thể .......................................................................................... 17
2.2. Đối tượng nghiên cứu.................................................................................. 17
2.3. Nội dung nghiên cứu ................................................................................... 17
2.4. Phương pháp nghiên cứu............................................................................. 17
2.4.1. Phương pháp kế thừa tài liệu..................................................................... 17
2.4.2. Phương pháp bố trí nghiệm ....................................................................... 18
2.4.3. Phương pháp so sánh và xử lý số liệu ....................................................... 19
CHƯƠNG 3 THỰC NGHIỆM ........................................................................... 20
3.1. Khảo sát một số phương pháp phân tích xác định phenol trong mơi trường
nước ..................................................................................................................... 20
3.1.1. Khảo sát phương pháp so màu quang điện ............................................... 20
3.1.2. Khảo sát phương pháp sắc ký khí ............................................................. 26
3.2. Đánh giá nồng độ phenol trong một số nguồn thải ..................................... 31
CHƯƠNG 4 KẾT QUẢ NGHIÊN CỨU ............................................................ 33
4.1. Kết quả khảo sát phương pháp phân tích phenol bằng phương pháp so màu
quang điện ........................................................................................................... 33
4.1.1. Kết quả xây dựng đường chuẩn ................................................................ 33
4.1.2. Kết quả đánh giá độ thu hồi của các phương pháp chưng cất hàm lượng
Phenol .................................................................................................................. 37
4.2. Kết quả khảo sát phương pháp phân tích phenol bằng phương pháp sắc ký
khí đầu dị ion hóa ngọn lửa FID (GC/FID)........................................................ 46
4.2.1. Kết quả xây dựng đường chuẩn phenol trên máy sắc ký khí (GC/FID) ... 46
4.2.2. Đánh giá sự ảnh hưởng của thành phần nền mẫu và dung môi chiết đến độ
thu hồi của phương pháp sắc ký khí (GC/FID) ................................................... 50
4.3. Đánh giá nồng độ phenol trong một số nguồn thải ..................................... 52
4.4. Đề xuất giải pháp phân tích phenol phù hợp .............................................. 53
CHƯƠNG 5 KẾT LUẬN - TỒN TẠI - KIẾN NGHỊ ........................................ 54
5.1. Kết luận ....................................................................................................... 54
5.2. Tồn tại ......................................................................................................... 54
5.3. Kiến nghị ..................................................................................................... 55
TÀI LIỆU THAM KHẢO
PHỤ LỤC
DANH MỤC CÁC TỪ VIẾT TẮT
Tên đầy đủ
TT
Tên viết tắt
1
TCVN
2
EPA
Environmental Protection Agency
3
ĐC
Đường chuẩn
4
KTC
5
TC
Mẫu thêm chuẩn
6
FID
Flame-ionization derector
7
TCD
Thermal conductivity derector
8
GTGH
Tiêu chuẩn Việt Nam
Mẫu không thêm chuẩn
Giá trị giới hạn
DANH MỤC CÁC BẢNG
Bảng 3.1. Chương trình nhiệt độ máy sắc ký khí (GC/FID) ............................... 28
Bảng 4.1. Giá trị độ hấp thụ quang đo được của các mẫu không qua chưng cất ứng
với các nồng độ ................................................................................................... 33
Bảng 4.2. Giá trị độ hấp thụ quang đo được của các mẫu qua chưng cất bằng thiết
bị tự động UDK 139 ứng với các nồng độ .......................................................... 34
Bảng 4.3. Giá trị độ hấp thụ quang đo được của các mẫu qua chưng cất bằng bộ
chưng cất thủy tinh ứng với các nồng độ ............................................................ 36
Bảng 4.4. Độ thu hồi của phương pháp chưng cất sử dụng thiết bị tự động UDK
139 đối với mẫu nước cất .................................................................................... 38
Bảng 4.5. Độ lệch chuẩn tương đối thu được tiến hành trên thiết bị chưng cất bán
tự động đối với mẫu nước cất.............................................................................. 39
Bảng 4.6. Độ thu hồi của phương pháp chưng cất được tiến hành trên thiết ..... 40
bị chưng cất thủy tinh đối với mẫu nước cất ....................................................... 40
Bảng 4.7. Độ lệch chuẩn tương đối thu được tiến hành trên thiết bị chưng cất thủy
tinh đối với mẫu nước cất .................................................................................... 41
Bảng 4.8. Độ thu hồi của phương pháp chưng cất sử dụng thiết bị bán tự động
UDK 139 đối với mẫu nước hồ ........................................................................... 41
Bảng 4.9. Độ lệch chuẩn tương đối thu được tiến hành trên thiết bị chưng cất bán
tự động đối với mẫu nước hồ .............................................................................. 42
Bảng 4.10. Độ thu hồi của phương pháp chưng cất được tiến hành trên thiết bị
chưng cất thủy tinh đối với mẫu nước hồ ........................................................... 43
Bảng 4.11. Độ lệch chuẩn tương đối thu được tiến hành trên thiết bị chưng cất
thủy tinh đối với mẫu nước hồ ............................................................................ 44
Bảng 4.12. Kết quả đánh giá tổng hợp đối với phương pháp chưng cất bán tự động
trên thiết bị UDK 139 và bộ chưng cất thủy tinh ................................................ 45
Bảng 4.13. Kết quả đo diện tích peak với mỗi mức nồng độ tương ứng của dãy
dung dịch chuẩn .................................................................................................. 49
Bảng 4.14. Độ thu hồi của phương pháp sắc ký khí sử dụng dung mơi chiết n –
Hecxan ................................................................................................................. 50
Bảng 4.15. Độ thu hồi của phương pháp sắc ký khí sử dụng dung môi chiết
Diclometan .......................................................................................................... 51
Bảng 4.16. Giá trị nồng độ phenol phân tích được trong một số nguồn thải ...... 52
DANH MỤC CÁC HÌNH
Hình 1.1. Cơng thức cấu tạo của phenol. ........................................................ 3
Hình 1.2. Mơ phỏng q trình gây độc của phenol trong nước biển ............ 10
Hình 1.3. Sơ đồ máy sắc ký khí GC ............................................................. 13
Hình 1.4. Mơ hình mơ phỏng derector ion hóa ngọn lửa FID ...................... 14
Hình 3.1. Thiết bị chưng cất đạm bán tự động UDK 139 của hãng Velp .... 21
Hình 3.2. Sơ đồ bố trí thí nghiệm bộ chưng cất thủy tinh ............................ 22
Hình 3.3. Quá trình tách chiết phenol ........................................................... 23
Hình 3.4. Sơ đồ bố trí thí nghiệm đánh giá độ thu hồi của phương pháp chưng
cất .................................................................................................................. 24
Hình 3.5. Máy sắc ký khí .............................................................................. 28
Hình 3.6. Máy chưng cất quay chân khơng .................................................. 30
Hình 4.1. Biểu đồ đường chuẩn Phenol khơng qua chưng cất. .................... 34
Hình 4.2. Biểu đồ đường chuẩn Phenol qua chưng cất bằng thiết bị chưng cất
tự động UDK 139 .......................................................................................... 35
Hình 4.3. Đường chuẩn Phenol qua chưng cất bằng bộ chưng cất thủy tinh.36
Hình 4.4. Sắc ký đồ của phenol trong n- Hecxan có nồng độ 10 ppm.
(GC/FID) ....................................................................................................... 47
Hình 4.5. Sắc ký đồ của phenol trong n- Hecxan có nồng độ 100 ppm.
(GC/FID) ....................................................................................................... 48
Hình 4.6. Biểu đồ đường chuẩn phenol xây dựng trên thiết bị sắc ký khí đầu
dị ion hóa ngọn lửa (GC/FID) ...................................................................... 49
Hình 4.7. Biểu đồ hiệu suất thu hồi phenol đối với từng dung môi chiết .... 52
ĐẶT VẤN ĐỀ
Ở nước ta hiện nay các ngành công nghiệp đang phát triển mạnh đã làm
nguồn nước bị ô nhiễm nghiêm trọng, ảnh hưởng vô cùng lớn đến sức khỏe con
người và toàn bộ hệ sinh thái. Phenol và các hợp chất của phenol tồn tại trong môi
trường nước do các nhà máy sản xuất các sản phẩm chế biến từ hạt điều, nhựa,
luyện kim, gang thép, giấy hoặc do sự phân hủy của các hợp chất thuốc trừ sâu là
nguồn phát chính phenol vào trong mơi trường.
Các nhà sản xuất luôn mong muốn kết tinh trong mỗi sản phẩm của mình
khơng chỉ có cơng nghệ sản xuất hiện đại, quy trình quản lý tiên tiến mà cịn phải
có phần trách nhiệm với môi trường. Tuy nhiên để đạt được điều này địi hỏi phải
có sự đầu tư quy trình sản xuất hiện đại, ít gây ơ nhiễm mơi trường, ít phát sinh
các chất độc hại hoặc có phương pháp xử lý chất thải hiệu quả, chi phí hợp lý để
đảm bảo giá thành sản phẩm có khả năng cạnh tranh trên thị trường. Trong tình
hình kinh tế hiện nay, đây là vấn đề hết sức khó khăn đối với mỗi doanh nghiệp,
đặc biệt là các doanh nghiệp mà trong quy trình sản xuất thường xuyên phải thải ra
các chất hữu cơ độc hại, khó phân hủy như phenol, các dẫn xuất phenol hay các
hợp chất hữu cơ khác. Thực tiễn đã chứng minh khi năm 2016 thảm họa sinh thái
biển Việt Nam diễn ra tại 4 tỉnh miền Trung mà một trong số nguyên nhân chính
gây ra là phenol có trong nước thải phát sinh trong q trình luyện cốc của Công ty
Hưng Nghiệp gang thép Formosa Hà Tĩnh.
Cho đến nay cũng đã có rất nhiều cơng trình nghiên cứu về khả năng xử
lý chất ô nhiễm của các phụ phẩm, phế phẩm nông nghiệp như xơ dừa, lục bình,
vỏ lạc, bã cà phê, mùn cưa, chitin. Tuy nhiên việc nghiên cứu và đánh giá phương
pháp phân tích thì cịn rất hạn chế, thực tế hiện nay cho thấy rằng sự thừa nhận
các kết quả phân tích theo một quy trình cho trước mà khơng có sự kiểm sốt
trong phương pháp phân tích, các dụng cụ và thiết bị phân tích chưa được kiểm
nghiệm chặt chẽ về mức độ phù hợp với chất phân tích khiến cho các kết quả phân
tích chưa thực sự đánh giá đúng hiện trạng môi trường.
1
Từ sự cấp thiết của những vấn đề nêu trên, đề tài “Khảo sát một số phương
pháp phân tích phenol trong nước và bước đầu phân tích hàm lượng phenol
trong một số nguồn thải” được lựa chọn và tiến hành thực hiện.
2
CHƯƠNG 1
TỔNG QUAN NGHIÊN CỨU
1.1. Tổng quan về Phenol
1.1.1. Giới thiệu chung về phenol
Phenol là những hợp chất hữu cơ trong phân tử có nhóm OH liên kết trực
tiếp với ngun tử C vịng benzen. Để lâu ngồi khơng khí, phenol bị oxi hóa một
phần nên có màu hồng và bị chảy rữa do hấp thụ hơi nước. Phenol ít tan trong
nước lạnh, tan trong một số hợp chất hữu cơ. Phenol và các dẫn chất như cresyl
(acid cresylic) là những chất rất thơng dụng trong cơng nghiệp (hố hữu cơ, chất
dẻo, hoá dược) và dễ tẩy uế, sát khuẩn (dung dịch 1%), [4],[6].
Hình 1.1. Cơng thức cấu tạo của phenol.
Phenol và các dẫn xuất của phenol là hợp chất hữu cơ có tính rất độc, gây
bỏng nặng khi rơi vào da. Phenol và các dẫn xuất của phenol là các chất độc hại
gây nguy hiểm cho sức khoẻ con người và mọi sinh vật sống. Trên góc độ mơi
trường phenol và các dẫn xuất của phenol được xếp vào loại chất gây ơ nhiễm.
Đây là nhóm tương đối bền, có khả năng tích luỹ trong cơ thể sinh vật và có khả
năng gây nhiễm độc cấp tính, mãn tính cho con người. Khi xâm nhập vào cơ thể
các phenol nói chung và Clophenol nói riêng gây ra nhiều tổn thương cho các cơ
quan và hệ thống khác nhau nhưng chủ yếu là tác động lên hệ thần kinh, hệ thống
tim mạch và máu. Liều nguy hiểm: từ 2 – 5 gam. Liều gây chết: trên 10gam. Tác
dụng ăn mòn tại chỗ và ức chế chuyển hố.
Phenol có nhiều dẫn xuất phụ thuộc vào nhóm gắn lên vịng nhân thơm.
Theo tổ chức bảo vệ môi trường của Mỹ - (EPA) hiện có 11 hợp chất phenol gây
ơ nhiễm mơi trường chủ yếu hiện nay là: 4-Cloro-3-Methylphenol, 2-Clorophenol,
2,4-Dimethylphenol,
2,4-Dinitrophenol,
3
2-Methyl-4,6-Dinitrophenol,
2-
Nitrophenol, 4-Nitrophenol, Pentaclorophenol, 2,4,6-Triclorophenol và phenol,
[11],[10],[12].
1.1.2. Nguồn gốc phát sinh
1.1.2.1. Nguồn gốc tự nhiên
Trong tự nhiên phenol và các clophenol được phát hiện trong chất thải
động vật, là chất nội sinh trong ruột từ sự trao đổi chất của các axit amin thơm.
Một số được phát hiện trong môi trường có nguồn gốc từ các nhựa cây, nhựa than
đá. Trong nhựa cây các sản phẩm phenol được tìm thấy thơng qua q trình phân
hủy các hợp chất thiên nhiên có cấu trúc khác nhau bằng con đường vi sinh vật.
Trong than, hàm lượng phenol được tìm thấy trong than antraxit lên đến 0,001 %.
Ở một số loài sinh vật như nấm penicilium phát hiện thấy 2,4 – diclophenol. Hàm
lượng lớn clophenol được phát hiện trong mơi trường có nguồn gốc xuất phát từ
tự nhiên, [11],[13].
1.1.2.2. Nguồn gốc nhân tạo
Phenol được phát hiện vào năm 1834 từ đó mà phenol và các dẫn xuất của
phenol như clophenol bắt đầu được áp dụng rộng rãi vào trong quá trình sản xuất
của các ngành, lĩnh vực khác nhau.
Ngành công nghệp nặng: công nghiệp gang thép, công nghiệp mạ, luyện
kim. Phenol là sản phẩm thứ cấp từ các quá trình luyện cốc sinh ra.
Ngành công nghiệp dược phẩm: Phenol là thành phần dùng để điều chế
Aspirin (hay axit acetylsalicilic hay axit 2- acetoxi benzoic) làm giảm đau và chữa
huyết phổi… việc sử dụng để sản xuất đã tăng quá trình sản xuất phenol cung cấp
cho các ngành cơng nghiệp dược phẩm, [11],[13].
1.1.3. Tính chất vật lý của một số hợp chất phenols
Phenol, tên khác là Carbolic Acid, Benzenol, Phenylic Acid,
Hydroxybenzene, Phenic acid, là tinh thể khơng màu, có mùi đặc trưng, ít tan
trong nước lạnh, tan vô hạn ở 66°C, tan tốt trong dung mơi hữu cơ. Ngồi những
đặc điểm trên Phenol cịn mang một số tính chất vật lý khác như:
- Khối lượng phân tử: 94,11 g/mol.
4
- Màu: không màu đến màu hồng nhạt.
- Điểm sôi: 182ᵒC.
- Điểm nóng chảy: 42ᵒC.
- Nhiệt độ tới hạn: 694,2ᵒC.
- Trọng lượng riêng: 1,057.
- Tỉ trọng bay hơi: 3,24.
- Ngưỡng mùi: 0,048 ppm.
Khi để lâu ngồi khơng khí, phenol chảy rữa do hấp thụ hơi nước và bị oxi
hóa một phần nên tạo thành chất lỏng có màu hồng.
1.1.4. Tính chất hóa học
Tính axit yếu
Phenol có hiệu ứng cộng hưởng xảy ra trong phân tử, nhóm phenyl hút e
mạnh làm liên kết O-H phân cực tạo nên tính axit yếu của phenol. Tuy nhiên, tính
axit của phenol rất yếu pKa=9,75 nên khơng làm đổi màu quỳ tím.
Phenol tác dụng với bazơ mạnh tạo muối phenolat (VD: natri phenolat):
C6H5OH + NaOH ---> C6H5ONa + H2O
Phenol có tính axit yếu hơn axit cacbonic (CO2) nên muối phenolat phản
ứng với axit cacbonic tạo lại phenol. Phản ứng này được dùng để tái tạo phenol
trong công nghiệp:
C6H5ONa + CO2 + H2O ---> C6H5OH + NaHCO3
Tính chất như ancol:
Phenol có thể tác dụng được với Na như ancol nhưng khác ở chỗ là tạo
muối phenolat không bị thủy phân:
2C6H5OH + 2Na --> 2C6H5ONa + H2
C6H5ONa + H2O --không phản ứng-Do hệ liên hợp của nhóm OH với vịng thơm làm mật độ điện tích âm của
O nhóm -OH giảm hơn so với O nhóm -OH của ancol thơng thường và hiệu ứng
khơng gian cản trở của vịng thơm nên phenol khó tấn cơng vào phân tử axit tạo
5
este. Vì vậy phenol chỉ tạo được este khi tác dụng với clorua axit hoặc anhiđrit
axit:
C6H5OH + CH3COCl ---> CH3COOC6H5 + HCl
C6H5OH + (CH3CO)2O ---> CH3COOC6H5 + CH3COOH
Phản ứng thế H ở vịng Benzen (Tính chất của nhân thơm)
Phenol phản ứng với dung dịch brom tạo kết tủa trắng, nếu Br2 dư cũng
tạo kết tủa trắng.
Phenol phản ứng với HNO3 tạo kết tủa vàng (axit picric), [13].
1.1.5. Độc tính của phenol và các hợp chất của phenol
Độc cấp tính: Người sau khi nhiễm phenol ở liều lượng cao thường có
những biểu hiện nhiễm độc cấp tính như sau:
Gây tổn thương hệ thần kinh ngoại vi (phá hủy bao myelin của sợi trục
thần kinh). Làm biến chất Protein.
Sự ngộ độc tồn thân có thể xảy ra khi tiếp xúc trực tiếp với lượng nồng
độ lớn phenol thông qua 3 con đường tiếp xúc. Thơng thường, sự kích thích hệ
thần kinh trung ương xảy ra nhanh sau đó hệ thần kinh này suy giảm nhanh chóng.
Hệ quả của sự tổn thương hệ thần kinh này là tử vong. Tuy nhiên nếu sự ngộ độc
xảy ra ở các cơ quan khác, triệu chứng có thể bị trì hỗn đến 18 giờ.
Một số triệu chứng:
Đối với tim mạch: việc sảy ra ngộ độc phenol có thể làm tăng huyết áp,
sau đó huyết áp thấp dần và bị sốc. Ngồi ra cóng có triệu chứng rối loạn nhịp
tim.
Ở hệ thần kinh: sự ngộ độc phenol dẫn đến các triệu chứng như buồn nơn, ói mửa,
nhức đầu, hịa mắt, chóng mặt và ù tai. Sau đó có thể rơi vào trạng thái mất kiểm
sốt, hơn mê dẫn đến sự suy giảm hô hấp và tử vong
Đường hô hấp: tiếp xúc ở nồng độ cao sẽ gây sưng cổ họng, viêm và lt
khí quản. Ngồi ra, phenol nặng hơn khơng khí nên khi đi vào phổi sẽ hóa lỏng
và khơng bay ra.
6
Đường tiêu hóa: ngồi triệu chứng buồn nơn, ói mửa như đề cập ở trên, sự
tiếp xúc với phenol qua đường tiêu hóa có thể dẫn đến viêm loét cổ họng, dạ dày và
thực quản.
Đối với hệ tuần hoàn máu: hầu hết là các thay đổi huyết học (như tán
huyết, ức chế tủy xương và thiếu máu có thể được quan sát rõ ràng khi tiếp xúc
với phenol.
Ngoài ra phenol cịn gây bỏng mắt, viêm mắt.
Với các mơ biểu bì (da): sự ngộ độc phenol có thể gây ra các triệu chứng
chết tế bào da (hoại tử). Tuy nhiên do đặc tính gây tê nên rất khó cảm nhận được
cơn đau trong thời gian ngắn, có thể dẫn đến tử vong, [12],[22],[23].
Độc mãn tính: việc tiếp xúc với phenol trong thời gian dài tại khu vực làm
việc hoặc sinh sống trong khu vực có nồng độ phenol cao có thể gây tổn thương
một số cơ quan trong cơ thể như:
Thận: viêm thận, sưng ở ống thận và các tế bào, thối hóa ở cầu thận.
Da: thay đổi sắc tố da (hoại tử) có thể xảy ra như đã nêu ở trên.
Máu: tăng nguy cơ các bệnh động mạch vành và thiếu máu cung cấp cho
tim ở những người tiếp xúc với phenol trong thời gian dài chủ yếu là những người
lao động. Phenol không được phân loại như một tác nhân có thể gây ung thư
nhưng lại được biết đến như một chất hoạt hóa cho các khối u phát triển, [23].
1.1.6. Sự tồn tại và chuyển hóa của các hợp chất của phenol trong môi trường
Phenol đi vào trong mơi trường đất, nước và khơng khí là kết quả của các
quá trình tự nhiên và các hoạt động của con người.
Trong mơi trường đất: Phenol được tìm thấy chủ yếu nhờ q trình sa lắng
bao gồm sa lắng khơ và sa lắng ướt. Trong đất thì cả 2 loại vi sinh vật đất hiếu khí
và kỵ khí đều có khả năng sử dụng phenol như một chất nền tăng trưởng, tuy
nhiên khả năng phân hủy phenol nhanh thường thấy ở các lồi sinh vật hiếu khí.
Sự tồn tại của phenol trong môi trường đất thường từ 2 đến 5 ngày.
Trong môi trường nước: Phenol đi vào môi trường nước qua hoạt động xả
thải trực tiếp của các nguồn công nghiệp, sa lắng từ khơng khí, ngấm từ đất vào
7
nguồn nước ngầm. Phenol trong nước có thể tồn tại trong nước 1 tuần, hoặc nhiều
hơn. Mặt khác phenol liên kết theo kết tủa sắt (III) hình thành trầm tích lắng đọng.
Phenol trong mơi trường nước có khả năng gây độc cao, có thể thấy như sự kiện
tháng 6 năm 2016. Công ty gang thép Hưng Nghiệp Formosa Hà Tĩnh đã gây ra
thảm họa nghiêm trọng về hệ sinh thái biển Việt Nam nguyên nhân là do trong
quá trình luyện cốc đã sinh ra các chất độc như Xyanua và Phenol. Các chất này
đã đi theo đường nước thải và gây nên hiện tượng cá chết hàng loạt tại 4 tỉnh Miền
Trung.
Phenol trong khơng khí: Phenol đi vào mơi trường khơng khí qua khí thải
của các ngành cơng nghiệp sản xuất, sử dụng và xử lý sản phẩm có chứa phenol
và sự phân hủy của thực vật. Phenol tồn tại trong khơng khí trong vịng 1,5 đến 2
ngày nó khơng di chuyển xa trong bầu khí quyển do bị loại bỏ khỏi bầu khí quyển
bằng phản ứng oxy hóa với hydroxyl và gốc nitrat, quang phân, lắng đọng ướt và
khô.
1.1.7. Ứng dụng của phenol
Phenol và các dẫn xuất của nó được ứng dụng rộng rãi trong sự phát triển
của loài người. Được tìm ra vào năm 1834 phenol đã được đưa vào sử dụng trong
các nghành:
Công nghiệp chất dẻo: phenol là nguyên liệu để điều chế nhựa phenol
formaldehyde.
Công nghiệp tơ hóa học: Từ phenol tổng hợp ra tơ polyamide.
Nông dược: Từ phenol điều chế được chất diệt cỏ dại và kích thích tố
thực vật 2,4 - D (là muối natri của axit 2,4 điclophenoxiaxetic).
Phenol cũng là nguyên liệu để điều chế một số phẩm nhuộm, thuốc
nổ (axit picric).
Do có tính diệt khuẩn nên phenol được dùng để trực tiếp làm chất sát
trùng, tẩy uế, được sử dụng bởi Sir Joseph Lister (1827-1912). Hoặc để điều chế
các chất diệt nấm mốc (ortho - và para - nitrophenol…)
8
Phenol cũng là thành phần hoạt chất trong một số thuốc giảm đau đường
uống như Chloraseptic, Axit salicilic (axit 2- hidroxi benzoic) được dùng làm
thuốc giảm đau, hạ nhiệt và chống viêm, đường xơng hơi (phun) như Carmex. Nó
cũng là thành phần chính của quả cầu khói Carbolic Ball, một thiết bị trên thị
trường tại London vào thế kỷ 19 sử dụng để chống dịch bệnh cúm và các bệnh
khác, [13].
Vì rẻ tiền, dễ điều chế, gây ra cái chết nhanh chóng và êm dịu chỉ với 10
gram, phenol được sử dụng như một phương tiện giết người của Đức quốc xã
trong thế chiến thứ hai vào năm 1939 vào những ngày cuối cùng của cuộc chiến.
Thời kỳ đó, Zyklon-B, một phát minh bởi Gerhard Lenz, được sử dụng trong các
phịng hơi ngạt để tiêu diệt các nhóm lớn của người dân, phát xít Đức cịn dùng
phenol tiêm cho từng nạn nhân để sát hại nhóm ít người như một biện pháp tiết
kiệm kinh tế. Việc tiêm Phenol được áp dụng lên hàng ngàn người dân trong các
trại tập trung, đặc biệt là ở Auschwitz-Birkena.
1.2. Một số nghiên cứu về phenol trên thế giới và tại Việt Nam
1.2.1. Trên thế giới
Trên thế giới đã có nhiều nghiên cứu về phenol cũng như nghiên cứu xử
lý nguồn thải nhiễm phenol đã đạt được như sử dụng công nghệ màng lọc sinh
học trong xử lý ô nhiễm phenol trong nước (theo Lin J., Reddy M., Moorthu V.,
Qoma B.E, Đại học KwaZulu – Natal).
Theo nghiên cứu và cuộc điều tra về sự có mặt và ảnh hưởng của phenol
ảnh hưởng đến sức khỏe người dân dọc con sông Dzierzejzna (miền trung Balan),
kết quả điều tra cho thấy nồng độ các hợp chất phenol trong nước từ 0,01 đến 2
µg/L [18].
Năm 2004 một cuộc điều tra khác được tiến hành tại Nga (Czukczi, địa phương
Uelan) gần vùng Bắc Cực [19]. Đã tiết lộ nồng độ trung bình của
Pentachlorophenol (PCP) trong huyết tương của người là 0,64 µg/L.
Một vài nghiên cứu khác trên thế giới như: Theo nghiên cứu đánh giá sự
hiện diện của ankylphenol trong mẫu cá thu thập từ sông kalamazoo (Michigan,
9
USA) cho thấy nồng độ ankylphenol trên thể là 3,4 µg/Kg [20]. Một nghiên cứu
khác được thực hiện tại biển Baltic chỉ ra sự tích tụ các nonylphenol trong các mô
của nhuyễn thể - Dreissena Plymorpha và Mytilus edulius lên đến 112 µg/Kg thể
trọng [21].
1.2.2. Tại Việt Nam
Theo báo cáo hiện trạng môi trường lưu vực sông Srepok năm 2013
(tr23,24). Hàm lượng Phenol trong nước dưới đất thay đổi từ 0,1 đến 1,9 µg/l,
trung bình 0,6 µg/l. Trong tổng số 177 mẫu phân tích có 5 mẫu (chiếm 2,8%) vượt
GTGH. Kết quả phân tích của 5 mẫu có hàm lượng Phenol vượt quá GTGH cho
phép thuộc “Đề án Điều tra nguồn nước dưới đất ở một số vùng trọng điểm tỉnh
Đăk Lăk”: 3 mẫu ở xã Dliê Yang – Ea H’leo (0,3 – 1,9 µg/l), một mẫu ở xã Cư
Pơng – Krơng Buk (1,124 µg/l), một mẫu ở xã Ea H’Đỉng – CưM’gar (1,9 µg/l).
Tuy nhiên, hàm lượng của chúng chỉ vượt chút ít so với GTGH cho phép (1 µg/l).
Sự kiện nổi bật năm 2016 liên quan đến sự cố môi trường biển Việt Nam
do công ty Hưng Nghiệp gang thép Formosa gây ra ô nhiễm thu hút gần 100 nhà
khoa học trên thế giới. Kết quả điều tra cho thấy trong nước thải của nhà máy
Formosa có chứa hàm lượng lớn độc tố cyanua và phenol, các chất này kết hợp
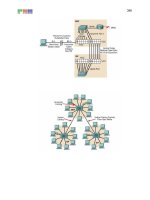
với phức sắt ở dạng keo (Mixel) [15]. Q trình gây cá chết được mơ phỏng như
hình sau:
Hình 1.2. Mơ phỏng q trình gây độc của phenol trong nước biển
(Nguồn: Internet)
10
Theo ước tính nếu lượng nước thải của nhà máy Formosa khơng được xử
lý thì mỗi ngày sẽ có khoảng 1 tấn phenol được đổ ra biển. [16]
Hậu quả của nó đã ảnh hưởng đến hơn 100000 người có thu nhập thấp, phá hủy
hệ sinh thái biển của 4 tỉnh miền trung, khiến hơn 350 ha tôm nuôi và 1613 lồng
nuôi cá bị chết. Hải sản tồn kho, không tiêu thụ được với số lượng rất rất lớn. [15].
1.3. Các phương pháp xác định phenol
Phenol trong môi trường tồn tại ở nhiều các dẫn xuất khác nhau, tuy nhiên
với khả năng bay hơi ở nhiệt độ khoảng 60ᵒC do đó mà việc xác định nồng độ
phenol trong môi trường đất, nước và mơi trường khơng khí cũng gặp nhiều khó
khăn do q trình phân hủy phenol trong mơi trường. Do đó việc áp dụng các
phương pháp vào trong q trình phân tích xác định hàm lượng phenol để chỉ ra
ưu và nhược điểm của từng phương pháp để lựa chọn được phương pháp thích
hợp nhất để xác định hàm lượng phenol trong môi trường.
1.3.1. Phương pháp so màu quang điện
Cơ sở khoa học của phương pháp: Là phương pháp phân tích quang học
dựa trên sự tương tác chon lọc giữa chất cần xác định với năng lượng bức xạ thuộc
vùng tử ngoại, khả kiến hoặc hồng ngoại.
Nguyên tắc của phương pháp: Tách các chất phenol khỏi tạp chất và chất
bảo quản mẫu bằng chưng cất. Vì tốc độ bay hơi của các hợp chất phenol chậm
nên thể tích phần cất phải bằng thể tính mẫu đem chưng cất. Cho các hợp chất phenol
chưng cất được phản ứng với 4-aminoantipyrin ở pH 10,0 ± 0,2 khi có mặt kali
hexexyanoferat (III) để tạo phẩm màu antityrin. Chiết phẩm màu này bằng clorofom,
rồi đo độ hấp thụ ở 450 nm. Chỉ số phenol được biểu thị bằng miligam phenol trong
lít, [2],[7].
Phạm vi áp dụng của phương pháp: phương pháp này cho phép xác định
chỉ số phenol khoảng từ 0,002 mg/l đến khoảng 0,10 mg/l.
Lĩnh vực áp dụng: Phương pháp này được áp dụng dùng để xác định hàm
lượng phenol tổng số ở trong nước mặt, nước uống và nước thải công nghiệp.
- Ưu, nhược điểm của phương pháp:
11
Ưu điểm:
- Giới hạn phát hiện thấp (0,002 mg/l) điều này đáp ứng được các mẫu có
hàm lượng phenol thấp.
- Độ chính xác cao.
- Sử dụng để phân tích phenol tổng số
Nhược điểm:
- Mẫu phân tích có thể bị nhiễu dẫn đến kết quả khơng chính xác, điều này
phụ thuộc vào quá trình chiết và chưng cất mẫu.
- Thời gian phân tích lâu.
- Cần sử dụng các thiết bị hiện đại.
- Chất dùng chiết là dung môi dễ bay hơi và độc.
- Cần chất phản ứng tạo phức màu chọn lọc với chất cần phân tích.
1.3.2. Phương pháp sắc ký khí
1.3.2.1. Cơ sở lý thuyết
Sắc ký khí là phương pháp phân tách trong đó pha động là khí trơ (cịn gọi
là khí mang) và pha tĩnh là chất rắn (hoặc một lớp phim mỏng được phủ lên thành
chất mang rắn) được phủ lên bề mặt trong của cột sắc khí. Phương pháp sắc ký
khí dùng để phân tích các chất có khả năng bay hơi, [5].
Dung dịch mẫu thử sau khi tiêm vào máy sẽ hóa hơi. Đám hơi này được
thổi vào dịng khí mang và chuyển tới lò cột. Sự tương tác hấp phụ giữa các thành
phần hóa học trong dịng khí (cả khí mang lẫn đám hơi mẫu thử) với pha tĩnh sẽ
quyết định sự phân tách các hợp chất khác nhau trong hỗn hợp. Những chất có sự
tương tác khác nhau sẽ có thời gian lưu trong cột khác nhau, đây là một trong các
yếu tố giúp nhận danh chất phân tích (kết hợp so sánh thời gian lưu với đường
chuẩn của cùng chất phân tích). Sau khi ra khỏi cột, chất phân tích sẽ được đưa
tới đầu dò. Tại đây bộ phận xử lý tín hiệu sẽ ghi nhận nồng độ chất phân tích dười
dạng các tín hiệu (tùy vào từng loại đầu dị mà phương pháp ghi nhận tín hiệu sẽ
khác nhau).
12
1.3.2.2. Sơ đồ khối và nguyên tắc hoạt động của sắc ký khí
Hình 1.3. Sơ đồ máy sắc ký khí GC
Nguồn khí (bình chứa dung mơi pha động): nơi chứa hơi pha động là khí
trơ, khơng tương tác với chất phân tích trong mẫu.
Thiết bị đầu vào: Bộ phận bơm mẫu (auto sampler) sẽ đưa mẫu chứa
phenol vào thiết bị hóa hơi. tại đây dung dịch mẫu sẽ được hóa hơi và chuyển vào
dịng khí mang pha động (khí trơ) để đưa đến cột.
Lò cột: Tại đây các chất phân tích khác nhau có trong mẫu được phân tách
dựa trên sự khác biệt về sự tương tác đối với pha tĩnh (dạng lỏng được phủ lên bề
mặt chất mang rắn).
Đầu dò: Xác định và đo lường nồng độ phenol dựa trên tín hiệu của nó.
loại tín hiệu của phenol tùy thuộc vào loại derector sử dụng và phương pháp phân
tích. Một trong số derector chính sử dụng trong phân tích phenol là: Derector ion
hóa ngọn lửa FID (Flame-ionization derector), [8].
- Nguyên tắc hoạt động:
Dựa trên sự biến đổi độ dẫn điện của ngọn lửa được tạo bởi hộn hợp khí H2 và
O2 trong khơng khí (nguồn ion hóa) và được đặt trong một điện trường (buồng điện
cực).
13
Khí mang sau khi rời khỏi cột đi qua nguồn ion hóa vào buồng điện cực. Ở
đó chúng bị bắn phá bởi các chùm hạt electron tạo thành các hạt tích điện (ion
dương và ion âm, electron). Sự tạo thành các hạt tích điện như vậy tạo nên dịng
điện giữa 2 bản điện cực. Dòng điện này đi qua điện trở đo R. Sự rơi thế E0 qua
điện trở R sẽ được khuếch đại rồi đưa đến máy ghi lại sự thay đổi đó (sắc ký đồ).
Đường nền được sinh ra do dịng khí mang với thành phần và tốc độ ổn
định. để giảm thiểu dòng này người ta sử dụng một dịng điện bổ chính.
Khi khí mang mang theo các phân tử chất cần phân tích, các phân tử này bị ion
hóa và dịng điện cực tăng lên. Các tín hiệu được ghi lại dưới dạng các peak.
Hình 1.4. Mơ hình mơ phỏng derector ion hóa ngọn lửa FID
- Đặc điểm:
Khơng bị ánh hưởng bởi vận tốc khí mang.
Thời gian chỉ tín hiệu nhở hơn 0,1 giây và có độ nhạy gấp 1000 derector
TCD.
Giới hạn phát hiện dưới 10-12 (g/s).
Tuy nhiên cũng có những điểm bất lợi là phải dùng thêm hệ thống khí đốt,
ngồi khí mang khơng được dùng các khí như SO2, CO2, H2O, NOx.
Bên cạnh đó ngoài ra cấu tử mẫu bị phân hủy trong ngọn lửa nên không thể
dùng trong trường hợp muốn cho cấu tử qua tiếp một thiết bị phân tích khác như
máy hồng ngoại.
14
Khoảng động học từ 106 đến 107
Nhiệt độ làm việc khoảng 400ᵒC
Phân hủy chất địi hỏi 3 khí: khí mang, hydro và oxi
Độ ổn định cao ít bị ảnh hưởng bởi nhiệt độ và tốc độ dòng.
- Ứng dụng:
Độ nhạy của derector FID (Flame-ionization derector) cao rất nhiều so với
derector TCD (Thermal conductivity derector) khoảng 1000. Derector này chỉ
thích hợp nhất với các hợp chất hữu cơ chứa cacbon.
Một số hợp chất không thể phát hiện bằng derector này như: axit formic,
fomandehit, NOx NH3, các hợp chất của halogen, CS2, H2O, H2S, CO, CO2.
Trong phân tích phân tích sắc ký khí khí đối với phenol. Với bản chất của phenol
như đã nêu người ta thường sử dụng thêm cả khối phổ MS
- Ưu, nhược điểm của sắc ký khí:
* Ưu điểm:
- Hiệu quả tách hay độ phân giải cao.
- Tiến hành nhanh, ít qua các bước do đó hạn chế được sự nhiễm bẩn từ
môi trường.
- Giới hạn phát hiện rất thấp.
- Độ chính xác cao.
- Xác định được nhiều chất trong cùng một lần phân tích, có thể tách
riêng từng dẫn xuất của phenol.
* Nhược điểm:
- Kỹ thuật sắc ký khí khó địi hỏi máy móc hiên đại, người phân tích có
trình độ và sự am hiểu cao, mẫu phải được loại bỏ tối đa các chất gây nhiễu.
1.3.2.3. Ứng dụng của phương pháp sắc ký khí trong phân tích các hợp chất nhóm
VOCs
Thực tế hiện nay việc áp dụng kỹ thuật sắc ký khí vào trong q trình phân
tích các chất hữu cơ và các dẫn xuất của chúng với độ chính xác và độ tin cậy cao
đã được áp dụng rất phổ biến và rộng rãi, đặc biệt trong việc phân tích các chất
15
hữu cơ thuộc nhóm VOCS các chất dễ bay hơi như: Formandehit, sơn
Polyurethane (PU), sơn Nitro Cellulose (NC), isoprene… Một trong những chất
dễ bay hơi được áp dụng phương pháp này là phenol.
Tùy thuộc vào cấu tạo, thành phần của chất cần phân tích mà người ta sử
dụng các loại đầu dò khác nhau sao cho phù hợp với chất cần phân tích đó, thơng
thường đối với phenol thì việc sử dụng derector FID sẽ cho độ nhạy cao và độ
chính xác cao hơn so với các loại derector khác.
16