hấp thụ & trao đổi ion trong kỹ thuật xử lý nước và nước thải
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (2.23 MB, 287 trang )
Nhà xuất bản thống kê
Hà Nội - 2002
nớc & nớc thải
Lê Văn Cát
Hấp ionphụ & trao đổi
T
rung tâm khoa học tự nhiên và công nghệ quốc gia
Nhà xuất bản thống kê
Hà Nội - 2002
trong kỹ thuật
sử lý
nớc & nớc thải
Lê Văn Cát
Hấp phụ & trao đổi ion
T
rung tâm khoa học tự nhiên và công nghệ quốc gia
Mc lc
1
Phần I
Cơ sở khoa học của phơng pháp Hấp phụ
1. Hấp phụ
1. 1. Hiện tợng hấp phụ
Hấp phụ trong môi trờng nớc đợc hiểu là hiện tăng nồng độ của một
chất tan (chất bị hấp phụ) lên bề mặt một chất rắn (chất hấp phụ). Chất đã
bị hấp phụ chỉ tồn tại trên bề mặt chất rắn, không phân bố đều khắp trong
toàn bộ thể tích chất hấp phụ nên nó còn đợc gọi là quá trình phân bố hai
chiều , khác với quá trình hấp thụ mà trong đó chất tan sau khi đợc làm
giàu phân bố đều khắp trong thể tích chất hấp thụ.
Khi đã đợc hấp phụ lên bề mặt chất rắn, nếu tơng tác giữa chất hấp
phụ và chất bị hấp phụ không lớn, cấu trúc điện tử của chất bị hấp phụ ít
thay đổi, nhiệt hấp phụ tỏa ra nhỏ thì ngời ta gọi nó là hấp phụ vật lý. Nếu
tơng tác giữa chất hấp phụ và chất bị hấp phụ lớn sẽ làm biến đổi cấu trúc
điện tử của các nguyên tử dẫn tới sự hình thành liên kết hóa học, nhiệt tỏa
ra lớn ngang với các phản ứng hóa học, quá trình đó gọi là hấp phụ hóa học.
Khi bị hấp phụ lên bề mặt một chất rắn, chất bị hấp phụ chiếm chỗ của một
cấu tử nào đó và đẩy nó ra khỏi vị trí mà nó đã gắn trên đó thì hiện
tợng đó gọi là trao đổi ion. Do những đặc thù riêng về bản chất giữa cặp
chất hấp phụ bị hấp phụ chúng có thể tạo ra các loại phức chất. Trong một
phức chất nếu giữa khoảng cách của phối tử và nguyên tử trung tâm có tồn
tại các phân tử nớc chen giữa gọi là phức ngoại, nếu không gọi là phức nội.
Hiện tợng hấp phụ xảy ra do lực tơng tác giữa chất hấp phụ và chất bị
hấp phụ lực tơng tác giữa các phân tử gây ra hấp phụ vật lý, trao đổi ion,
lực nội phân tử gây ra hấp phụ hóa học tạo ra các liên kết hóa học.
Sau đây sẽ đề cập đến một số tơng tác gây ra hiện tợng hấp phụ
vật lý.
ở một khoảng cách nào đó, lực giữa các phân tử sẽ phát huy tác dụng,
các phân tử vừa hút vừa đẩy nhau. Khoảng cách để lực tơng tác xuất hiện
khá lớn và lực tơng tác yếu, chúng mạnh dần lên khi khoảng cách đợc rút
ngắn lại. Các loại lực có đặc trng đó là lực vật lý hay lực Van de Waals và
lực tơng tác tĩnh điện. Lực tơng tác dạng đó có thể phân ra thành: lực tán
xạ, lực định hớng, lực moment.
Lực tĩnh điện: theo Coulom hai điện tích trái dấu thì hút nhau và cùng dấu
thì đẩy nhau. Giá trị của lực hút (đẩy) tỉ lệ thuận với điện tích và tỉ lệ
nghịch với bình phơng khoảng cách:
2
21
.
.
R
kE
tt
= (1. 1)
- E
t
: năng lợng tơng tác do tĩnh điện.
- q
1
, q
2
: điện tích.
Lờ Vn Cỏt
2
- k
t
: hằng số phụ thuộc vào điện môi.
- R: khoảng cách giữa hai điện tích.
Đối với các điểm điện tích có kích thớc nhất định thì lực tơng tác còn
phụ thuộc vào kích thớc của điểm điện tích đó, tức là phụ thuộc vào mật độ
điện tích, mật độ điện tích đợc định nghĩa là tỉ lệ giữa điện tích và bán kính
của hạt mang điện. Mật độ điện tích lớn gây ra tơng tác tĩnh điện mạnh.
Lực định hớng: Do độ âm điện khác nhau của các nguyên tố, trong
một phân tử có sự phân bố điện tích không đều. Ví dụ trong phân tử H
2
O do
độ âm điện của oxy lớn hơn hydro nên xung quanh nguyên tử oxy tích điện
âm nhiều hơn so với hydro, vì vậy giữa các phân tử nớc xảy ra tơng tác
định hớng giữa các nguyên tử chứa nhiều điện tích âm và nhiều điện tích
dơng. Lực tơng tác đó đợc gọi là lực định hớng.
Lực định hớng đợc tính theo biểu thức:
E
đ
=
6
2
2
2
1
.
.
.
3
2
R
T
k
àà
(1. 2)
Đối với các phân tử cùng loại:
E
đ
=
6
4
1
.
.
3
2
R
T
k
à
(1. 3)
- E
đ:
năng lợng tơng tác định hớng
- à: moment
- k: hằng số Boltzmann.
Lực tơng tác định hớng phụ thuộc vào nhiệt độ, giảm khi nhiệt độ tăng
do khi tăng nhiệt độ, khả năng chuyển động nhiệt (động năng tăng) tăng và
làm giảm khả năng định hớng của tơng tác.
Lực tán xạ: Các phân tử luôn tơng tác với nhau, ngay cả với các chất có
phân bố điện tích đều nh khí trơ. Nguyên nhân gây tơng tác là sự phân bố
điện tích không đều một cách tức thời trong phân tử, sự phân bố không đều
tức thời đợc lan truyền và cộng hởng sang các phân tử xung quanh gây ra
tơng tác. Loại lực này có tên gọi là lực London. Theo London lực này tỉ lệ
nghịch với khoảng cách bậc mũ 6.
E
L
= -
6
R
A
(1. 4)
- E
L
: lực tán xạ London
- A: hằng số
Hằng số A có thể tính từ phơng pháp lợng tử, phơng pháp nhiễu loạn.
Theo London, A có thể tính:
A =
21
21
21
.
2
3
+
h
(1. 5)
- : độ phân cực
-
1
,
2
: tần số đặc trng
- h: hằng số Planck.
Mc lc
3
Vì h tơng ứng với năng lợng ion hóa I nên:
A =
2
1
21
2
1
.
2
3
II
II
+
(1. 6)
Với cùng loại phân tử:
A = I.
2
3
2
(1. 7)
Bằng phơng pháp biến phân, Slate và Kirshwood tính đợc hằng số A và nó
có dạng:
A
S
L
=
2211
21
5,0
//
.
.4
.3
NN
m
he
+
(1. 8)
- e: điện tích của điện tử.
- m: khối lợng của điện tử.
- N
1
, N
2
: số điện tử ở lớp ngoài của phân tử tham gia tơng tác
Lực cảm ứng (Lực Debye): một phân tử khi chịu tác động của một điện
trờng khác sẽ bị phân cực tạo thành các moment cảm ứng và gây ra tơng
tác. Tơng tác này phụ thuộc vào độ phân cực và cờng độ điện trờng tác
dụng lên nó. Năng lợng tơng tác giữa hai dipol cảm ứng là:
E
C
=
6
2
22
2
11
R
àà
+
(1. 9)
Tóm lại: lực tơng tác vật lý xảy ra giữa các phân tử là tổng hợp của
nhiều loại lực hút khác nhau: tĩnh điện, tán xạ, cảm ứng và lực định hớng.
Các loại lực này có đặc điểm cũng là phát huy tơng tác ở khoảng cách nhỏ
R
6
(trừ trờng hợp lực tĩnh điện). Trong tr ờng hợp các phân tử tơng tác có
chứa moment lỡng cực hay tứ cực thì lực tác dụng không tỉ lệ nghịch với
khoảng cách theo hàm mũ bậc sáu mà theo bậc tám hoặc mời. Lực tơng
tác tổng thể giữa hai phân tử là tổng đại số của các lực thành phần:
E = E
đ
+ E
L
+ E
C
(1. 10)
Đối với hai phân tử cùng chất:
E = -
622
4
.
4
3
2
3
2
++ RI
kT
à
à
(1. 11)
Cho hai phân tử khác loại:
E = -
6
21
21
21
2
22
2
11
2
2
2
1
.
.
.
.2
3
.
3
2
+
+++ R
II
II
kT
àà
àà
(1. 12)
Khi hai phân tử tiến sát gần nhau đến một khoảng cách nào đó sẽ xuất
hiện lực đẩy. Về mặt lý thuyết rất khó thực hiện các phép tính toán cho loại
lực này do khi gần nhau sự phân bố điện tử trong phân tử đã bị biến dạng
nhiều nên không thể dùng các thông số của phân tử độc lập để tính toán.
Khi tính toán lực đẩy ngời ta thờng phải dùng các công thức kinh nghiệm,
bán kinh nghiệm. Một trong những công thức hay sử dụng là lực đẩy tỉ lệ với
R
- m
với m có giá trị từ 9 đến 14, thờng là 12.
Lờ Vn Cỏt
4
Trong một hệ hấp phụ khi ở trạng thái cân bằng tổng năng lợng tơng
tác đạt giá trị cực tiểu. Sự tham gia tơng tác không chỉ xảy ra giữa hai
phân tử mà là của cả một tập hợp phân tử nằm trong phạm vi chịu tơng
tác.
Tất cả các tơng tác hút, đẩy, ảnh hởng của phạm vi tác dụng đợc mô
tả qua phơng trình thế năng Lenard Jones:
E
LJ
=
+
1
26
ii
rBrA (1. 13)
- A, B: hằng số đặc trng lực hút, đẩy
- r
i
: khoảng cách giữa các điểm tơng tác.
1. 2. Hấp phụ trong môi trờng nớc.
Trong nớc, tơng tác giữa một chất hấp phụ và bị hấp phụ phức tạp hơn
rất nhiều vì trong hệ có ít nhất là ba thành phần gây tơng tác: nớc chất
hấp phụ chất bị hấp phụ. Do sự có mặt của dung môi nên trong hệ sẽ xảy
ra quá trình hấp phụ cạnh tranh giữa chất bị hấp phụ và dung môi trên bề
mặt chất hấp phụ. Cặp nào có tơng tác mạnh thì hấp phụ xảy ra cho cặp
đó. Tính chọn lọc của cặp tơng tác phụ thuộc vào các yếu tố: độ tan của chất
bị hấp phụ trong nớc, tính a hoặc kị nớc của chất hấp phụ, mức độ kỵ
nớc của các chất bị hấp phụ trong môi trờng nớc.
Nớc là một dung môi phân cực, trong trạng thái lỏng các phân tử không
tồn tại ở trạng thái biệt lập mà chúng tơng tác, gắn kết với nhau thông qua
cầu liên kết hydro. Năng lợng liên kết cầu hydro trong nớc đá và chất lỏng
khoảng 23 kJ/mol, tuy nhỏ hơn nhiều so với liên kết OH ( 450 kJ/mol)
nhng lớn hơn nhiều so với lực tơng tác vật lý Van de Waals ( 4 5
kJ/mol) [1].
Nớc trong trạng thái lỏng có cấu trúc trung gian giữa nớc đá và hơi
nớc và thay đổi theo nhiệt độ. Cấu trúc của nớc ở trạng thái lỏng đợc coi
là dễ chấp nhận là mô hình tập hợp mỏng (flickering cluster) của Frank và
Went. Theo mô hình này một tập hợp các phân tử nớc (vài chục phân tử)
cụm lại với nhau do cầu liên kết hydro với thời gian tồn tại khoảng 10
- 10
giây, chúng đợc hình thành và phá hủy liên tục do chuyển động nhiệt của
các phân tử, tuy vậy thời gian sống của các tập hợp mỏng còn cao hơn ngàn
lần so với thời gian dao động phân tử (10
- 13
giây). Vì vậy có thể cho rằng sự
tồn tại của tập hợp mỏng là có thực mặc dù khá chóng tàn. Theo qui tắc:
những chất có bản chất hóa học giống nhau thì hòa tan lẫn nhau (like
disolves the likes) thì những chất phân cực dễ hòa tan trong dung môi phân
cực và ngợc lại. Các loại rợu chứa nhóm OH phân cực dễ hòa tan trong
nớc, các hydrocarbon dễ hòa tan trong dầu. Độ hòa tan giảm khi phân tử
lợng cao, ví dụ loại rợu chứa một hay hai nguyên tử carbon tan vô hạn
trong nớc, trong khi rợu mạch dài (C
4
, C
5
) chỉ có độ tan giới hạn.
Tơng tự nh vậy các chất hấp phụ tơng tác với chất tan và dung môi
cũng theo đặc thù trên thể hiện qua tính thấm ớt bề mặt. Trong nớc, bề
mặt chất rắn có độ phân cực cao (silicagel chứa nhiều nhóm OH) tơng tác
tốt với nớc và có góc thấm nớc nhỏ hơn 90
o
(không tạo thành giọt trên bề
Mc lc
5
mặt chất rắn), các chất rắn có độ phân cực thấp (than muội) có tính thấm
ớt kém, góc thấm ớt lớn hơn 90
o
do độ phân cực thấp, vì vậy nó đợc coi là
kị nớc.
Khả năng hấp phụ của chất tan (bị hấp phụ) lên chất hấp phụ vì thế
trớc hết phụ thuộc vào tính tơng đồng giữa chất bị hấp phụ và chất hấp
phụ về độ phân cực: chất không phân cực (chất hữu cơ) hấp phụ tốt trên chất
hấp phụ không phân cực (than hoạt tính) và ngợc lại. Một chất tan có độ
phân cực cao hơn nớc có thể hấp phụ tốt trên chất hấp phụ phân cực (quy
tắc Trauben). Cùng bản chất hóa học mà có phân tử lợng khác nhau thì cấu
tử có phân tử lợng lớn sẽ hấp phụ tốt hơn nếu không bị ràng buộc bởi hiệu
ứng rây phân tử.
Hấp phụ các phân tử trung hòa vì vậy không chỉ phụ thuộc vào tơng tác
giữa chất hấp phụ và bị hấp phụ mà còn phụ thuộc vào tơng tác của dung
môi với chất hấp phụ, cặp tơng tác nào mạnh hơn thì cặp khác ít có khả
năng hấp phụ. Đặc điểm này không chỉ xảy ra giữa dung môi với chất bị hấp
phụ mà còn đối với giữa các chất bị hấp phụ với nhau nhất là trong nớc tự
nhiên luôn tồn tại đồng thời nhiều chất bị hấp phụ [2].
Với một số chất bị hấp phụ có độ phân cực cao, ví dụ các ion kim loại hay
một số dạng phức oxy anion (SO
4
2-
, PO
4
3-
, CrO
4
2-
) quá trình hấp phụ xảy ra
do tơng tác tĩnh điện thông qua lớp điện kép thì hình ảnh tơng tác khác
hơn. Trên bề mặt chất hấp phụ hình thành các lớp điện kép hay lớp khuếch
tán chứa điện tích xắp xếp lần lợt của loại trái dấu nhau. Các ion hoặc các
phân tử có độ phân cực lớn bị bao bọc bởi một lớp vỏ của các phân tử nớc,
bán kính (độ lớn) của các chất bị hấp phụ này ảnh hởng nhiều đến khả
năng hấp phụ của hệ do tơng tác tĩnh điện. Với các ion cùng hóa trị thì loại
có kích thớc lớn sẽ hấp phụ tốt hơn do có độ phân cực cao hơn và lớp vỏ
hydrat nhỏ hơn. Lớp vỏ hydrat là yếu tố cản trở tơng tác tĩnh điện. Theo đó,
có thể xắp xếp thứ tự về khả năng hấp phụ: Li
+
< Na
+
< K
+
< Rb
+
< Cs
+
và
Mg
2+
< Ca
2+
< Sr
2+
< Ba
2+
; Cl
-
< Br
-
< NO
3
-
< I
-
< NCS
-
.
Khả năng hấp phụ của các ion có hóa trị cao tốt hơn nhiều so với ion hóa
trị thấp: K
+
<< Ca
2+
<< Al
3+
<< Th
4+
phù hợp với dãy Hofmeister [3].
Bản thân chất hấp phụ trong môi trờng nớc cũng mang điện tích, điện
tích thay đổi dấu khi thay đổi pH của môi trờng. Tại pH bằng điểm đẳng
điện thì điện tích bề mặt chất rắn bằng không, trên đó bề mặt tích điện âm
và dới đó tích điện dơng. Mật độ tích điện càng lớn khi điểm pH của hệ
càng cách xa điểm đẳng điện. Với các chất bị hấp phụ có tính axit hay bazơ
yếu, phụ thuộc vào pH nó có thể tồn tại ở trạng thái mang điện tích hay
trung hòa. Với các axit yếu khi pH > pK thì nó tích điện âm, pH < pK thì nó
ở trạng thái trung hòa. Với bazơ yếu ta có hình ảnh ngợc lại.
Trong quá trình hấp phụ các chất có độ phân cực lớn, ngời ta nhận thấy
khả năng hấp phụ của hệ tốt ở trạng thái trung hòa điện tích và kém ở các
vùng có điện tích cao. Điều đó nói lên rằng lực hấp phụ của một hệ chủ yếu
do lực tơng tác khác với lực tĩnh điện và hệ hấp phụ đợc gây ra bởi lực
tĩnh điện có khả năng hấp phụ thấp (lực Van de Waals đợc gọi là lực không
đặc thù).
Lờ Vn Cỏt
6
Với các chất trao đổi ion diễn biến của hệ cũng phức tạp do các chủng loại
chất trao đổi ion đa dạng: tính axit (cationit), bazơ (anionit), cờng độ axit,
bazơ của các nhóm chức có chức năng trao đổi, khả năng phân li của các
nhóm chức cũng nh của các cấu tử trao đổi phụ thuộc và pH môi trờng,
đồng thời xảy ra cả quá trình hấp phụ các phân tử trung hòa, quá trình tạo
phức chất.
So với quá trình hấp phụ trong pha khí, tốc độ hấp phụ trong nớc xảy ra
chậm hơn nhiều chủ yếu do quá trình chuyển khối, khuếch tán chậm. Do đó
trong thực tiễn công nghệ, dung lợng hấp phụ của một hệ rất ít khi đợc sử
dụng triệt để, nhất là đối với các chất hấp phụ có dung lợng cao (diện tích
bề mặt lớn, độ lớn của mao quản nhỏ). Kết quả sử dụng ngoài thực tiễn vì
vậy đôi lúc có điều trái ngợc: chất hấp phụ có dung lợng cao có kết quả sử
dụng kém hơn loại có chất lợng thấp, chất bị hấp phụ có tính chọn lọc cao
hấp phụ kém chất có độ chọn lọc thấp. Đó là kết quả của sự tơng tác giữa
yếu tố động học và cân bằng hấp phụ trong môi trờng nớc.
Trong nớc không chỉ tồn tại các quá trình hóa học, vật lý mà xen lẫn là
các quá trình vi sinh, chúng có tác động và ảnh hởng lên tổng thể quá trình
xử lý nớc. Ví dụ khi sử dụng cột than để xử lý (loại bỏ) chất hữu cơ trong
nớc, trên bề mặt than phát triển một số loại vi sinh, chúng tiêu thụ nguồn
chất hữu cơ đã hấp phụ trên than cho quá trình sinh sôi, phát triển và trao
đổi chất. Kết quả là than hấp phụ đợc nhiều chất hữu cơ hơn khả năng của
nó (thật ra là quá trình tái sinh than bằng vi sinh), mặt khác nếu chúng
phát triển quá mạnh tạo thành các lớp màng bao bọc quanh hạt than làm
ngăn cản quá trình chuyển khối hoặc làm mất tác dụng hấp phụ của than [4,
5, 6].
Tóm lại, khác với hấp phụ trong pha khí, hấp phụ trong môi trờng nớc
có cơ chế phức tạp hơn do yếu tố hấp phụ hỗn hợp, do sự biến động mạnh về
bản chất hóa học của chất bị hấp phụ và chất hấp phụ, do quá trình động
học chậm và các quá trình tồn tại song song khác.
2. Chất hấp phụ
2. 1. Chế tạo chất hấp phụ.
Một hệ hấp phụ có dung lợng cao hay thấp trớc hết phụ thuộc vào lực
tơng tác giữa chất hấp phụ và bị hấp phụ. Ngoài lực tơng tác do bản chất
của hệ quyết định có thể dễ dạng nhận thấy là một chất hấp phụ có diện tích
bề mặt lớn sẽ có khả năng hấp phụ cao hơn so với chất hấp phụ cùng bản
chất nhng có diện tích bề mặt thấp hơn. Diện tích bề mặt của chất hấp phụ
tăng theo độ phân tán, độ phân tán càng lớn thì diện tích bề mặt tính theo
đơn vị khối lợng (diện tích riêng) càng cao. Thí dụ một khối lập phơng có
các cạnh là 1 cm thì diện tích của nó là 6 cm
2
, nếu chia nhỏ khối đó thành
các khối lập phơng có độ dài các cạnh là 0,1 cm sẽ nhận đợc một ngàn khối
lập phơng nhỏ, mỗi khối có diện tích 0,06 cm
2
và tổng diện tích khi đó là 60
cm
2
, nghĩa là diện tích tăng thêm 10 lần.
Với các biện pháp cơ học (đập, nghiền) chỉ có thể tạo đợc một mức độ
phân tán hay diện tích bề mặt hạn chế, thờng ít vợt quá 1 m
2
/g. Muốn có
Mc lc
7
độ phân tán cao phải dựa vào các biện pháp hóa học, hóa lý. Các chất rắn
xốp là hệ phân tán cao, thậm chí đạt tới mức phân tán của phân tử nên có
diện tích lớn, có thể tới trên ngàn m
2
/g. Một trong những nhiệm vụ quan
trọng nhất của việc chế tạo chất hấp phụ là kiểm soát đợc độ xốp và phân
bố độ xốp theo kích thớc của chất hấp phụ.
Các biện pháp áp dụng để chế tạo chất hấp phụ có độ phân tán cao có
nhiều và thay đổi theo mục tiêu sử dụng, trình độ khoa học, công nghệ của
các nhà sản xuất. Tuy nhiên nguyên tắc chế tạo chất hấp phụ xốp đều dựa
trên các phơng pháp [7]:
- Phơng pháp kết tụ.
- Phơng pháp ăn mòn (leaching).
- Kết tinh thủy nhiệt (hydrothermal crystalization).
- Phân hủy nhiệt.
Phơng pháp kết tụ là tạo ra một cấu trúc xốp từ vật liệu có kích thớc
nhỏ hơn, khác với tạo viên bằng phơng pháp cơ học, vật liệu để tạo cấu trúc
xốp trong trờng hợp này có kích thớc rất nhỏ, ví dụ ở dạng keo phân tán
trong một chất lỏng. Bằng các tác nhân vật lý, hóa học làm cho chúng co
cụm, liên kết với nhau. Khi sấy khô khoảng cách giữa chúng giảm đi tăng độ
bền liên kết giữa các hạt. Diện tích bề mặt của vật liệu chính là tổng diện
tích của các hạt nhỏ.
Phơng pháp ăn mòn là phơng pháp đi từ một vật liệu đặc, dùng các tác
nhân hóa học cho phản ứng với khối chất đó tạo ra các sản phẩm có tính tan
tốt, sản phẩm tạo thành mang theo một phần nguyên liệu ra ngoài tạo ra độ
xốp. Ví dụ để tạo ra thủy tinh xốp ngời ta dùng tác nhân xút để ăn mòn.
Kết tinh thủy nhiệt là từ một khối phản ứng vô định hình ban đầu, dùng
nhiệt để ủ và các tinh thể hình thành trong chất lỏng. Cấu trúc vật liệu tinh
thể có độ xốp và diện tích do bản chất của nó quyết định.
Phân hủy nhiệt cũng tơng tự nh phơng pháp ăn mòn, tác nhân chính
là dùng nhiệt. Nó đợc phân ra hai trờng hợp là có và không dùng thêm tác
nhân phân hủy. Sản phẩm của quá trình là các chất bay hơi. Nếu trong
nguyên liệu có sinh ra các chất bay hơi thì không cần bổ xung tác nhân phân
hủy, ví dụ dehydrat nhôm hydroxit thành nhôm oxit, luyện than cốc. Trong
trờng hợp hoạt hóa chế tạo than hoạt tính ngời ta phải đa thêm oxy, hơi
nớc hay CO
2
làm tác nhân phản ứng.
Ngoài các phơng pháp chế tạo trên, một số chất hấp phụ polymer đợc
chế tạo theo các nguyên lý của polymer, một số chất hấp phụ khoáng tự
nhiên và chất hấp phụ có nguồn gốc sinh học (biosorbent)
Các chất hấp phụ nhân tạo, tự nhiên (không kể chất hấp phụ sinh học) có
nguồn gốc hay thành phần hóa học chủ yếu sau:
- Dạng oxit kim loại hay silic (SiO
2
, Al
2
O
3
, Fe
2
O
3
, MgO )
- Hỗn hợp các ôxit kim loại (Zeolit, khoáng sét, than bùn, diatomit,
vermiculit, perlit. Sau đây chúng ta điểm qua phơng pháp chế tạo
một số chất.
Lờ Vn Cỏt
8
2. 1. 1. Than hoạt tính
Than hoạt tính đợc chế tạo theo phơng pháp loại trừ với nguyên liệu
ban đầu có chứa thành phần cacbon: than, xenlulose, gỗ, sọ dừa, bã mía, tre,
nứa, mùn ca. Trong nguyên liệu ngoài thành phần cacbon còn tồn tại một
số thành phần hợp chất vô cơ, tạp chất gây ra thành phần tro khi đốt cháy
(oxit kim loại), trong đó Ca, Mg, K, Na có trong đó gây tính kiềm ví dụ
K
2
CO
3
, Na
2
CO
3
, CaCO
3
, vì vậy sản phẩm cuối nếu không rửa sạch có tính
kiềm.
Có thể xuất phát từ những nguyên liệu có nguồn gốc rất khác nhau, khi
chế tạo ngời ta có thể qui về hai phơng pháp chính trong giai đoạn hoạt
hóa - giai đoạn phát triển độ xốp của than: hoạt hóa với hóa chất và hoạt hóa
với khí, hơi. Hai quá trình này còn đợc gọi là hoạt hóa hóa học và vật lý.
Quá trình hoạt hóa với hóa chất là đa thêm một số tác nhân hóa học vào
nguyên liệu hay những tác nhân này đã tồn tại sẵn trong đó, chúng có tác
dụng phân hủy hoặc dehydrat các phân tử chất hữu cơ trong quá trình than
hóa hoặc thiêu đốt. Tác nhân hóa học đa vào là các chất vô cơ: kiềm, muối
cacbonat, sunfat, sunfid kiềm, cacbonat, clorua, sunfat, photphat của kiềm
thổ, kẽm clorua, axit sunfuric, photphoric. Chúng đợc dùng riêng lẻ hay
phối hợp với nhau theo tỉ lệ nào đó để tạo các hiệu ứng cần thiết. Một số
nguyên liệu nh xơng, vỏ trấu chứa khá nhiều hợp chất vô cơ, những thành
phần này tác động tốt lên hoạt tính hấp phụ của than (carbon) khi than hóa
trong môi trờng yếm khí. Ví dụ khi đốt than từ xơng tại 750 950
o
C yếm
khí, thành phần carbon trong đó chỉ chiếm 8 12%, CaCO
3
3 8% còn phần
lớn là canxi photphat (70 80% Ca
3
(PO
4
)
2
), tuy hàm lợng carbon thấp
nhng khả năng hấp phụ vẫn khá cao do carbon đợc phân bố kiểu một
màng rất mỏng trên nền vật liệu vô cơ xốp. Tơng tự nh vậy than sản xuất
từ vỏ trấu cũng có tác dụng hấp phụ do carbon đợc phân tán đều trên bề
mặt silic oxit, thành phần chiếm tới 90% trong tro [7, 8].
Thông thờng than đợc sản xuất theo phơng pháp hoạt hóa hóa học
bằng cách trộn hay tẩm nguyên liệu với các hóa chất và đốt yếm khí từ 500
900
o
C. Các hóa chất vô cơ khi đốt sẽ phân hủy ra các khí có tính oxy hóa
hoặc phân hủy các phân tử chất hữu cơ qua phản ứng dehydrat hóa [9].
Than sản xuất theo phơng pháp hóa học có diện tích bề mặt không cao,
độ xốp lớn thích hợp cho hấp phụ các phân tử lớn trong chất lỏng (tảy màu)
ít thích hợp cho hấp phụ khí.
Tuy nhiên, quá trình nhiệt phân hay than hóa một số nguyên liệu đặc
thù nh polyme PVC, polyvinylacetat, polyacryllonville cho ra các sản phẩm
có diện tích bề mặt lớn tới trên ngàn m
2
/g.
Tuy vậy các nguyên liệu đó đắt không thích hợp cho sản xuất đại trà.
Phơng pháp hoạt hóa vật lý thờng tiến hành theo hai giai đoạn: than
hóa và hoạt hóa. Giai đoạn than hóa là giai đoạn đốt yếm khí tại 400 500
o
C
nhằm loại bỏ các thành phần bay hơi trong nguyên liệu, đa nguyên liệu trở
về dạng carbon.
Mc lc
9
Bớc hoạt hóa là phát triển độ xốp của nguyên liệu thông qua phản ứng
oxy hóa ở nhiệt độ cao (800 1100
o
C). Trong quá trình oxy hóa, một số
nguyên tử carbon bị đốt cháy thành khí (CO, CO
2
), khí này bay đi để lại chỗ
trống, đó chính là cơ chế tạo nên độ xốp. Quá trình hoạt hóa này vì vậy còn
đợc gọi là khí hóa (gasification). Tác nhân oxy hóa có thể dùng là hơi nớc,
không khí (oxy), khí cácbonic, khí thải. Do phản ứng với oxy toả nhiệt nên
nhiệt độ hoạt hóa thờng thấp và khó điều khiển, phản ứng với hơi nớc, khí
CO
2
thu nhiệt nên tiến hành ở nhiệt độ cao hơn và dễ khống chế đợc quá
trình, chính vì vậy nên nó là phơng án sản xuất thông dụng nhất.
Chế độ hoạt hóa quyết định chất lợng của than hoạt tính: yếu tố cháy
đều trong thể tích hạt than là quan trọng nhất, khi khống chế đợc quá
trình cháy đều thì mức độ cháy của than (phần hao hụt so với nguyên liệu)
sẽ quyết định độ xốp của sản phẩm. Do phần lớn nguyên liệu sử dụng cho
quá trình hoạt hóa vật lý đều có độ đặc nhất định (khối lợng riêng lớn) nh
than đá, than bùn, sọ dừa nên xu hớng là cháy từ ngoài vào trong, cháy đến
đâu để lại lớp tro tới đó, có hình ảnh giống nh đốt củi. Than cháy theo kiểu
đó chỉ hoạt hóa (có tác dụng) đợc phía ngoài vỏ, lớp trong mất tác dụng, do
vậy chất lợng kém.
Than cốc đợc sản xuất từ than đá, đợc nung yếm khí ở nhiệt độ cao,
trong quá trình nung các thành phần dầu nặng bay đi, một phần hợp chất
sunfua cũng đợc loại bỏ nên trong chừng mực nhất định nó cũng đợc sử
dụng nh than hoạt tính nhng thờng có chất lợng thấp hơn loại hoạt hóa
với hơi nớc.
Than hoạt tính thơng phẩm thờng đợc phân chia theo dạng hạt hay
bột, loại tảy màu hay hấp phụ khí và kèm theo nó là một số chỉ tiêu: chỉ số
iod, chỉ số tảy màu, chỉ số phenol Dới tên than tảy màu có thể sử dụng
than vào các mục đích: tảy màu, làm trong, khử mùi, tinh chế cho thực
phẩm, đồ uống, dầu mỡ, nớc. Nó có đặc điểm chung nhất là hấp phụ trong
pha lỏng, diện tích bề mặt không lớn lắm, độ xốp cao tạo điều kiện cho quá
trình khuếch tán, dạng bột. Than hấp phụ khí, khử mùi thờng là dạng hạt,
độ bền cơ học cao, diện tích bề mặt và dung lợng hấp phụ lớn.
Ngoài ra còn một số loại than có tính đặc thù riêng: dùng trong y học,
than hấp phụ kim loại, than dùng trong mặt nạ, than oxy hóa dùng để xử lý
phóng xạ. Phần lớn những than đó đều đợc biến tính bề mặt để tăng cờng
thêm các nhóm chức qua phản ứng oxy hóa hoặc tẩm một số xúc tác.
Do có rất nhiều loại than đang lu hành nên việc chọn lựa cho một mục
đích sử dụng cụ thể nên theo khuyến cáo của nhà sản xuất. Nếu không có
đợc khuyến cáo cụ thể thì trớc khi sử dụng cần phải đợc thử để đánh giá.
Một số chỉ tiêu nh thành phần hóa học, một số chỉ số mang tính chất tiêu
chuẩn chỉ nên xem là yếu tố tham khảo. Bảng sau cho thấy sự khác biệt rất
lớn về thành phần hóa học của một số loại than hoạt tính.
Bảng sau liệt kê một số loại than thơng phẩm của một vài nớc dùng
trong xử lý nớc và nớc thải nhằm mục đích loại bỏ chất hữu cơ.
Lờ Vn Cỏt
10
Bảng 1: Than dùng để xử lý nớc, nớc thải [10]
Tên Nhà sản xuất Nguyên liệu Phơng pháp
hoạt hóa
ứng dụng trong
công nghệ
TW
1
, TW
2
,
TW
3
Tr Bắc, Tr Vinh,
Việt Nam
Sọ dừa Hơi nớc Nớc cấp, nớc thải, đồ
uống
CAL 12x40 Calgon, Pitts- burg
USA
Than non
(bitum)
Hơi nớc Nớc, đồ uống, đờng
Acticarbone Charbon actifs corp.
New York
Than gỗ Hơi nớc Nớc, rợu, dầu thực vật,
đờng
Cliffchar Cliffs Dow Chem.
Co. USA
Than gỗ axit Nớc, tảy mu đờng
Dusarit Matschapp Activit
Amsterdam
Than gỗ Không khí Nớc, tinh chế đờng
Hydraffin Carbo Norit Un.
Czech + Đức
Gỗ Clorua kẽm Nớc
Hydro darco Darco Corp. New
York
Lignit Hơi nớc Nớc
Klearit Fennison Wright
Corp. Toledo, Ohio
Than gỗ Hơi nớc Nớc, khử mùi
Norit Amer. Norit Comp.
USA
Gỗ thông Hơi nớc Nớc, tảy mu thực phẩm,
hóa chất
Norit All. Norit gesell.
H Lan
Gỗ Hơi nớc Nớc, tảy mu
Nuchar West Virginia pulp.
Co. New York
Bã thải CN
giấy
Hơi nớc Nớc, tảy mu, khử mùi
khí
Sylvac Gray chem. Comp.
Roullet, USA
Gỗ cứng Photphoric Nớc
Weschar Western Filter Co.
Dewver
Lignit Hơi nớc Nớc, tách dầu khoáng
khối nớc, lm trong các
loại dầu thơm
Mc lc
11
Bảng 2: Thành phần hóa học của một số loại than hoạt tính [16]
Than Thành phần C
(%)
Tro (%) Tan trong HCl
(%)
pH trớc chiết
Norit 93 - 96 4,5 6,5 2 - 3 7,8 8,3
Darco 65 - 70 25 - 30 0,5 4,5 6,0
Suchar 97 - 99 2,0 3,5 1,2 - 2,4 6,3 7,0
Nuchar W 95 98 2,0 3,5 1,3 2,5 7,5
Nuchar 2 90 95 5 10 3 7 7 8
Bonchar 9 10 90 - -
Cliffchar 89 90 3 4 - 9,5 10,5
TW 2 [11] 92,5 2,6 - -
Cal 12x40 [11] 89 7 - -
2. 1. 2. Silicagel
Silicagel là một chất hấp phụ có thành phần hóa học chủ yếu là silic oxit
SiO
2
có cấu trúc rất xốp. Ngời ta có thể cho rằng silicagel hạt chứa rất
nhiều quả cầu SiO
2
nhỏ, các quả cầu nhỏ SiO
2
tụ lại với nhau, xắp xếp
không theo một trật tự nào về mặt hình học. Khoảng không gian giữa các
quả cầu nhỏ chính là lỗ xốp, tổng diện tích bề mặt ngoài của các quả cầu nhỏ
đó là diện tích bề mặt của silicagel. Độ xốp của silicagel có thể đạt 50 60%,
diện tích bề mặt của một số loại đạt tới 800 m
2
/g [12]. Tổng hợp silicagel là ví
dụ điển hình của phơng pháp kết tụ.
Nguyên liệu để tổng hợp silicagel là axit silic, axit đơn (dạng ortho)
H
4
SiO
4
là axit rất yếu (pK
1
= 9,9, pK
2
= 12,4). Khi vợt quá độ hòa tan nó
không kết tủa mà tạo thành polyme thông qua phản ứng trùng ngng, giai
đoạn đầu của quá trình trùng ngng là 2H
4
SiO
4
H
6
SiO
7
+ H
2
O, phản ứng
trùng ngng tiếp diễn và hình thành các phân tử polyme lớn cho tới khi
nồng độ axit đơn d trong dung dịch nằm trong khoảng 100 500 mg/l tùy
thuộc vào pH (1 11). Phân tử polyme phát triển đến kích thớc hạt keo
(silica sol). Các hạt keo này tiếp tục tụ lại, liên kết với nhau tạo thành dạng
gel, khái niệm gel chỉ đề cập đến một giai đoạn trung gian trong quá trình
hình thành sản phẩm.
Silicagel thờng đợc chế tạo bằng cách kết tủa SiO
2
từ dung dịch thủy
tinh lỏng (silicat kiềm có công thức hóa học chung Me
0,5
O
n
. SiO
2
, ví dụ 32%
Na
2
O + 66% SiO
2
, loại natri silicat) với axit (chủ yếu là axit sunfuric), trong
một số trờng hợp đặc biệt có thể thủy phân SiCl
4
hoặc các hợp chất silic
khác dễ thủy phân.
Trong quá trình thủy phân với axit sunfuric sẽ hình thành axit silic yếu
và ngay lập tức xảy ra phản ứng trùng ng ng tạo thành dạng gel đặc và khá
trong chứa khoảng 90% nớc, hay 300 phân tử nớc trên một phân tử SiO
2
.
Lờ Vn Cỏt
12
Khi tỉ lệ nớc/SiO
2
là 30 40 thì có thể dùng dao để cắt thành miếng, khi tỉ
lệ còn 6/1 thì đợc coi là khô và có thể nghiền thành bột.
Quá trình sản xuất có thể mô tả nh sau: pha loãng thủy tinh lỏng và
axit sunfuric đến một mức độ nào đó và đa thủy tinh lỏng vào axit đến một
pH nhất định. Cả khối phản ứng đông lại sau khi già hóa vài giờ, chúng đợc
rửa sạch (Na
2
SO
4
) và sấy khô. Phơng pháp đó tạo ra đợc silicagel có hình
dạng không ổn định, không đều. Để tạo đợc hạt tròn, sau quá trình thủy
phân hỗn hợp phản ứng đợc cho chuyển động qua một lớp dầu, trong khi
chuyển động sản phẩm của phản ứng hình thành có dạng hình cầu, chúng
đợc để già và rửa sạch, sấy khô.
Tính chất của silicagel phụ thuộc vào các yếu tố thực hiện khi chế tạo:
nồng độ, pH, nhiệt độ. Hạt keo (silica sol) càng nhỏ thì diện tích bề mặt và
mật độ nhóm chức càng lớn [13]. Thông thờng khi thủy phân tại vùng pH
thấp hạt keo nhỏ thời gian đông tụ chậm. ở vùng nồng độ loãng và nhiệt độ
cao cũng tạo ra các hạt sol nhỏ. Tỉ lệ các thành phần tham gia phản ứng, tốc
độ khuấy trộn, chất đa thêm vào, thứ tự đa chất tham gia phản ứng đều
ảnh hởng đến chất lợng của sản phẩm.
Sản phẩm silicagel lu hành trên thị trờng thờng chia làm hai loại:
mao quản lớn và mao quản nhỏ, loại mao quản nhỏ có dung lợng hấp phụ
cao hơn; loại mao quản lớn dùng cho những mục đích đặc thù nh làm chất
hấp phụ trong phân tích sắc kí (sắc kí khí, bản mỏng, sắc kí rắn lỏng, sắc
kí cao áp), loại này trớc khi sử dụng thờng đợc biến tính bề mặt.
Silicagel đợc sử dụng chủ yếu làm chất hút ẩm, một phần làm chất
mang xúc tác, đã từng sử dụng làm mặt nạ phòng độc, tinh chế dầu mỏ.
Trong phân tích nó chủ yếu đợc sử dụng làm chất hấp phụ hay chất mang
sắc kí. Gần đây có một số nghiên cứu ứng dụng silicagel để xử lý nớc thải
chứa kim loại nặng và chất phóng xạ [14].
2. 1. 3. Nhôm oxit
Nhôm oxit là vật liệu màu trắng ngà không tan trong nớc nhng tan
trong axit đặc, khi nung ở nhiệt độ cao nó sẽ chuyển sang dạng thù hình
khác và không tan trong axit. Nhôm oxit tồn tại dới nhiều dạng thù hình.
Khi loại bỏ nớc của nhôm hydroxit dạng ortho hay meta hay nung nhôm
oxihydrat sẽ hình thành - Al
2
O
3
tinh thể.
150
0
C 300
0
C
- 2H
2
O - H
2
O
- Al
2
O
3
tan trong cả axit và kiềm. Tùy điều kiện chế tạo, hạt - Al
2
O
3
tinh
thể rất khác nhau và mức độ sai lệch của tinh thể cũng khác nhau và khả
năng hút ẩm tốt. Khi nung nóng trên 1000
O
C, - Al
2
O
3
chuyển hóa thành
dạng không tan trong axit, kiềm và không hút ẩm và điểm nóng chảy cao,
khoảng 2050
o
C. Ngoài hai dạng thù hình trên, nhôm oxit còn tồn tại ở các
dạng , , và .
2 Al(OH)
3
2 AlO (OH)
2 - Al
2
O
3
Mc lc
13
Nhôm oxit hình thành khi đốt nhôm kim loại hoặc nung nhôm hydroxit
hay các muối nhôm có gốc là các axit dễ bay hơi. Sản xuất công nghiệp
thờng sử dụng nguyên liệu quặng bauxit theo phơng pháp Bayer.
Bauxit là loại quặng chứa nhôm, nguyên liệu chủ yếu để sản xuất nhôm
công nghiệp. Bauxit là loại khoáng chủ yếu chứa nhôm hydroxit và một số
tạp chất khác: caolin, sắt, khoáng titan. Dạng nhôm hydroxit trong bauxit
gồm hydrargillit (còn gọi là gibbsite), diaspor và boemit, chủ yếu là boemit.
Diaspor và boemit là loại monohydrat Al
2
O
3
H
2
O, gibbsite là loại trihydrat
Al
2
O
3
3H
2
O. Hàm lợng Al
2
O
3
trong quặng từ 55 60%, độ ẩm: 12 30%,
SiO
2
: 4 10%, Fe
2
O
3
: 1,5 23,6%, TiO
2
: 1,5 2,6% [10].
Bauxit dạng nguyên khai có khả năng hấp phụ thấp, thông qua hoạt hóa
nhiệt làm tăng khả năng hấp phụ của bauxit. Có mối quan hệ giữa nhiệt độ
hoạt hóa, thời gian hoạt hóa với hàm lợng tạp chất d dễ bay hơi với diện
tích bề mặt, độ xốp và khả năng hấp phụ của sản phẩm. Nhiệt độ hoạt hóa
từ 370 400
o
C thờng cho sản phẩm có dung lợng hấp phụ cao và giảm
đợc hàm lợng chất bay hơi từ khoảng 30% xuống còn 6 8%. Sản phẩm tối
u có khả năng hấp phụ 11 16% hơi nớc theo khối lợng của nó. Sản
phẩm có thể tái sinh ở nhiệt độ 150 250
o
C. Bauxit trihydrat (gibbsite) vẫn
giữ đợc nớc tới 30% kể cả khi nung lên đến nhiệt độ 105
o
C và khả năng
hấp phụ rất kém. Khi tăng nhiệt độ hoạt hóa, nớc liên kết bị mất dần, khi
đó diện tích bề mặt và khả năng hấp phụ tăng đáng kể, đạt cực đại ở khoảng
370
o
C. Nếu tiếp tục tăng nhiệt độ hoạt hóa, lợng nớc còn lại tiếp tục giảm
đi nhng diện tích và khả năng hấp phụ cũng giảm.
Trong một số trờng hợp, ngoài hoạt hóa nhiệt ngời ta còn phải loại bỏ
bớt một số tạp chất oxit trong quặng bằng cách xử lý (hòa tan) với axit
clohydric hay flohydric loãng. Ngời ta cũng có thể tinh chế nh sau: cho
bauxit phản ứng với sô đa hay hỗn hợp vôi, sô đa tạo ra dung dịch natri
aluminat, tách dung dịch ra khỏi cặn (Fe(OH)
3
, TiO
2
. SiO
2
) và thủy phân tạo
ra nhôm hydroxit, xử lý nhiệt (dehydrat) thu đợc nhôm oxit. Tác nhân thủy
phân aluminat có thể dùng là axit (H
2
SO
4
, HCl) hoặc một số khí có tính axit
(SO
2
, H
2
S, CO
2
). Phơng án thủy phân khác là cho phản ứng giữa các hợp
chất nhôm có tính kiềm (aluminat, Al(OH)
4
-
) với hợp chất nhôm có tính axit
(Al
2
(SO
4
)
3
, AlCl
3
).
Trong các phòng thí nghiệm để chế tạo Al
2
O
3
ngời ta thờng thủy phân
muối nhôm (sunfat, clorua, axetat), phèn với amoniac, xút, sô đa để thu
nhôm hydroxit sau đó nung lên thành oxit nhôm. Để thu đợc - Al
2
O
3
nhiệt
độ nung thờng không quá cao, 300 600
o
C, diện tích bề mặt của các sản
phẩm có thể đạt 30 300 m
2
/g. [14]
Nhôm oxit đợc sử dụng làm chất sấy khô khí, chất mang xúc tác, xử lý
phân đoạn dầu mỏ, khử mùi, hấp phụ một số chất đặc thù nh florua, asen
[15].
2. 1. 4. Zeolit
Zeolit là tên gọi một nhóm khoáng chất alumosilicat cấu trúc tinh thể,
thành phần hóa học chủ yếu gồm nhôm oxit và silic oxit sắp xếp theo một
Lờ Vn Cỏt
14
trật tự nào đó và với tỉ lệ nhất định. Trật tự sắp xếp và tỉ lệ Al: Si dẫn đến
các loại zeolit khác nhau. Ngoài thành phần hóa học chính kể trên trong
zeolit còn tồn tại các ion dơng (hóa trị 1, 2, 3) không gắn vào vị trí cố định,
nó linh động và có thể trao đổi đợc với các ion khác nên ngoài tính năng
hấp phụ zeolit còn là chất trao đổi ion.
Zeolit có nguồn gốc tự nhiên hay loại tổng hợp. Sự hình thành zeolit tự
nhiên đợc cho là do quá trình tác dụng lâu dài của dung dịch muối khoáng
có tính kiềm lên các loại khoáng vật ở nhiệt độ cao (100 300
o
C). Vì vậy sẽ
là điều ít ngạc nhiên là nhiều loại zeolit đợc phát hiện ở gần những vùng
quặng nóng hay ở các vùng núi lửa đã từng hoạt động. Ví dụ mordenit đợc
phát hiện ở vùng núi lửa Mordern Kings ở Mỹ. [16].
Silicat muối của axit silic, có thể coi là hợp chất của silic với oxy, SiO
2
.
Về mặt cấu trúc, nó tạo thành các khối tứ diện, nguyên tử silic nằm ở trung
tâm. Trong cấu trúc mạng tứ diện [SiO
4
] có thể đợc thay thế bởi các mạng
tứ diện của nhôm [AlO
4
]
-
, của bo [BO
4
]
-
hay beri [BeO
4
]
-
, các khoáng vật này
có tên tơng ứng là alumosilicat, borosilicat và beryllosilicat.
Zeolit thuộc khoáng alumosilicat tinh thể có công thức hóa học tổng quát
Me
2/n
O Al
2
O
3
nSiO
2
pH
2
O [12, 16].
Trong đó Me là ion kim loại kiềm (n=1) chủ yếu là Na, K, kiềm thổ (n=2)
thông dụng là Ca và có thể là Ba, Sr, Mg. Trong một loại zeolit có thể tồn tại
đồng thời nhiều loại ion khác nhau.
Đơn vị cấu trúc cơ bản của zeolit là các khối tứ diện [SiO
4
], [AlO
4
]
-
, chúng
đợc nối kết với nhau qua nguyên tử oxy. Sự thay thế [SiO
4
] bởi [AlO
4
]
-
phá
hủy tính trung hòa điện tích của mạng, nó tích điện âm. Lợng điện tích âm
của mạng đợc trung hòa bởi các ion dơng có tính linh động cao trong
zeolit. Sự sắp xếp các đơn vị cấu trúc cơ bản trong mạng tinh thể zeolit tạo
ra các hốc và các mao quản nối liền các hốc với nhau, các hốc và mao quản
thờng chứa các phân tử nớc.
Phụ thuộc vào trật tự liên kết giữa[AlO
4
]
-
và [SiO
4
] trong mạng tinh thể
ngời ta có thể chia zeolit thành sáu nhóm [7]: natrolith, harmotom,
mordenit, chabasit, faujasit và analcit.
Những mỏ zeolit lớn trên thế giới có nguồn zeolit không sạch, lẫn nhiều
tạp chất vì vậy ít có giá trị về kỹ thuật. Bắt chớc các quá trình địa hóa
trong thiên nhiên, con ngời đã thành công trong việc tổng hợp nhiều loại
zeolit. Rất nhiều loại tổng hợp có cấu trúc và thành phần hóa học giống loại
trong tự nhiên nh thompsonit, harmotom, phillipsit, mordenit, chabasit,
gmelinit, erionit, faujasit, anacit, heulandit, clinoptilolit, có nhiều loại không
tồn tại trong tự nhiên và thậm chí ngời ta còn tổng hợp đợc nhiều loại rất
tinh khiết; điều khiển đợc tính năng hấp phụ của chúng [19]. Nhiều loại
zeolit đợc sử dụng làm vật liệu rây phân tử. Đối với từng loại zeolit ngời
ta có thể biến tính một cách đơn giản để phục vụ cho một mục đích nào đó
thông qua trao đổi ion (loại ion, mức độ trao đổi), ví dụ zeolit X trao đổi với
ion bạc có khả năng hấp phụ khí nitơ cao hơn nhiều so với dạng thông dụng
NaX.
Mc lc
15
Cách sắp xếp của các khối tứ diện SiO
4
, AlO
4
theo hai kiểu: lần lợt hai
khối với nhau có chung nguyên tử oxy và hai ion nhôm có chung một nguyên
tử oxy. Trờng hợp đầu xảy ra khi tỉ lệ mol SiO
2
/Al
2
O
3
> 2 và trờng hợp sau
khi nhỏ hơn 2. (qui tắc Loewenstein).
Các cation trong mạng thờng nằm ở các vị trí của mao quản và các hốc
(cavity), có khả năng dịch chuyển trong mạng. Vị trí của các cation phụ
thuộc vào hóa trị, mức độ hydrat hóa của mạng cũng nh độ khiếm khuyết
của mạng tinh thể.
Zeolit đợc chế tạo theo các phơng pháp:
- Từ zeolit tự nhiên ngời ta loại bỏ các tạp chất trong mao quản bằng
cách chiết với nớc hay với dung môi khác, trong trờng hợp này cấu
trúc mạng tinh thể đợc giữ nguyên.
- Dới tác dụng của dung dịch muối khoáng đậm đặc, chúng đợc tái
kết tinh để chuyển sang một dạng khác.
- Tổng hợp zeolit từ các hóa chất cơ bản: aluminat, silicat kiềm hoặc
kiềm thổ. Phơng pháp này gọi là tổng hợp trực tiếp.
Trong phơng pháp tổng hợp trực tiếp, ngời ta đi từ một gel hỗn hợp có
thành phần: Me
2
O Al
2
O
3
nSiO
2
pH
2
O (kiềm) hay MeO Al
2
O
3
nSiO
2
pH
2
O
(kiềm thổ) bằng cách trộn dung dịch (nớc) aluminat, silicat kiềm hay kiềm
thổ.
Trong một số trờng hợp ngời ta trộn thêm SiO
2
sol để nâng cao hàm
lợng SiO
2
. Khi trộn hỗn hợp trên, gel hình thành một cách nhanh chóng.
Nó đợc kết tinh bằng cách khuấy trộn hay để tĩnh, ở vùng nhiệt độ 50
350
o
C, có thể dùng áp suất cao. Trong giai đoạn này, các tinh thể zeolit hình
thành từ dạng gel vô định hình, nó gồm nhiều pha tinh thể. Tinh thể nhỏ
hình thành và lắng, nó đợc tách khỏi dung dịch kết tinh, rửa với nớc để
loại bỏ các tạp chất không kết tinh, sấy khô để loại bỏ nớc.
Thành phần hóa học của các tinh thể hình thành đợc quyết định bởi
một loạt các yếu tố, về mức độ ảnh hởng có thể xếp theo thứ tự: nhiệt độ kết
tinh, tỉ lệ SiO
2
/Al
2
O
3
và nớc trong hỗn hợp gel, nồng độ kiềm và kiềm d
sau kết tinh. Các yếu tố ảnh hởng khác có thể kể đến là: quá trình rửa, tạp
chất trong nguyên liệu, mức độ khuấy trộn.
Nghiên cứu ảnh hởng của các yếu tố trên lên chất lợng của sản phẩm
là những nghiên cứu tỉ mỉ, công phu vì đồng thời có nhiều yếu tố tác động.
Để tiến hành ngời ta sử dụng phơng pháp giản đồ gọi là giản đồ vùng
kết tinh, tức là mô tả ảnh hởng của hai thông số (tọa độ hai chiều) trong
khi giữ nguyên các yếu tố khác lên sự hình thành và chất lợng zeolit trong
các vùng khác nhau. Hai phơng pháp hay sử dụng và có ý nghĩa thực tiễn
là phơng pháp Barrer và Zdanov. [16, 19].
Giản đồ vùng kết tinh của Barrer là một tọa độ hai chiều, trục x thể hiện
tỉ lệ nồng độ mol của SiO
2
/Al
2
O
3
= n, trục y thể hiện nhiệt độ kết tinh. Ví dụ
Barrer tạo ra gel có thành phần Na
2
O Al
2
O
3
nSiO
2
pH
2
O bằng cách trộn
dung dịch natri aluminat, natri hydroxit, natri silicat. Tỉ lệ n = SiO
2
/Al
2
O
3
nằm trong khoảng 1 n 12. Lợng Na
2
O luôn là 100%, 200%, 300% so với tỉ
Lờ Vn Cỏt
16
lệ mol Na
2
O: Al
2
O
3
= 1, tơng ứng với trờng hợp trong dung dịch có 2
Na
2
O/Al
2
O
3
, 3 Na
2
O/Al
2
O
3
và 4 Na
2
O/Al
2
O
3
. Nớc và các thành phần khác
đợc ấn định thông qua các tỉ lệ trên. Thời gian kết tinh đợc chọn là đến
thời điểm hình thành sản phẩm tinh thể. Lợng Na
2
O d (kiềm) là một yếu
tố hết sức quan trọng trong việc hình thành dạng zeolit. Từ các nghiên cứu
này cho phép xác định các điều kiện hình thành loại zeolit và chất lợng của
chúng.
Ví dụ để chế tạo zeolit NaA (nhóm faujasit) thì lợng Na
2
O d nhỏ
(khoảng 100%), giá trị n<2, nhiệt độ cần thấp (90
o
C hay thấp hơn). Tại n=2,
Na
2
O d 200 300%, nhiệt độ kết tinh 110
o
C thì xuất hiện cả zeolit P.
Để tổng hợp zeolit 13X hay NaX (nhóm faujasit) điều kiện là n= 2,2 2,5,
lợng Na
2
O d cao (300%), nhiệt độ kết tinh giữ thấp ở mức có thể (60
100
o
C). Cùng trong điều kiện đó nếu nhiệt độ kết tinh 90 - 100
o
C thì hình
thành zeolit P.
Zdanov sử dụng giản đồ vùng kết tinh khác: trục x là giá trị n, trục y thể
hiện nồng độ Na
2
O d. Hàm lợng nớc p trong hỗn hợp gel đợc xác định
thông qua nồng độ Na
2
O tơng ứng. Với giản đồ này ngời ta có thể xác định
đợc sự hình thành các loại zeolit và độ tinh khiết của chúng phụ thuộc vào
điều kiện tổng hợp.
Ví dụ với thành phần của hỗn hợp gel là: nồng độ Na
2
O d 0,16 đến 2,12,
n = 2,12 2,16, nhiệt độ kết tinh 90
o
C sẽ hình thành zeolit 4A hay NaA.
Qua đó cho thấy sự hình thành các loại zeolit và độ tinh khiết của sản
phẩm đợc quyết định chủ yếu bởi tỉ lệ SiO
2
/Al
2
O
3
, nhiệt độ kết tinh và
lợng kiềm d.
Trong quá trình kết tinh, tinh thể hình thành có độ lớn 0,1 đến 10 àm.
Độ lớn tinh thể có ảnh hởng tới một số tính chất sử dụng nó trong kỹ thuật.
Ví dụ khi tạo hạt ngời ta thờng đa thêm chất kết dính vào (5 20% đất
sét), kích thớc hạt tinh thể nhỏ tạo ra sản phẩm hạt có độ bền cao và ảnh
hởng tốt tới quá trình khuếch tán trong vùng mao quản nhỏ, nhng ảnh
hởng không tốt đến quá trình khuếch tán trong hệ mao quản thứ cấp [18].
ảnh hởng của các điều kiện tổng hợp đến độ lớn kích thớc hạt có thể
tóm tắt nh sau [16]:
- Nồng độ kiềm trong hỗn hợp gel giảm làm tăng kích thớc.
- Tỉ lệ SiO
2
/ Al
2
O
3
cao khi giữ nguyên nồng độ Na
2
O thì làm tăng kích
thớc hạt tinh thể.
- Nhiệt độ kết tinh (giữ các yếu tố khác không đổi) tác động rất ít tới
kích thớc hạt.
Những kết luận từ thực nghiệm trên đây dẫn đến nhiều định hớng ứng
dụng thú vị: với zeolit A, khi tổng hợp ở độ kiềm cao, tinh thể hình thành có
kích thớc nhỏ và trở nên có dạng hình cầu, một nguyên liệu lý tởng dùng
làm phụ gia chất tẩy rửa.
Chỉ cần thay đổi nồng độ Na
2
O với nhiệt độ kết tinh là 90
o
C có thể tạo ra
NaA, CaA với kích thớc 0,1 àm; nguyên liệu rất thích hợp cho các ứng dụng
mà trong đó tốc độ quá trình bị khống chế bởi khuếch tán trong.
Mc lc
17
Zeolit là chất hấp phụ xốp, độ xốp của nó chính là các kênh nối các hốc và
các hốc. Kích thớc của các kênh và các hốc có giá trị xác định đối với từng
loại zeolit, diện tích của các hốc và kênh (gọi chung là mao quản) chính là
diện tích bề mặt trong của zeoit. Diện tích này đợc hình thành chủ yếu là
do các nguyên tử oxy (bán kính của oxy là 1,32, của Si là 0,39 và Al là 0,57
A
o
), vì vậy bề mặt của zeolit có tính phân cực cao. Hệ thống mao quản gồm
các kênh và hốc đợc gọi là hệ mao quản sơ cấp. Lối ra vào của các hốc và
kênh đợc bao quanh bởi các nguyên tử oxy. Với các zeolit khác nhau thì
kích thớc các cửa cũng khác nhau. ở xung quanh cửa, các cation định vị ở
quanh đó, nó che hoặc chắn một phần tiết diện cửa sổ. Dới tác dụng lực của
các chất bị hấp phụ, vị trí của các cation có thể bị lệch khỏi vị trí cân bằng.
Các cation có kích thớc lớn chắn mất nhiều không gian hơn loại nhỏ. Khi
trao đổi cation với các ion hóa trị cao hơn hoặc với zeolit có tỉ lệ SiO
2
/Al
2
O
3
cao thì mật độ các cation trong zeolit giảm, hiệu quả là cửa sổ của chúng
đợc mở rộng tạo điều kiện thuận lợi cho quá trình khuếch tán của các chất
bị hấp phụ trong đó. Kích thớc có giá trị xác định của các cửa sổ có thể cho
phép hay ngăn cản các phân tử khác xâm nhập vào tới bề mặt trong của
zeolit vì vậy zeolit còn đợc gọi là vật liệu rây phân tử.
Trong kỹ thuật, zeolit rất ít khi đợc sử dụng ở dạng bột, chúng thờng
đợc tạo viên với chất kết dính. Trong quá trình tạo viên hình thành hệ mao
quản thứ cấp. Diện tích bề mặt của hệ mao quản thứ cấp chính là diện tích
của các hạt tinh thể, nó nhỏ so với diện tích của hệ mao quản sơ cấp, ít khi
vợt quá 5 m
2
/g so với diện tích 700 1200 m
2
/g. Kích thớc của mao quản
thứ cấp phụ thuộc vào cỡ hạt tinh thể, sự phân bố kích thớc của chúng,
hàm lợng chất kết dính cũng nh áp suất tạo viên. Nhìn chung bán kính,
mao quản thức cấp gần với giá trị độ lớn của hạt tinh thể, phổ phân bố kích
thớc rộng dẫn tới giảm bán kính hiệu dụng của hệ ma quản. Hàm lợng
chất kết dính cao và áp suất nén lớn cũng làm giảm độ xốp của nó. Quá
trình tạo hạt ít ảnh hởng tới dung lợng hấp thụ của zeolit.
Lực hấp thu của zeolit chủ yếu là lực tơng tác tĩnh điện hay định hớng,
lực tán xạ đóng góp không nhiều. Vì vậy các phân tử có tơng tác lỡng cực,
tứ cực hay phân cực hấp phụ tốt hơn nhiều so với các phân tử không phân
cực và loại liên kết đơn. Zeolit đợc sử dụng làm chất hấp phụ trong công
nghệ lọc dầu: tách các n paraffin ra khỏi hỗn hợp iso paraffin hoặc các
chất thơm do hiệu ứng rây phân tử. Do tiết diện của các n paraffin nhỏ có
thể tiếp cận đợc với bề mặt trong của zeolit A trong khi iso paraffin và
chất thơm có tiết diện lớn không tiến sâu vào đến đợc các hốc zeolit (quá
trình tách paraffin trong pha khí Parex, trong pha lỏng Molex). Tuy nhiên
hiệu ứng rây phân tử không nên đánh giá một cách cứng nhắc vì khái niệm
về đờng kính của cả mao quản lẫn chất bị hấp phụ cũng là những khái
niệm không cứng nhắc, bị chi phối bởi nhiều yếu tố. Zeolit cho phép tách các
hợp chất có độ phân cực khác nhau, vì thế chúng đợc sử dụng khá rộng rãi
trong kỹ thuật tinh chế nhiều loại chất lỏng, chất khí, tách oxy và nitơ của
không khí, trong kỹ thuật chân không, và phân tích kể cả hấp phụ chất
phóng xạ.
Lờ Vn Cỏt
18
Zeolit đợc sử dụng rộng rãi trong kỹ thuật xúc tác với chức năng là chất
hấp phụ nhằm loại bỏ những tác nhân gây hại cho xúc tác, là xúc tác trực
tiếp cho một số quá trình hóa dầu hay là thành phần của xúc tác hỗn hợp (ví
dụ với silicat).
Zeolit đợc sử dụng làm chất trao đổi ion, đôi khi có lợi thế hơn về một số
mặt so với nhựa trao đổi: dung lợng trao đổi lớn và độ chọn lọc cao đối với
các ion kim loại, độ trơng nở trong nớc thấp, những đặc tính này rất có ích
trong công nghệ. Tuy vậy nó chỉ là các cationit và độ bền đối với môi trờng
kém, nó chỉ chịu đợc trong khoảng pH từ 5 12 trừ một vài loại đặc thù.
Dung lợng trao đổi ion của zeolit A là 7,0 mđl/g ứng với 5,1 mol/ml trong
khi đối với nhựa loại Dowex 50 số liệu tơng ứng là 4,7 mđl/g hay 1,8
mđl/ml.
Rất nhiều nớc sản xuất và zeolit đợc lu hành rộng rãi với t cách là
thơng phẩm, sau đây là một số loại với một số đặc tính kỹ thuật và lĩnh vực
sử dụng.
Linde 3A. Sản phẩm của Union Carbid Corp. Linde Co. USA. Đờng
kính mao quản 3,8 A
o
, có thể hấp phụ các chất có đờng kính phân tử 3,8 A
o
.
Công thức hóa học: (0,96 0,04) Na
2
O. 1,0 Al
2
O
3
. (1,92 0,09)SiO
2
. nH
2
O;
75% Na
+
đợc trao đổi với K
+
. Nó đợc sử dụng để sấy khô (hấp phụ hơi
nớc) các khí CO
2
, hỗn hợp CO
2
và H
2
S, hydrocarbon các loại. Tơng tự tính
năng với Linde 3A có: Z 12K (Mỹ), Bayer zeolith S10 (Đức), Zeosorb 3A
Wolfen (Đông Đức), Potassti 3A (Tiệp), các loại KA (Liên Xô).
Linde 4A (Mỹ). Đờng kính mao quản 4,2 A
o
có thể hấp phụ đợc các loại
hydrocarbon nhẹ (etan, propylen, acetylen), SO
2
, H
2
S, không hấp phụ đợc
loại cao hơn. Công thức hóa học giống nh Linde 3A, dạng Na
+
thuần tuý.
Nó đợc sử dụng để tách các tạp chất kể trên khỏi hỗn hợp và sấy khô.
Tơng tự với Linde 4A có: Linde 4A xw, Linde 4A XH (Mỹ), Z 12 Na
Microtrap (Mỹ), ICD 05050 Typ 180 (Mỹ), Zeosorb 4A (Đông Đức), Nalcit
4A (Tiệp), NaA số thứ tự (Liên Xô), Bayer zeolith T10 (Đức), Siliporit K10
(Anh), 4A Sodawerke (Ba Lan).
Riêng loại Linde 4A XW giống cấu trúc của Linde 4A, khác ở chỗ hàm
lợng chất kết dính thấp hơn 15%, độ bền cơ học cao hơn (gấp đôi), khối
lợng riêng biểu kiến lớn hơn Linde 4A, dung lợng hấp phụ cao hơn Linde
4A 30 40%. Loại này chỉ dùng để sấy khô.
Loại Linde 4A XH chỉ dùng để sấy khô khí trong kỹ thuật lạnh, các khí
lạnh phá hủy nó.
Linde 5A (Mỹ). Đờng kính mao quản 5 A
o
. Nó hấp phụ hydrocarbon tới
C
22
, iso paraffin, hợp chất thơm (trừ cyclo propan) không hấp phụ. Công
thức hóa học giống Linde 4A trong đó 75% Na
+
đợc thay thế bằng Ca
2+
. Nó
đợc sử dụng để tách n- paraffin, trong phân tích sắc kí. Tơng tự tính năng
với Linde 5A có: Linde AW 400, Linde AW 500, Z 12 Ca Microtrap (Mỹ),
Zeosorb 5A (Đông Đức), Calsit 5A (Tiệp), CaA + số thứ tự (Liên Xô), Bayer
Zeolith K10 (Đức), Siliporit K20 (Anh), 5A (Ba Lan).
Mc lc
19
Linde 10X (Mỹ). Đờng kính mao quản 8 A
o
. Công thức hóa học (0,83
0,05) Na
2
O. 1,0 Al
2
O
3
. (2,48 0,03)SiO
2
. nH
2
O. 75% Na
+
đợc thay thế bởi
Ca
2
+
. Nó đợc sử dụng để tách chất, kỹ thuật chân không và xúc tác. Tơng
tự tính năng với Linde 10X có: Zeolon Na (Mỹ), Zeosorb 10X (Đông Đức),
Calsite 10X (Tiệp), CaX + số thứ tự (Liên Xô).
Linde 13X (Mỹ). Đờng kính mao quản 9 A
o
. Công thức hóa học giống
Linde 10X, thuần tuý dạng Na
+
. Nó đợc sử dụng để tách chất, trong kỹ
thuật chân không, xử lý các khí và hơi nhiễm phóng xạ. Tơng tự với tính
năng của Linde 13X có: Zeolon H (Mỹ), Zeosorb 13X (Đông Đức), Nalcit 13X
(Tiệp), NaX + số thứ tự (Liên Xô).
Zeolit dạng NaA và NaX dạng bột có một số thông số liên quan đến cấu
trúc nh sau: diện tích bề mặt trong 700 800 m
2
/g, độ xốp 45% (NaA), 51%
(NaX), khối lợng riêng thực khi no nớc (không sấy) 1,99 và 1,93 g/cm
3
cho
NaA và NaX, khi sấy khô tơng ứng là 1,55 và 1,53 g/cm
3
[16].
Những năm trong thập kỷ 70, ở Việt Nam có tiến hành một số nghiên
cứu chế tạo zeolit dạng A, X từ sét caolin và đạt đợc một số kết quả nhất
định. Việc sản xuất ổn định để có đợc một mặt hàng zeolit đã không đợc
thực hiện, rất có thể do nhu cầu không nhiều, chất lợng cha cao. Gần đây
zeolit AlPO
4
- 5, ZSM đợc nghiên cứu tổng hợp và khảo sát các ứng dụng
[20, 21, 22].
Hiện có xu hớng tổng hợp một số loại zeolit có giá thành rẻ từ các
nguyên liệu thải bỏ công nghiệp, đặc biệt là bã thải rắn từ quá trình đốt
than đá (nhiệt điện) là loại tro bay hoặc xỉ than. Thành phần chủ yếu của tro
bay hoặc xỉ than là Al
2
O
3
(20 30%), SiO
2
(45 60%). Hoạt hóa với kiềm
(KOH, NaOH) và kết tinh sẽ thu đợc một số zeolit dạng: philipsit,
merlinoit, analcime, Na P1 [23, 24]. Zeolit rẻ tiền này có thể sử dụng xử
lý nớc thải chứa kim loại nặng, phóng xạ và một số tạp chất khác.
2. 1. 5. Sắt oxit
Trong công nghệ xử lý nớc và nớc thải, một trong những nguyên tố hay
gặp là sắt ở dạng ion 2. Sắt (II) có nồng độ tới 70 80 mg/l tại một số nguồn
nớc ngầm, trong một số ngành công nghiệp mạ, gia công bề mặt kim loại
sắt (II) trong nớc thải có thể tới 150 g/l, ví dụ trong nớc thải quá trình
tráng kẽm trên thép (sản xuất ống nớc). Mặt khác trong tự nhiên tồn tại
rất nhiều sắt oxit (limonit, lepidokrokit) hay chất thải của một số quá trình
sản xuất công nghiệp (sản xuất axit sunfuric từ quặng pyrit).
Sắt (II) hydroxit, Fe(OH)
2
là chất kết tủa xốp dạng đám mây, màu xanh
nhạt, để ngoài không khí sẽ ngả sang màu vàng do bị oxy hóa thành sắt (III)
hydroxit. Hợp chất trung gian là hỗn hợp của sắt (II, III) hydroxit. Trong
môi trờng xút, sắt (II) hydroxit chuyển hóa thành natri hydroxo ferrat (II),
Na
2
[FeOH
4
], dạng tinh thể màu xanh lá cây.
Sắt (III) hydroxit, màu vàng sẫm, cấu trúc vô định hình. Qua phổ
Rơnghen cho thấy: không tồn tại công thức hóa học Fe(OH)
3
một cách
nghiêm ngặt mà công thức tổng quát là Fe
2
O
3
. nH
2
O. Kết quả nghiên cứu
cấu trúc bằng Rơnghen cho thấy có hai dạng thù hình là , có cùng công
Lờ Vn Cỏt
20
thức hóa học FeOOH hoặc Fe
2
O
3
. H
2
O và có tên là , sắt hydroxit (sắt oxit
hydrat) , - FeOOH. Tất cả các sắt (III) hydroxit khác đều chỉ chứa các
lợng nớc khác nhau. Trong tự nhiên - FeOOH là thành phần chính của
quặng goethit, còn - FeOOH thì trong lepido Crocit. Ngoài hai dạng thù
hình kể trên còn tồn tại một loại khác, - FeOH, hình thành từ quá trình
thủy phân chậm muối FeCl
3
. Limonit là một loại quặng sắt (quặng sắt nâu)
quan trọng cho công nghệ luyện kim (hàm lợng sắt 30 60%) là hỗn hợp
của goethit (chủ yếu) và lepidokrokit, có lẫn một lợng nhỏ sắt (III) hydroxit
gel [25].
Sắt (III) hydroxit hình thành qua quá trình thủy phân của muối sắt (III)
với kiềm. Sắt (III) hydroxit vừa kết tủa có hoạt tính hấp phụ cao đối với
nhiều tạp chất trong nớc, ví dụ với arsen và một số các ion kim loại nặng.
Sắt (II) oxit, FeO là dạng bột có màu đen, vô định hình, tạo thành từ quá
trình khử sắt (III) oxit với hydro hay khí CO hoặc nung sắt (II) oxalat không
có mặt oxy. Công thức hóa học chính xác là Fe
0,90
O đến Fe
0,95
O. Một số vị trí
thiếu đợc bù bởi Fe(III). Trong tự nhiên sắt (II) oxit tồn tại chủ yếu trong
quặng Wustit O
2-
Fe
2+
O
2-
Fe
2+
.
Sắt (III) oxit, Fe
2
O
3
với cấu trúc Fe
3+
O
2-
O
2-
O
2-
Fe
3+
O
2-
, bột màu nâu sẫm,
tồn tại ở hai dạng thù hình, - Fe
2
O
3
và - Fe
2
O
3
. - Fe
2
O
3
là tinh thể cấu
trúc khối lập phơng có tính sắt từ, tạo thành trong quá trình oxy hóa chậm
của sắt (II, III) oxit Fe
3
O
4
. Nung - Fe
2
O
3
lên trên 300
o
C nó sẽ chuyển sang
dạng bền, thuận từ - Fe
2
O
3
. Dạng cũng hình thành khi nung sắt (III)
hydroxit (sắt oxit hydrat), sắt (III) nitrat hoặc nung sắt trong dòng oxy.
Tính chất của các sản phẩm sắt oxit rất phụ thuộc vào điều kiện chế tạo.
Fe
2
O
3
chế tạo ở vùng nhiệt độ thấp tan dễ trong axit loãng, nếu xử lý ở nhiệt
độ cao thì hầu nh không tan ngay cả trong dung dịch axit đặc. Sắt (III)
hydroxit vừa kết tủa có hoạt tính cao, rất xốp, oxit sắt là sản phẩm nung
ngợc lại rất cứng có thể dủng làm chất mài bóng cho thủy tinh, kim loại và
một số loại đá. Sắt (III) oxit hay đợc sử dụng làm chất tạo màu sơn, phụ gia
cho polyme cao su.
Một trong những phơng pháp thông dụng tổng hợp sắt (III) hydroxit
hay oxit là kết tủa từ muối sắt (III) và về phơng diện chất hấp phụ, xúc tác
thì thành phẩm cần có chính là dạng - FeOOH hoặc - Fe
2
O
3
. Dạng này có
nhiều khuyết tật tinh thể và diện tích bề mặt có thể tới 200 300 m
2
/g.
Rất nhiều công trình nghiên cứu điều kiện kết tủa Fe(III) và các dạng
sản phẩm tạo thành trong mối tơng quan của nồng độ Fe(III), tỉ lệ
Fe(III)/OH
-
, pH, nhiệt độ, loại anion (Cl
-
, SO
4
2-
, NO
3
-
, F
-
, ClO
4
-
) [26, 27, 28]
Thủy phân Fe(III) xảy ra theo bậc:
Fe(III) + H
2
O
Fe(OH)
2+
+ H
+
FeOH
2+
+ H
2
O Fe(OH)
2
+
+ H
+
2 FeOH
2+
Fe
2
(OH)
2
4+
Sơ đồ phản ứng trên xảy ra trong điều kiện nồng độ Fe(III) loãng, sản
phẩm sinh ra không chỉ là các monome mà còn hình thành dime, trime thậm
Mc lc
21
chí cả polyme với các cầu nối là oxy hoặc OH (trùng ngng kiểu oxolation và
olation). Các polyme này kết tụ với nhau tạo thành dạng gel khi nồng độ cao.
Khi đa kiềm (NaOH, NaHCO
3
, NH
3
) vào dung dịch Fe(III) thì màu của
dung dịch thay đổi, khi tỉ lệ OH/Fe>2,8 thì lập tức hình thành kết tủa. Ví dụ
khi OH/Fe 0,7 thì màu của dung dịch chuyển từ màu vàng sang da cam,
khi tiếp tục đa thêm kiềm vào pH của hỗn hợp đạt mức cực đại rồi giảm và
hầu nh không đổi cho tới khi OH/Fe = 2,6. Sự tăng hay giảm pH theo thời
gian phụ thuộc vào tốc độ đa kiềm vào hệ. Nếu cho nhanh thì sau đó pH
của hệ giảm dần, ngợc lại nếu cho kiềm chậm thì sau đó pH tăng nhẹ do
quá trình phân ly các polyme hình thành mang tính cục bộ trớc đó [27].
Kết tủa Fe
2
(SO
4
)
3
với NH
4
OH hay NaOH cho thấy thành phần pha, độ
tinh thể, tỉ lợng, tính chất từ của sản phẩm tạo thành phụ thuộc rất lớn
vào tỉ lệ [OH]/[Fe
3+
] của dung dịch khi bắt đầu kết tủa, thời gian và nhiệt độ
của hệ trong suốt quá trình.
Thành phần anion của muối nguyên liệu cũng ảnh hởng tới thành phần
pha kết tủa cũng nh độ lớn và hình dạng của hạt tạo thành. Ví dụ khi kết
tủa sắt (III) nitrat thì sản phẩm tạo thành là dạng - FeOOH (goethit), hạt
càng mịn khi tốc độ cho kiềm nhanh. Nếu sử dụng sắt (III) peclorat hay
clorua, tốc độ cho kiềm chậm thì sản phẩm chủ yếu là - FeOOH
(lepidocrocit) và - FeOOH. Nhng nếu tốc độ cho kiềm nhanh thì tạo thành
- FeOOH. [27].
Khi sử dụng sắt (III) sunfat để kết tủa, sản phẩm hình thành phức tạp
hơn ngoài sắt hydroxit: muối kiềm và sắt jarosite. Muối kiềm là một phức
chất của sắt hydroxit với chính muối của nó, ví dụ FeOOH. Fe
2
(SO
4
)
3
.
Trờng hợp kết tủa sắt (III) sunfat hình thành muối kiềm dạng
Fe
16
O
16
(OH)
12
(SO
4
)
2
. Sắt jarosite có công thức hóa học chung là
MFe
3
(OH)
6
(SO
4
)
2
, M = H
+
, Na
+
, K
+
, Rb
+
, Ag
+
, NH
4
+
, 1/2 Pb
2+
hay 1/2 Hg
2+
.
[25].
Nhìn chung sản phẩm kết tủa có nhiều dạng, phụ thuộc vào điều kiện
tổng hợp của nó.
Ngời ta có thể biến tính sắt oxit bằng cách cấy một số nguyên tố vào
mạng (Cr, Ga, Zn, Co, Ag) bằng cách nung hỗn hợp hydroxit tơng ứng hoặc
xử lý cơ học sau đó nung tiếp tục [29, 30, 31] và có thể tạo ra vật liệu
composit dạng nanocluster [32].
Trong kỹ thuật xử lý nớc ngời ta chế tạo các vật liệu lọc bằng cách phủ
một lớp sắt oxit lên cát thạch anh dùng để hấp phụ kim loại nặng trong nớc
và nớc thải [33, 34].
2. 1. 6. Chất hấp phụ vô cơ tự nhiên và sản phẩm biến tính
Trong tự nhiên tồn tại một số chất vô cơ có diện tích bề mặt lớn có thể sử
dụng làm chất xúc tác và hấp phụ. Do có sẵn trong thiên nhiên nên các loại
chất này có giá thành hạ, tuy nhiên chất lợng của chúng không phải khi
nào cũng đáp ứng đ ợc cho nhu cầu sử dụng nên nó đợc biến tính bằng các
biện pháp khác nhau.
Lờ Vn Cỏt
22
Chất hấp phụ vô cơ trong tự nhiên chủ yếu là silic oxit, nhôm oxit và
alumosilicat. Phần nhôm oxit đã đợc trình bày ở 2. 1. 3.
Điển hình của họ silic oxit trong tự nhiên là diatomit, thành phần hóa
học chủ yếu là SiO
2
, có cấu trúc vô định hình. Diatomit là sản phẩm phân
hủy của tảo diatome (tảo cát) nên thành phần hóa học không ổn định,
thờng từ 70 90% SiO
2
, 3 12% là nớc, chất hữu cơ, tạp chất vô cơ (sắt
oxit) chiếm một phần nhỏ trong đó. Thành phần SiO
2
chính là các khung
xơng của tảo sau khi phần hữu cơ đã phân hủy, độ xốp của diatomit rất lớn
chiếm 80 90%, diện tích bề mặt của loại cha biến tính 10 25 m
2
/g, loại
đã biến tính đạt tới 54 m
2
/g. [35]. Do có độ xốp lớn nên nó đợc sử dụng làm
chất cách nhiệt, cách âm và do có diện tích bề mặt lớn nên nó đợc sử dụng
làm chất hấp phụ, chất mang xúc tác, chất mang sắc kí và chất trợ lọc.
Sau khi đợc khai thác từ mỏ, nguyên liệu cần phải đợc tinh chế: loại bỏ
nớc, cát sạn và các tạp chất (oxit sắt) và tạp chất hữu cơ.
Tách cát sạn có thể tiến hành theo hai cách: nghiền mịn khuấy vào nớc
và tách phần cát lắng ở đáy hoặc đơn giản là tách theo rây.
Sau khi sấy khô có thể nung ở 600 800
o
C để loại bỏ tạp chất hữu cơ -
Trong trờng hợp sử dụng làm chất trợ lọc (bia, thực phẩm). Sản phẩm sau
đó đợc nghiền và phân loại.
Sản phẩm tạo ra theo cách xử lý trên có chất lợng không cao, nó sẽ có
màu sẫm nếu hàm lợng sắt lớn hơn 1,5%. Để loại bỏ sắt ngời ta có thể áp
dụng hai phơng pháp: ớt và khô. Trong phơng pháp ớt, diatomit đợc
khuấy trong dung dịch axit HCl 7 12% tại 80
o
C hoặc với axit sunfurơ (SO
2
trong nớc) dới nhiệt độ và áp suất cao. Trong quá trình xử lý với axit
sunfurơ tạo thành muối sắt và canxi tan. Phơng pháp khô là dùng tác nhân
khí clo hay muối kiềm clorua (NaCl) nung ở nhiệt độ cao 500 700
o
C, trong
quá trình nung tạo ra sắt (III) clorua bay hơi.
Để chế tạo chất trợ lọc (bia, thực phẩm) ngời ta thờng bổ xung muối
kiềm (NaCl, Soda, 3 10%) và nung ở nhiệt độ 550 600
o
C. Nếu dùng thủy
tinh lỏng thì sản phẩm có màu trắng.
Diatomit cũng đợc sử dụng làm chất mang sắc kí, chất mang đòi hỏi
phải có độ xốp lớn, diện tích bề mặt thấp, các mao quản có độ lớn đều. Để đạt
các chỉ tiêu đó, diatomit đợc trộn với phụ gia (NaCl, Soda) và nung ở nhiệt
độ cao. Độ xốp của sản phẩm có thể đạt 1,8 2,1 cm
3
/g, diện tích bề mặt thấp
1 2m
2
/g. Hai loại chất mang khá điển hình là chromosorb p và w. Hai loại
khác nhau về độ xốp, diện tích bề mặt và màu sắc của sản phẩm (w trắng,
p màu gạch non). Xử lý với axit có thể làm tăng diện tích bề mặt của
diatomit để dùng cho một số mục đích nhất định.
Alumosilicat tự nhiên hoặc loại biến tính cũng đợc dùng rộng rãi làm
chất hấp phụ (đặc biệt đối với loại có phân tử lợng lớn nh polyme), chất
trao đổi ion và làm chất tẩy màu.
Alumosilicat trong tự nhiên gồm chủ yếu hai loại: loại cấu trúc tinh thể
zeolit và loại cấu trúc lớp họ khoáng sét.
Khoáng sét lúc đầu đợc các nhà địa chất định nghĩa là thành phần
khoáng vật mịn dạng keo có kích thớc hiệu dụng nhỏ hơn 2àm, tuy nhiên
Mc lc
23
việc định nghĩa và phân loại nh vậy chỉ phù hợp và tiện ích với phơng tiện
nghiên cứu thời đó cho các nhà địa chất.
Phần lớn các khoáng sét có cấu trúc lớp thuộc họ phyllosilicat. Khoáng
sét bao gồm các lớp (tính theo trục đứng d(001)) của silic oxit và nhôm oxit
xếp theo một trật tự nhất định, ví dụ nếu cứ lần lợt một lớp silic oxit rồi tới
một lớp nhôm oxit ta có cấu trúc 1: 1, nếu lớp nhôm oxit bị kẹp giữa hai lớp
silic oxit thì ta có cấu trúc 2: 1. Ngoài ra còn có loại cấu trúc 2: 1: 1 nhng nó
ít có ý nghĩa về mặt chất hấp phụ.
Lớp silic oxit đợc tạo bởi các tứ diện Si (O,OH), nguyên tử silic nằm ở
giữa, mặt phẳng phía dới là các nguyên tử oxy, mặt trên (chóp) là các nhóm
OH. Lớp nhôm oxit tạo thành hình tám mặt, các mặt phẳng phía trên và
dới nguyên tử nhôm là các nhóm OH.
Trong cấu trúc 1: 1 (caolin) mặt chóp của lớp silic oxit hớng về mặt
phẳng chứa OH của lớp nhôm hydroxit, còn trong cấu trúc 2: 1 thì cả hai
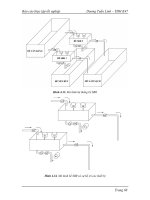
mặt phẳng OH của lớp silic đều hớng về lớp nhôm nằm ở giữa (xem hình 1).
Các nguyên tử Si, Al có thể bị thay thế đồng hình bởi các nguyên tố có cùng
kích thớc và cùng số phối trí nhng có hóa trị nhỏ hơn và sẽ gây ra điện
tích âm cho toàn mạng, để lập lại thế trung hòa điện tích nó phải hấp phụ
các cation từ bên ngoài, chúng có thể hoặc không thể trao đổi.
Hình 2, 3 cho thấy độ dày của lớp sét cấu trúc 1: 1 (caolinit) là 7,2 A
o
, và
của cấu trúc 2: 1 (montmorilonit) là 9,5 A
o
. Hạt sét có độ dày khoảng 0,05 -
2àm nên nó là tập hợp của hàng vạn lớp xếp chồng lên nhau, từng lớp sét
cũng tiếp tục phát triển theo chiều ngang. Các lớp này liên kết với nhau
thông qua lực tơng tác cầu hydro, lực Van de Waals hoặc tĩnh điện.
Ôxy
OH
-
Nhôm
Silic
Hình 1: Cấu trúc lớp Silic và lớp nhóm trong mạng Silicat