DE KT hoc ki II - Hoa 8
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (50.69 KB, 3 trang )
Trờng PTDT Nội trú kiểm tra học kỳ ii
Văn Lãng môn: Hoá học 8
Thời gian làm bài: 45'
I/ Mục tiêu:
1. Kiến thức:
- Chủ đề 1: Tính chất và cách điều chế oxi, hiđro
- Chủ đề 2: Các loại phản ứng hoá học, các hợp chất vô cơ
- Chủ đề 3: Dung dịch, nồng độ dung dịch
- Chủ đề 4: Tính toán hoá học
2. Kỹ năng:
- Có kỹ năng viết PTHH
- Nhận biết các chất.
- Giải bài tập tính theo PTHH, tính khối lợng chất d sau phản ứng.
3. Thái độ:
- Cẩn thận, nghiêm túc khi làm bài
II/ Hình thức kiểm tra: Tự luận
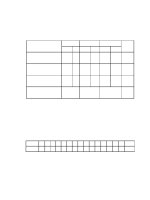
III/ Ma trận:
Cấp độ
Chủ đề
Nhận biết Thông hiểu
Vận dụng
TổngCấp độ thấp Cấp độ cao
Hiđro - Oxi
Khái niệm về sự
oxi hoá, sự khử,
chất oxi hoá, chất
khử
Phân biệt các
khí
Số câu 1 1 2
Số điểm 1 1
2
20%
Các loại phản
ứng hoá học,
các loại hợp
chất vô cơ
Nhận biết các
loại hợp chất vô
cơ, tên gọi
Hoàn thành
PTHH, xác
định loại phản
ứng
Số câu
1
1 2
Số điểm 2 2
4
40%
Dung dịch,
nồng độ
dung dịch
Tính nồng độ
%, nồng độ mol
của dung dịch
Số câu 1 1
Số điểm 2
2
20%
Tính toán hoá
học
Tính khối lợng
chất d sau phản
ứng.
Số câu 1 1
Số điểm 2
2
20%
Tổng
3 điểm
30%
2 điểm
30%
2 điểm
20%
3 điểm
20%
10
điểm
100%
II. Đề bài:
Câu 1: (2 điểm): Các chất sau đây thuộc loại hợp chất nào, đọc tên mỗi chất: K
2
O,
Al(OH)
3
; HCl ; NaHSO
4
Câu 2: (1 điểm): Nêu các khái niệm: sự oxi hoá, sự khử, chất oxi hoá, chất khử?
Câu 3: (1 điểm): Phân biệt các chất khí sau: O
2
, CO
2
, H
2
. Viết PTHH (nếu có)
Câu 4: (2điểm)
Hoàn thành các phản ứng sau ; cho biết chúng thuộc loại phản ứng nào ?
a- Al + HCl t
o
AlCl
3
+ H
2
b- Mg + O
2
t
o
MgO
c- Fe
2
O
3
+ H
2
t
o
Fe +
H
2
O
d- Fe
(OH)
3
t
o
Fe
2
O
3
+ H
2
O
Câu 5 ( 2 điểm)
a) Tính nồng độ phần trăm của 30g KCl trong 600g dung dịch KCl
b) Tính nồng độ mol của 0,5mol CuCl
2
trong 400ml dung dịch CuCl
2
Câu 6 ( 3 điểm)
Cho 22,4g sắt tác dụng với dung dịch chứa 29,4g axit sunfuric H
2
SO
4
a- Viết phơng trình phản ứng xảy ra?
b- Chất nào d sau phản ứng, d bao nhiêu gam?
b- Tính thể tích khí hiđro thu đợc (ở đktc)?
(Biết H = 1 , O = 16 , S = 32 , Fe = 56)
III. Đáp án
Câu 1 : (2 điểm): Xác định đợc mỗi công thức và đọc tên đợc 0,5 điểm:
K
2
O là oxit bazơ - Kali oxit
Al(OH)
3
là Bazơ - Nhôm hiđroxit
HCl là axit - Axit clohiđric
NaHSO
4
là muối - Natri hiđro sunfat
Câu 2: (1 điểm): Phân biệt các chất khí: O
2
, CO
2
, H
2
.
- Dùng nớc vôi trong: Nhận ra CO
2
do làm nớc vôi trong vẩn đục (0,25đ)
- Dùng que đốm có tàn đỏ, khí nào làm que đóm bùng cháy là O
2
, khí còn lại không
làm que đóm bùng cháy là H
2
(0,5đ)
PTHH: CO
2
+ Ca(OH)
2
CaCO
3
+ H
2
O (0,25đ)
Câu 3: (2 điểm) mỗi PTHH viết đúng đợc (0,5đ)
a- 2Al + 6HCl 2AlCl
3
+ 3 H
2
(phản ứng thế)
b- 2Mg + O
2
t
o
2MgO (phản ứng hoá hợp, oxi hoá - khử)
c- Fe
2
O
3
+ 3H
2
t
o
2Fe + 3H
2
O (phản ứng thế, oxi hoá - khử)
d- 2Fe
(OH)
3
t
o
Fe
2
O
3
+ 3H
2
O (phản ứng phân huỷ)
Câu 4 ( 2 điểm): Mỗi ý đúng đợc 1đ
a) Nồng độ % của dd KCl là:
mKCl x 100 30 x 100
C%
KCl
= = = 5 %
mKCl 600
b) Nồng độ mol của dd CuCl
2
là: Đổi 400 ml = 0,4 l
n CuCl
2
0,5
CMCuCl
2
= = = 1,25 (M)
VddCuCl
2
0,4
Câu 5 ( 3 điểm)
a) Tính đợc số mol Fe = 2,24 : 56 = 0, 4 (mol) (0,25đ)
số mol H
2
SO
4
= 29,4 : 98 = 0,3 mol (0,25đ)
PTHH: Fe + H
2
SO
4
FeSO
4
+ H
2
(0,25đ)
b) Theo PT: nFe
= n H
2
SO
4
= 0,3 mol nên Fe d 0,1 mol (0,5đ)
Khối lợng Fe d là: m
Fe d
= 0,1 x 56 = 5,6 g (0,25đ)
Thể tích khí H
2
thu đợc là: (0,5đ)
n H
2
= nH
2
SO
4
= 0,3 mol
VH
2
= nH
2
x 22,4 = 0,3 x 22,4 = 6,72 (l)