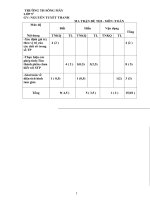
ma trận đề thi giỏi hóa lớp 9
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (294.7 KB, 10 trang )
SỞ GIÁO DỤC & ĐÀO TẠO THANH HĨA
PHỊNG GD&ĐT TP THANH HĨA
KÌ THI CHỌN HỌC SINH GIỎI KHỐI 9
Mơn thi: HĨA HỌC
Thời gian: 150 phút(không kể phát đe)à
MA TRẬN ĐỀ THI HỌC SINH GIỎI HĨA HỌC 9
Người lập:
Đơn vị:
Mức độ kiến thức
Cộng
Tên chủ đề
Nhận biết
Chủ đề 1
Phương trình hóa
học
Số câu. Số điểm.
Tỉ lệ%
Thơng
hiểu
Hồn thành
các phản
ứng
1 câu.
2điểm
Chủ đề 2
Hồn thành chuỗi
phản ứng.
Số câu. Số điểm.
Tỉ lệ%
Hồn thành
chuỗi phản
ứng
1 câu.
2điểm
Xác định
chất trong
phản ứng
1 câu.
1điểm
Chủ đề 3
Vận dụng các kiến
thức hóa học cơ
bản
Số câu. Số điểm.
Định luật
bảo tồn
khối lượng
Xác định
chất
1 câu.
1 câu.
Vận dụng
thấp
Vận dụng
cao
1 câu.
2điểm
=10%
2 câu.
3điểm
=15%
2 câu.
Tỉ lệ%
1 điểm
2điểm
3điểm
=15%
Chủ đề 4
Điều chế
Số câu. Số điểm.
Tỉ lệ%
Điều chế
các chất
1câu.
2 điểm
Chủ đề 5
Bài toán tổng hợp
Số câu. Số điểm.
Tỉ lệ%
Giải và tính
toán
1 câu
2 điểm
Chủ đề 6
Các hiện tượng
hóa học
Số câu. Số điểm.
Tỉ lệ%
1 câu.
2điểm
=10%
Nêu hiện
tượng
1 câu.
1 điểm
1 câu.
1điểm
=5%
Chủ đề 7
Mối quan hệ giữa
các chất
Xác định
mối quan hệ
giữa các
chất
1 câu. 1điểm 1 câu.
1điểm
=5%
Số câu. Số điểm.
Tỉ lệ%
Chủ đề 8
Bài tập tính toán
Số câu. Số điểm.
Tỉ lệ%
1 câu .
2 điểm
Chủ đề 9
Bài toán tinh thể
Số câu. Số điểm.
Tỉ lệ%
1 câu.
2điểm
=10%
1 câu. 2điểm 1 câu.
2điểm
=10%
Chủ đề 10
Bài toán vận dụng
tỉ khối
Số câu. Số điểm.
Tỉ lệ%
Tổng
1 câu.
2điểm
=10%
2 câu
3 điểm
4 câu
6 điểm
3 câu
6 điểm
1 câu.2 điểm 1câu.
2điểm
=10%
3 câu
12 câu
5 điểm
20 điểm
=15%
=30%
=30%
=25%
=100%
ĐEÀ BÀI
Bài 1: (2 điểm)
Hoàn thành các phản ứng sau
a. FeSO4 + Cl2
FeCl3 + .....
b. H2O + ..... + SO2
HBr + .....
c. Fe3O4 + HCl
FeCl2 + ...... + H2O
d. Fe + H2SO4 đặc/nóng
Fe2(SO4)3 + H2S + .....
:
Bài 2: ( 2 điểm) Viết các PTHH hoàn thành dãy biến hóa sau:
K → K2O → KOH →K2CO3 →KCl → KOH →K2SO4 → KNO3 → KNO2
Bài 3: (2 điểm)
Nung nóng Cu trong không khí, sau một thời gian được chất rắn A. Hòa tan chất rắn
A trong axit sunfuric đặc nóng(vừa đủ) được dung dịch B và khí D có mùi xốc. Cho Na
vào dung dịch B thu được khí G và kết tủa M; cho khí D tác dụng với dung dịch KOH thu
được dung dịch E, E vừa tác dụng với BaCl2 vừa tác dụng với dung dịch NaOH. Xác định
thành phần A, B, D, G, M, E. Viết các phương trình hóa học xảy ra.
Bài 4: (1 điểm) Sục khí clo vào nước được dung dịch A. Lúc đầu dung dịch A làm mất
màu giấy quỳ tím, để lâu dung dịch A làm giấy quỳ tím hóa đỏ, giải thích. Hiện tượng này
là hiện tượng vật lý hay hiện tượng hóa học.
Bài 5: (2 điểm)
Có 6 lọ dung dịch được đánh số ngẫu nhiên từ 1 đến 6. Mỗi dung dịch chứa một chất tan
gồm BaCl2, H2SO4, NaOH, MgCl2, Na2CO3, HCl. Người ta tiến hành các thí nghiệm và thu
được kết quả sau:
Thí nghiệm 1: Dung dịch 2 cho kết tủa khi tác dụng với các dung dịch 3 và 4.
Thí nghiệm 2: Dung dịch 6 cho kết tủa khi tác dụng với các dung dịch 1 và 4.
Thí nghiệm3: Dung dịch 4 cho khí bay lên khi tác dụng với các dung dịch 3 và 5.
Hãy xác định số thứ tự của các lọ dung dịch trên và viết các phương trình hóa học đã xảy
ra?
Bài 6: ( 1 điểm) Cho dung dịch A chứa a mol NaOH, dung dịch B chứa b mol AlCl 3. Hãy
xác định mối quan hệ giữa a và b để sau khi pha trộn hai dung dịch trên ta luôn thu được
kết tủa?
Bài 7: (4 điểm)
Hòa tan hết 4,68 gam hỗn hợp hai muối ACO3, BCO3 bằng dung dịch H2SO4 loãng.
Sau phản ứng thu được dung dịch X và 1,12 lít khí CO2 (ở đktc).
1)Tính tổng khối lượng các muối trong dung dịch X.
2)Tìm các kim loại A, B và tính thành phần % khối lượng của mỗi muối trong hỗn
hợp ban đầu. Biết tỉ lệ số mol nACO : nBCO = 2 : 3 ; Tỉ lệ khối lượng mol MA : MB = 3 : 5
3)Cho tồn bộ lượng khí CO2 thu được ở trên hấp thụ vào 200 ml dung dịch Ba(OH)2.
Tính nồng độ mol của dung dịch Ba(OH)2 để thu được 1,97 gam kết tủa.
Bài 8: ( 2 điểm)
Cho hỗn hợp chất rắn gồm FeS2, CuS, Na2O. Chỉ được dùng thêm nước và các điều kiện
cần thiết (nhiệt độ, xúc tác,...). Hãy trình bày phương pháp và viết các phương trình hóa
học xảy ra để điều chế FeSO4, Cu(OH)2.
Câu 9: ( 2 điểm)
Làm lạnh 1877 gam dung dòch bão hòa CuSO4 từ 850C xuống 250C. Hỏi có bao
nhiêu gam CuSO4.5H2O tách ra. Biết độ tan CuSO4 850C là 87,7 gam và ở 250C là 40
gam.
Bài 10: (2 điểm)
Hồ tan hồn tồn 12,42 gam Al bằng dung dịch HNO3 lỗng (dư), thu được dung dịch X
và 1,344 lít (ở đktc) hỗn hợp khí Y gồm hai khí là N2O và N2. Tỉ khối của hỗn hợp khí Y
so với khí H2 là 18. Cơ cạn dung dịch X, thu được m gam chất rắn khan. Tính m.
3
3
----------------------------Hết----------------------------------
ĐÁP ÁN VÀ THANG ĐIỂM KỲ THI CHỌN HỌC SINH GIỎI LỚP 9
BÀI
ĐÁP ÁN
Bài 1:
a. 3FeSO4 + 3/2Cl2 à Fe2(SO4)3 + FeCl3
b. Br2 + 2H2O + SO2 à 2HCl + H2SO4
c. Fe3O4 + 8HCl à FeCl2 + 2FeCl3 + 4H2O
d. 8Fe + 15H2SO4 đặc/nóng à 4Fe2(SO4)3 + 3H2S + 4H2O
Bài 2
4K + O2 -> 2K2O
K2O + H2O -> 2KOH
2KOH + CO2 -> K2CO3 + H2O
K2CO3 + 2HCl -> 2KCl + H2O + CO2
2KCl + 2H2O —>2KOH + H2 + Cl2
đfmn
2KOH + H2SO4 -> K2SO4 + 2H2O
K2SO4 + Ba(NO3)2 -> BaSO4 + 2KNO3
t˚
KNO3 —→ KNO2 + ½ O2
THANG
ĐIỂM
2 điểm
0,5
0,5
0,5
0,5
2 điểm
0,25
0,25
0,25
0,25
0,25
0,25
0,25
0,25
2 điểm
Bài 3:
t
2Cu(r) + O2 (k)
→ 2CuO(r)
0
Do A tác dụng với H2SO4 đđ thu được khí D: Chứng tỏ chất rắn A
có Cu dư.
Cudư (r)+ 2H2SO4đđ → CuSO4 (dd)+ SO2 (k) + 2H2O(l)
CuO(r) + H2SO4đđ → CuSO4(dd) + + H2O(l)
2Na(r) + 2H2O(l) → 2NaOH(dd) + H2(k)
CuSO4(dd) + 2NaOH (dd) → Cu(OH)2(r) + Na2SO4(dd)
Do E vừa tác dụng với dung dịch BaCl2, tác dụng với dung dịch
NaOH; Chứng tỏ dung dịch E có chứa 2 muối.
SO2(kk) + KOH(dd) → KHSO3(dd)
SO2(k)+ 2KOH(dd) → K2SO3(dd)+ H2O(l)
(hoặc:KHSO3(dd) + KOHdư(dd) → K2SO3 (dd)+ H2O(l))
2KHSO3(dd) +2NaOH(dd) → K2SO3(dd)+ Na2SO3(dd) + 2H2O(l)
K2SO3(dd) + BaCl2 (dd) → BaSO3(r) + 2KCl(dd)
Bài 4
Bài 5
0,25
0,25
0,25
0,25
0,25
0,25
0,25
0,25
1 điểm
0,25
- Clo tan 1 phần trong nước và phản ứng một phần với nước.
- ban đầu làm mất màu quỳ tím là do:
Cl2 + H2O HClO + HCl
0,25
=> HClO có khả năng tẩy trắng ( tính oxi hóa mạnh).
=> do không cho Cl2 vào thêm nên HClO hết chỉ còn HCl làm quỳ 0,25
tím hóa đỏ.
- Hiện tượng vật lý: clo tan vào nước.
0,25
- Hiện tượng hóa học: clo tác dụng với nước
2 điểm
- Vì dung dịch (4) cho khí khi tác dụng với dung dịch (3) và (5)
0,25
àDung dịch (4) là Na2CO3; (3), (5) là hai dung dịch chứa H2SO4 0,25
và HCl.
- Vì (2) cho kết tủa khi tác dụng với (3) và (4). Vậy (2) phải là
0,5
dung dịch BaCl2 , (3) là dung dịch H2SO4 , (5) là dung dịch HCl.
0,25
- Vì (6) cho kết tủa với (1) và (4) nên (6) là MgCl2, (1) là NaOH.
Vậy: (1) là NaOH, (2) là BaCl2, (3) H2SO4,(4) là Na2CO3 , (5) là
0,25
HCl, (6) là MgCl2
+ Thí nghiệm 1: BaCl2 + H2SO4
BaSO4 + 2HCl
0,25
BaCl2 + Na2CO3
BaCO3 + 2NaCl
+ Thí nghiệm 2; MgCl2 +2 NaOH
Mg(OH)2 + 2NaCl
MgCl2 + Na2CO3
MgCO3 + 2NaCl
0,25
+ Thí nghiệm 3: Na2CO3 + H2SO4
Na2SO4 + H2O+ CO2
Na2CO3 + 2HCl
2NaCl + H2O + CO2
1 điểm
0,5
Bài 6
→
3NaOH
+ AlCl3
Al(OH)3
+ 3NaCl
3b
b
b
→
NaOH + Al(OH)3
NaAlO2
+ 2H2O
a- 3b
b
để có kết tủa thì: 3b < a và a- 3b < b ⇒ 3b < a < 4b
0,25
0,25
Bài 7
1)
2)
4 điểm
-PTHH ACO3(r) + H2SO4(dd) à ASO4(dd) + CO2(k) + H2O (1)
BCO3(r) + H2SO4(dd) à BSO4(dd) + CO2(k) + H2O (2)
à Muối thu được trong dung dòch X là: ASO4, BSO4;
nCO2 = 0,05 mol
Tổng khối lượng muối tạo thành trong dung dòch X là:
Theo (1) và (2): nH2SO4 = nCO2 = nH2O = 0,05(mol)
Theo ĐLBTKL: mmuối = (4,68 + 0,05 . 98)- (0,05 . 44 + 0,05 .
18) = 6,48 gam
* Tìm các kim loại A, B và tính % khối lượng của mỗi muối ban
đầu:
Đặt: n ACO = 2x (mol) à n BCO = 3x (mol) (vì n ACO :n BCO = 2 : 3)
MA = 3a (gam) à MB = 5a (gam) (vì MA : MB = 3 : 5)
Theo (1), (2): n CO = n ACO + n BCO = 5x = 0,05 (mol) à x =
0,01(mol) à n ACO = 0,02 (mol) à n BCO = 0,03 (mol)
à0,02(3a+60) + 0,03(5a+60) = 4,68 (g) à a =8
MA = 24 gam, MB = 40 gamà A là Mg, B là Ca.
3
3
2
3
3
3
3
3
0, 02.84
3)
0,25
0,25
0,25
0,25
3
%m MgCO = 46,8 .100% = 35,9% ; %m CaCO =(100 – 35,9)%=64,1%
3
0,25
0,25
3
0,25
0,25
0,25
0,25
* Tính nồng độ mol của dung dòch Ba(OH)2
Theo bài ra: hấp thụ hết lượng khí CO2 ở trên vào dung dòch
Ba(OH)2 được kết tủa à kết tủa là BaCO3 à n BaCO =
3
1,97
= 0, 01(mol )
197
Giả sử phản ứng chỉ tạo muối trung hòa:
0,25
0,25
CO2 + Ba(OH)2 à BaCO3(r) + H2O
(4)
Theo (4) n CO = n BaCO nhưng thực tế n CO > n BaCO à điều g/s sai.
à Phản ứng phải tạo 2 muối:
CO2 + Ba(OH)2 à BaCO3(r) + H2O
(4)
2CO2 + Ba(OH)2 à Ba(HCO3)2
(5)
3
2
3
2
0, 03
Tính được n Ba ( OH ) = 0,03 (mol) à C M ( ddBa (OH ) = 0, 2 = 0,15( M )
2
2
Bài 8
0,25
0,25
0,25
0,25
2 điểm
Hòa tan hỗn hợp vào nước lọc, tách lấy chất rắn FeS2, CuS và
dung dịch NaOH:
→ 2NaOH
Na2O + H2O
- Điện phân nước thu được H2 và O2:
đp
2H2O →
2H2 ↑ + O2 ↑
(1)
- Nung hỗn hợp FeS2, CuS trong O2 (ở 1) dư đến phản ứng hồn
tồn được hỗn hợp rắn Fe2O3, CuO và khí SO2:
t
4FeS2 + 11O2 →
2Fe2O3 + 8SO2 ↑
t
CuS + O2 →
CuO + SO2 ↑
- Tách lấy khí SO2 cho tác dụng với O2 (ở 1) dư có xúc tác, sau đó
đem hấp thụ vào nước được H2SO4:
, xt
2SO2 + O2 t
→ 2SO3
→ H2SO4
SO3 + H2O
(2)
- Lấy hỗn hợp rắn Fe2O3, CuO đem khử hồn tồn bằng H2 (ở 1)
dư ở nhiệt độ cao được hỗn hợp Fe, Cu. Hòa tan hỗn hợp kim loại
vào dung dịch H2SO4 lỗng (ở 2), được dung dịch FeSO4. Phần
khơng tan Cu tách riêng.
t
Fe2O3 + 3H2 →
2Fe + 3H2O
t
CuO + H2 → Cu + H2O
→ FeSO4 + H2
Fe + H2SO4
- Cho Cu tác dụng với O2 (ở 1) tạo ra CuO sau đó hòa tan vào
dung dịch H2SO4 (ở 2) rồi cho tiếp dung dịch NaOH vào, lọc tách
thu được kết tủa Cu(OH)2.
t
2Cu + O2 →
2CuO
→ CuSO4 + H2O
CuO + H2SO4
→ Cu(OH)2 ↓ + Na2SO4
CuSO4 + 2NaOH
0,25
0,25
0,25
o
o
0,25
o
0,5
o
o
0,5
o
Bài 9
2 điểm
* ở 850C, T = 87,7 gam, suy ra:
Cứ (100 + 87,7)gam ddbh có 87,7gam CuSO4 và 100gam H2O
Vậy 1877 gam ddbh à có 877 gam CuSO4 và 1000 gam H2O
* Đặt a là số mol CuSO4.5H2O tách ra, trong đó có:
160.a g CuSO4 tách ra và 5.a.18 g H2O tách ra
* Trong dung dòch bão hòa ở 250C (sau khi CuSO4.5H2O tách ra,
có:
mt = m CuSO = (877-160a)g
mdm= mH2O = (1000-90a)g
*Dung dòch này có T = 40 gam, ta có mối liên hệ:
CuSO4
4
0,25
0,25
0,25
0,25
0,25
CuSO4
mt
(877 − 160a )
0,25
T = m .100 40 = (1000 − 90a) .100 (1)
dm
Giải (1) ta được a = 3,846 mol
Vậy khối lượng CuSO4.5H2O tách ra bằng:
250 . 3,846 = 961,5 g
0,25
0,25
2 điểm
Bài 10
n Al =
12, 42
= 0, 46 mol
27
Gọi a, b lần lượt là số mol của N2O và N2 có trong 1,344 lít (đktc)
hỗn hợp Y, ta có hệ:
1,344
= 0,06
22,4
44a + 28b
= 18.2 = 36
a+b
0,5
a+b =
→ x = 0,03 mol; y = 0,03 mol
8Al + 30HNO3
→ 8Al(NO3)3 + 3N2O + 15H2O
0,08
0,08
0,03
10Al + 36HNO3
→ 10Al(NO3)3 + 3N2 + 18H2O
(1)
(2)
0,1
0,1
0,03
Giả sử sp khử chỉ có khí N2O và N2, ta có: nAl = 0,08 + 0,1 = 0,18
mol < 0,46 mol: Vơ lí
→ Sản phẩm khử còn có NH4NO3.
8Al
+
30HNO3
→ 8Al(NO3)3 + 3NH4NO3 + 5H2O
(0,46 – 0,18)
0,105
Vậy: m = 213.0,46 + 80.0,105 = 106,38(g)
Chú ý: Nếu học sinh làm cách khác mà đúng thì giáo viên vẫn cho điểm.
---------------------Hết-----------------------
0,5
0,5
0,5