DE CUONG HOC KI II l8
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (95.51 KB, 5 trang )
ĐỀ CƯƠNG ÔN TẬP HỌC KÌ II - MÔN HOÁ 8
Năm học 2018-2019
I. LÍ THUYẾT :
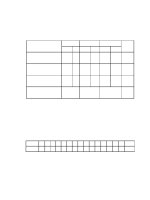
1. So sánh hiđro và oxi
Tính
chất
hoá
học
Điều
chế
Oxi
1. Tác dụng với phi kim :
a. Td với lưu huỳnh -> lưu huỳnh đioxit SO2
S + O2 to SO2
b. Td với photpho -> điphotphopentaoxit P2O5
4P + 5 O2 to 2 P2O5
2. Td với kim loại sắt
3Fe + 2O2 to Fe3O4
3. Td với hợp chất
CH4 + 2 O2 to CO2 + 2 H2O
Hiđro
1. Td với oxi -> H2O
2H2 + O2 to 2H2O
2. Td với đồng (II) oxit -> kim loại Cu + nước
H2 + CuO to Cu + H2O
1. Trong phòng thí nghiệm :
Phân huỷ kalipemanganat hoặc kaliclorat
2KMnO4 to K2MnO4 + MnO2 + O2
2KClO3 to 2KCl + 3O2
2. Trong công nghiệp :
- Hoá lỏng không khí ở nhiệt độ thấp và áp suất
cao .
- Điện phân nước
1. Trong phòng thí nghiệm :
Cho một kim loại (Fe , Al, Zn ) tác dụng với một
axit HCl, H2SO4 loãng
Zn + 2 HCl -> ZnCl2 + H2
Fe + H2SO4 -> Fe SO4 + H2
* Lưu ý Fe tác dụng với axit chỉ thể hiện hoá
trị II
2. Trong công nghiệp :
Điện phân nước : 2H2O to 2H2 + O2
- Thu qua nước
- Đẩy không khí
Thu - Thu qua nước
khí
- Đẩy không khí
* Một số khái niệm khác :
Sự cháy là sự oxi hóa có tỏa nhiệt và phát sáng.
Sự oxi hóa chậm là sự oxi hóa có tỏa nhiệt nhưng không phát sáng.
2. Tính chất hóa học của nước H2O
* Tác dụng với kim loại (Li , Na, K, Ca, Ba) -> bazơ + H2
2Na + 2H2O -> 2NaOH + H2
* Tác dụng với oxit bazơ ( Li2O, Na2O , K2O, BaO, CaO) -> bazơ
CaO + H2O -> Ca(OH) 2
-> dung dịch bazơ làm quỳ tím hoá xanh
* Tác dụng với oxit axit (CO2 , SO2, SO3, P2O5 , N2O5 ) -> axit
SO2 + H2O -> H2SO3
-> dung dịch axit làm quỳ tím hoá đỏ
3. Các loại phản ứng
Phản ứng hoá hợp
- là PƯHH trong đó chỉ có một
chất mới ( sản phẩm ) được tạo
thành từ hai hay nhiều chất ban
đầu
- VD :
S + O2 to SO2
Phản ứng phân huỷ
Phản ứng thế
- là PƯHH trong đó chỉ có một chất - là PƯHH giữa đơn chất và hợp
sinh ra hai hay nhiều chất mới
chất trong đó nguyên tử của đơn
chất thay thế nguyên tử của một
nguyên tố trong hợp chất .
- VD :
- VD :
2KClO3 to 2KCl+3O2
Zn +2 HCl-> ZnCl2 + H2
4. Oxit – Axit – Bazơ – Muối :
Oxit
Định
là hợp chất gồm hai
nghĩa nguyên tố trong đó có
một nguyên tố là oxi
VD: CO2, ZnO…
Công
thức
hoá
học
Phân
loại
Gọi
tên
MxOy
Trong đó :A : là kim
loại hoặc phi kim.
x là hoá trị của O
y là hoá trị của A
* Lưu ý x, y là các số
đã được tối giản
Có hai loại :
- Oxit axit: thường là
oxit của phi kim tương
ứng với một axít.
CO2 - H2CO3
SO3 – H2SO4
SO2 – H2SO3
P2O5 – H3PO4
N2O5 – HNO3
- Oxit bazơ: thường là
oxit của kim loại
tương ứng với một
bazơ
CaO – Ca(OH)2
Na2O – NaOH
- Tên oxit = tên
nguyên tố + oxit
VD : K2O : kali oxit
CaO : canxi oxit
- Nếu kim loại có
nhiều hóa trị :
+ Tên oxit bazơ: Tên
kim loại ( kèm theo
hóa trị) + oxit
VD : FeO : sắt ( II)
oxit
Fe2O3 : sắt ( III) oxit
- Nếu Phi kim có
nhiều hóa trị :
Tên oxit : tên phi
kim( có tiền tố chỉ số
nguyên tử phi kim ) +
oxit (có tiền tố chỉ
nguyên tử oxi )
SO3 : Lưu huỳnh
trioxit
CO2 : Cacbon đioxit
Axit
Phân tử axit gồm một
hay nhiều nguyên tử
hiđrô liên kết với gốc
axit, các nguyên tử
hiđro này có thể thay
thế bằng nguyên tử kim
loại
VD: HCl, H2SO4
HxA
Trong đó :
A : là gốc axit.
x là hoá trị của gốc
axit
Bazơ
Phân tử bazơ gồm một
nguyên tử kim loại liên
kết với một hay nhiều
nhóm hiđroxit (-OH)
Muối
Phân tử muối gồm một
hay nhiều nguyên tử
kim loại liên kết với
một hay nhiều gốc axit
-VD: NaOH, Zn(OH)2
VD: NaCl, MgSO4
M(OH)y
Trong đó :
M : là kim loại .
y là hoá trị của kim loại
MxAy
Trong đó :
M : là kim loại .
A là gốc axit
x là hoá trị của B
y là hoá trị của A
Có hai loại :
- Axit có oxi :H2SO4 ,
HNO3, H3PO4...
- Axit không có oxi :
HCl, H2S ...
Có hai loại :
- Bazơ tan trong nước
( kiềm): NaOH, KOH,
Ba(OH)2, Ca(OH)2,...
- Bazơ không tan trong
nước:Cu(OH)2,Fe(OH)2…
- Axit không có oxi :
Tên axit : axit + tên phi
kim + hiđric
VD : HCl : Axit
clohidric
HBr: Axit bromhiđric.
- Axit có oxi :
+ Axit có nhiều
nguyên tử oxi :
Tên axit : axit + tên phi
kim + ic
VD : H2SO4 : axit
sunfuric
HNO3 : axit nitric
+ Axit có ít nguyên tử
oxi :
Tên axit : axit + tên phi
kim + ơ
H2SO3 : axit sunfurơ
Có hai loại :
-Muối trung hoà là
muối mà trong gốc axit
không có nguyên tử
hiđro có thể thay thế
bằng nguyên tử kim
loại: Na2SO4, KCl,
MgSO4 …
- Muối axít là: muối
mà trong đó gốc axít
còn nguyên tử hiđrô
chưa được thay thế
bằng nguyên tử kim
loại:NaHCO3,
Ca(HCO3)2…
Tên bazơ = tên kim loại
Tên muối : tên kim loại
(kèm theo hóa trị nếu kim ( kèm hóa trị nếu có
nhiều hóa trị ) + tên gốc
loại có nhiều hoá trị) +
axit
hiđroxit
CD: NaCl: Natri clorua
Ví dụ :
MgSO4: Magie sunfat
NaOH : Natrihidroxxit
Cu(NO3)2: Đồng(II)
Fe (OH)2 sắt (II)
Nitrat
hiđroxit
Fe(OH 3 : sắt (III) hiđroxit ZnCO3: k ẽm cacbonat
K3PO4: kaliphotphat
5. Dung dịch – Nồng độ dung dịch :
- Dung môi là chất có khả năng hoà tan chất khác để tạo thành dung dịch .
- Chất tan là chất bị hoà tan trong dung môi .
- Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan .
- Nồng độ phần trăm là số gam chất tan có trong 100 gam dung dịch .
+ Công thức tính nồng độ phần trăm :
Trong đó :
m ct
100%
C
%
=
- Khối lượng chất tan là : mct (gam)
m dd
- Khối lượng dd là mdd (gam)
- Nồng độ % là C %
- Nồng độ mol ( kí hiệu CM của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch .
Trong đó : CM : là nồng độ mol (M hoặc mol/l)
n
n : Là số mol chất tan .
CM =
V
V : là thể tích dung dịch lít)
II. BÀI TẬP:
Bài 1: Oxit là gì? Trong những chất kể sau đây, chất nào là oxit : CO2, CaO, CaCO3, H2O, H2O, SO3
Bài 2: Có các oxit sau : CO2, N2O5, MgO, Na2O, SO2, CuO, CaO. Gọi tên và hãy cho biết đâu là oxit axit, đâu
là oxit bazơ?
Bài 3: Để điều chế hidro trong phòng thí nghiệm, người ta dùng các kim loại kẽm, sắt, nhôm cho tác dụng với
ait clohidric hoặc axit sunfuric loãng theo các sơ đồ phản ứng sau:
- Zn + HCl - - -> ZnCl2 + H2
- Fe + HCl - - -> FeCl2 + H2
- Al + HCl - - -> AlCl3 + H2
- Zn + H2SO4 - - -> ZnSO4 + H2
- Fe + H2SO4 - - -> FeSO4 + H2
- Al + H2SO4 - - -> Al2(SO4)3 + H2
Hãy lập PTHH của các phản ứng trên, và cho biết chúng thuộc loại phản ứng nào?
Bài 4: Cho các sơ đồ phản ứng sau :
Fe + O2 - - - > Fe3O4
Al + HCl - - -> AlCl3 + H2
H2O - - -> H2 + O2
Al + Cl2 - - - > AlCl3
Al + Fe2O3 - - - > Al2O3 + Fe
- P + O2 - - - > P2O5
- Mg + O2 - - - > MgO
CaCO3 - - - > CaO + CO2
- Fe + CuCl2 - - - > FeCl2 + Cu
a. Lập PTHH của các phản ứng trên
b. Cho biết các phản ứng trên thuộc loại nào
Bài 5: có ba lọ riêng biệt đựng các chất khí sau : không khí, oxi, hidro. Bằng thí nghiệm nào có thể biết được
chất khí trong mỗi lọ?
Bài 9: Cho các chất có CTHH sau: K2O, HCl, ZnSO4, Fe(OH)2, Fe(OH)3, H3PO4, N2O3, CO2, H2O, AlCl3,
Fe2(SO4)3, FeSO4, Na3PO4, Cu(NO3)2 , NaOH, H2SO4, CuSO4, AgNO3, CaO, CO2, Na2O, N2O5, BaO, P2O5,
Fe2O3, Cu(OH)2, SO3, HNO3, KOH, SO2, CuO, NaCl, H3PO4. Gọi tên và phân loại các chất trên?
Bài 6: Lập PTHH của các phản ứng sau :
- Cacbon đioxit + nước - - - > axit cacbonic (H2CO3)
- Lưu huỳnh đioxit + nước - - -> axit sunfurơ (H2SO3)
- Kẽm + axit clohidric - - - > Kẽm clorua + H2
- diphotpho pentaoxit + nước - - - > axit photphoric (H3PO4)
- Phì (II) oxit + hidro - - - > Chì + H2O
Bài 7: Viết PTHH của các chất sau với nước : Natri, lưu huỳnh trioxit, kali, cacbon đioxit, Kali oxit, Natrioxit,
Barioxit, diphotphopentaoxit. Các phản ứng trên thuộc loại phản ứng nào? Tại sao?
Bài 8: Cho các chất có CTHH sau : Na2O, CaO, Fe2O3, SO3, P2O5, Na.
a. Viết PTHH của mỗi chất đó với nước (nếu có)
b. Cho biết mỗi phản ứng đó thuộc loại nào?
c. Gọi tên mỗi chất tạo thành trong phản ứng
Bài 9: Photpho cháy theo sơ đồ phản ứng hoá học sau : P + O2 - - - > P2O5 ( photpho pentaoxit)
a. Tính khối lượng photpho pentaoxit tạo thành khi đốt cháy 2 mol nguyên tử P
b. Tính khối lượng photpho pentaoxit tạo thành khi đốt cháy 15,5g photpho.
c. Tính khối lượng khí oxi đã tham gia phản ứng để tạo ra 28,4 g photpho pentaoxit
Bài 10: Dùng khí hiđro để khử 48g đồng (II) oxit thu được đồng và nước
a. Tính số gam đồng điều chế được
b. Tính thể tích khí hidro (đktc) cần dùng cho phản ứng trên?
c. Cần dùng bao nhiêu gam kẽm oxit để tác dụng hết lượng khí hiđro trên
Bài 11: Người ta cho sắt tác dụng với 200 ml dung dịch axit clohidric để điều chế hidro. Muốn điều chế 5,6 lít
khí hidro (đktc) thì phải dùng:
a. Bao nhiêu gam sắt?
b. Tính nồng độ mol axit clohidric cần dùng?
BT 12: Khử hoàn toàn sắt (III) oxit bằng khí hidro, sau phản ứng thu được 11,2 gam sắt.
a. Viết PTHH của phản ứng
b. Tính thể tích khí hidro cần dùng (đktc).
c. Tính khối lượng sắt (III) oxit.
d. Cần dùng bao nhiêu gam axit clohiđric để tác dụng hết lượng sắt trên?
Bài 13 : Tính số gam muối ăn và số gam nước cần phải lấy đề pha chế thành :
a. 40 gam dd nồng độ 6%
b. 20 gam dd nồng độ 0,5%
Bài 14: Tính nồng độ mol/lít trong mỗi trường hợp sau:
- Hoà tan 4,48 lít khí HCl (đktc) vào 500ml nước ( thể tích dung dịch không đổi)
- Hoà tan 20 gam NaOH vào nước thu được 1,5 lít dung dịch.
- Hoà tan 3,36 lít khí NH3 (đktc) vào nước để được 200 ml dung dịch.
Bài 15 : Tính nồng độ % của các dung dịch thu được trong các trường hợp sau:
a. Hoà tan 40 gam đường vào 210 gam H2O
c. Hoà tan 50 gam NaOH vào nước thu được 200 gam dung dịch.
Bài 16: Đốt cháy hoàn toàn 4,8 gam kim loại R có hóa trị II trong khí oxi dư thu được 8 gam oxit. Xác định
kim loại R.
Bài 17: Đốt cháy hoàn toàn 2,7 gam kim loại X có hóa trị III trong khí oxi dư thu được 5,1 gam oxit. Xác định
kim loại X.