Mối quan hệ giữa các hợp chất vô cơ (Có bài tập vận dụng)
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (339.78 KB, 5 trang )
<span class='text_page_counter'>(1)</span><div class='page_container' data-page=1>
Truy cập vào: để học Tốn – Lý – Hóa – Sinh – Văn - Anh tốt nhất! 1
<b>MỐI QUAN HỆ GIỮA CÁC HỢP CHẤT VÔ CƠ </b>
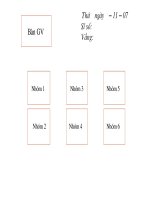
I.Mối quan hệ giữa các hợp chất vô cơ
Lưu ý điều kiện để các phản ứng xảy ra:
(6)(7)(8): Sản phẩm phải có 1 kết tủa hoặc bay hơi.
(8): Axit mới sinh ra yếu hơn axit tham gia phản ứng
II.Những phản ứng hóa học minh họa
1) MgO + H2SO4 → MgSO4 + H2O
2) SO2 + 2NaOH → Na2SO3 + H2O
SO2 + 2NaOH → NaHSO3
3) Na2O + H2O → 2NaOH
4) 2Fe(OH)3 𝑡
0
→ Fe2O3 + 3H2O
5) P2O5 + 3H2O → H3PO4
6) Cu(OH)2 + 2HCl → CuCl2 + 2 H2O
7) 2KOH + CuSO4 → K2SO4 + Cu(OH)2↓
<b> KOH + NH4Cl → KCl + NH3↑ + H2O </b>
8) BaCl2 + H2SO4 → BaSO4↓ + 2HCl
<b> CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O </b>
9) H2SO4(loãng) + Fe → FeSO4 + H2↑
</div>
<span class='text_page_counter'>(2)</span><div class='page_container' data-page=2>
Truy cập vào: để học Toán – Lý – Hóa – Sinh – Văn - Anh tốt nhất! 2
III. Bài tập vận dụng
Bài 1: Bằng phương pháp hóa học trình bày cách nhận biết 5 lọ hóa chất bị mất nhãn
mà chỉ dùng quỳ tím : KOH , HCl , H2SO4 , Ba(OH)2 , KCl?
Bài 2: Có 4 oxit riêng biệt: Na2O, Fe2O3, MgO và Al2O3. Làm thế nào để có thể nhận
biết được mỗi oxit bằng phương pháp hóa học với điều kiện chỉ dùng thêm 2 chất là
H2O và HCl?
Bài 3: Hồn thành các phương trình phản ứng sau:
(1) …. + 3H2O 2H3PO4
(2) …. + H2O 2NaOH
(3) …. + 2KOH Cu(OH)2 + 2KCl
(4) 6HCl + …. 2AlCl3 + 3H2O
(5) MgO + …. MgSO4 + H2O
(6) …. + 2NaOH Na2SO4 + H2O
(7) 2Fe(OH)3 𝑡
𝑜
→ …. + 3H2O
(8) KOH + …. KNO3 + H2O
(9) AgNO3 + …. AgCl + HNO3
Bài 4: Cho các chất sau: CuSO4; CuO; Cu(OH)2; Cu; CuCl2
Hãy sắp xếp các chất trên thành một dãy chuyển hóa và viết các phương trình phản
ứng.
Bài 5: VIết các phương trình biểu diễn chuyển hóa sau:
FeS2→SO2→S→H2S→SO2→SO3→SO2→H2SO4→BaSO4→SO2→NaHSO3
IV.Đáp án
Bài 1:
Bước 1: Lần lượt lấy mỗi lọ 1 giọt dung dịch nhỏ vào giấy quỳ tím.
- Nếu dung dịch làm quỳ tím chuyển thành màu xanh là: Ba(OH)2; KOH (Nhóm 1)
- Nếu làm quỳ tím chuyển thành màu đỏ là: HCl , H2SO4 (Nhóm 2)
- Không chuyển màu là : KCl (Nhóm 3)
Bước 2: Lấy dung dịch ở nhóm 1 lần lượt cho vào từng ống nghiệm ở nhóm 2, dung
dịch nào tạo kết tủa trắng:
</div>
<span class='text_page_counter'>(3)</span><div class='page_container' data-page=3>
Truy cập vào: để học Tốn – Lý – Hóa – Sinh – Văn - Anh tốt nhất! 3
Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
Bài 2:
Cho từng chất tác dụng với H2O:
- Oxit tan là Na2O:
Na2O + H2O -> 2NaOH
- Oxit không tan là MgO, Al2O3, Fe2O3
*Cho các oxit không tan tác dụng với dd HCl để tạo các dung dịch:
(1) MgO + 2HCl -> MgCl2 + H2
(2) Al2O3 + 6HCl -> 2AlCl3 + 3H2O
(3) Fe2O3 + 6HCl -> 2FeCl3 + 3H2O
Lấy dd NaOH vừa tạo thành làm chất thử. Nhỏ đến dư NaOH vào từng dd MgCl2,
AlCl3, FeCl3. Hiện tượng:
- xuất hiện kết tủa trắng Mg(OH)2:
MgCl2 + 2NaOH -> Mg(OH)2 + 2NaCl
- xuất hiện kết tủa trắng dạng keo Al(OH)3 sau đó tan ra:
(1) AlCl3 + 3NaOH -> Al(OH)3 + 3NaCl
(2) Al(OH)3 + NaOH -> NaAlO2 + 2H2O
- xuất hiện kết tủa nâu đỏ Fe(OH)3:
FeCl3 + 3NaOH -> Fe(OH)3 + 3NaCl
Bài 3:
(1) P2O5 + 3H2O 2H3PO4
(2) Na2O + H2O 2NaOH
(3) CuCl2 + 2KOH Cu(OH)2 + 2KCl
(4) 6HCl + Al2O3 2AlCl3 + 3H2O
(5) MgO + H2SO4 MgSO4 + H2O
(6) H2SO4 + 2NaOH Na2SO4 + H2O
(7) 2Fe(OH)3 𝑡
𝑜
→ Fe2O3 + 3H2O
(8) KOH + HNO3 KNO3 + H2O
</div>
<span class='text_page_counter'>(4)</span><div class='page_container' data-page=4>
Truy cập vào: để học Tốn – Lý – Hóa – Sinh – Văn - Anh tốt nhất! 4
Bài 4:
Dãy chuyển hóa có thể là:
a) CuCl2 → Cu(OH)2 → CuO → Cu → CuSO4
Hoặc: b) Cu → CuO → CuSO4 → CuCl2 → Cu(OH)2
Hoặc: c) Cu → CuSO4 → CuCl2 → Cu(OH)2 → CuO
<b>a) CuCl2→ Cu(OH)2 → CuO → Cu → CuSO4 </b>
(1) CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
(2) Cu(OH)2 𝑡
𝑜
→ CuO + H2O
(3) CuO + H2 → Cu + H2O
(4) Cu + 2H2SO4đ → CuSO4 + SO2 + 2H2O
<b>b) Cu → CuO → CuSO4→ CuCl2→ Cu(OH)2</b>
(1) Cu + O2 CuO
(2) CuO + H2SO4 → CuSO4 + H2O
(3) CuSO4 + NaCl → CuCl2 + Na2SO4
(4) CuCl2 + NaOH → Cu(OH)2 + 2NaCl
<b>c) Cu → CuSO4→ CuCl2→ Cu(OH)2→ CuO </b>
(1) Cu + 2H2SO4đ → CuSO4 + SO2 + 2H2O
(2) CuSO4 + NaCl → CuCl2 + Na2SO4
(3) CuCl2 + NaOH → Cu(OH)2 + 2NaCl
(4) Cu(OH)2 𝑡
𝑜
→ CuO + H2O
Bài 5:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
SO2 + 2CO → 2CO2 + S
S + H2 𝑡
0
→ H2S
2H2S + 3O2dư → 2SO2 + 2H2O
2SO2 + O2 𝑉2𝑂5,𝑡
0
→ SO3
2SO3 + 2NH3 𝑡
0
</div>
<span class='text_page_counter'>(5)</span><div class='page_container' data-page=5>
Truy cập vào: để học Toán – Lý – Hóa – Sinh – Văn - Anh tốt nhất! 5
H2SO4 + BaCl2 → BaSO4 + 2HBr
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
BaSO4 𝑡
0
</div>
<!--links-->
Mối quan hệ giữa các khâu sản xuất phân phối trao đổi tiêu dùng trong quá trình tái sản xuất
- 11
- 1
- 2