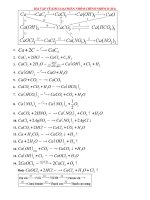LUYEN TAP II KIM LOAI
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1022.58 KB, 23 trang )
<span class='text_page_counter'>(1)</span>1 2 3 4 5 6 7. K K A L I H Ơ P K II M N H Ô M C LL O O X I A T R I N A K H Ô II L Ư Ơ N G.
<span class='text_page_counter'>(2)</span> Hàng ngang số 1: gồm 4 chữ cái: Đây là nguyên tố đúng đầu trong dãy hoạt động hóa học của kim loại..
<span class='text_page_counter'>(3)</span> Hàng ngang số 2: gồm 6 chữ cái: Để chống lại sự ăn mòn kim loại người ta chế tạo một số vật dụng làm bằng ……..
<span class='text_page_counter'>(4)</span> Hàng ngang số 3: gồm 4 chữ cái: Đây là tên một kim loại màu trắng, nhẹ, dẻo, dẫn điện, dẫn nhiệt tốt và có thể tác dụng với dd NaOH..
<span class='text_page_counter'>(5)</span> Hàng ngang số 4: gồm 3 chữ cái: Đây là một chất khí màu vàng lục, khi tham gia phản ứng với một số kim loại sẽ tạo thành muối..
<span class='text_page_counter'>(6)</span> Hàng ngang số : gồm 3 chữ cái: Đây là một chất khí không màu, khi tham gia phản ứng với một số kim loại sẽ tạo thành oxit ..
<span class='text_page_counter'>(7)</span> Hàng ngang số 6: gồm 5 chữ cái: Là nguyên tố có nguyên tử khối bằng 23..
<span class='text_page_counter'>(8)</span> Hàng ngang số 7: gồm 9 chữ cái: Trong một phản ứng hóa học, tổng ……. các chất sản phẩm bằng tổng …..các chất tham gia phản ứng..
<span class='text_page_counter'>(9)</span> TRƯỜNG THCS PHƯỚC MINH Tổ Hóa- Sinh. CHEMISTRY.
<span class='text_page_counter'>(10)</span> NỘI DUNG CHÍNH :. I. Kiến thức cần nhớ. 2. Bài tập. CHEMISTRY.
<span class='text_page_counter'>(11)</span> I. Kiến thức cần nhớ:. II. Bài tập. A. Hãy điền công thức hóa học phù 1. Tính chất hóa học của kim hợp vào chỗ trống và viết PTHH cho loại. mỗi trường hợp sau: a)Tác dụng với phi kim: to 1. ……. + 2O2 ---> Fe3O4 * Với O2 oxit. to 2……….+ Cl2 ---> 2NaCl * Với phi kim khác muối b) Tác dụng với dd axit. 3. Fe + ……… ---> FeCl2 + H2 c)Tác dụng với dd muối. 4. Fe + ……….. ---> FeSO4 + Cu. 5……. + 2H2O ---> 2KOH +H2 B. Để làm được bài tập này, em cần những kiến thức gì từ chương 2?.
<span class='text_page_counter'>(12)</span> I. Kiến thức cần nhớ: 1. Tính chất hóa học của kim loại. a)Tác dụng với phi kim: * Với O2 oxit. * Với phi kim khác muối b) Tác dụng với dd axit. c)Tác dụng với dd muối.. Bài tập 1 to 3Fe + 2O2 o Fe3O4 1. …… t 2. 2Na …...+ Cl2 2NaCl 2HCl FeCl + H 3. Fe + …….. 2 2 CuSO4 4. Fe + ……….. FeSO4 + Cu 2K 5. ……+ 2H2O 2KOH + 3H2.
<span class='text_page_counter'>(13)</span> I. Kiến thức cần nhớ: 1. Tính chất hóa học của kim loại. a)Tác dụng với phi kim: * Với O2 oxit. * Với phi kim khác muối b) Tác dụng với dd Để axit. c)Tác dụng muối. làmvới ddđược bài động tập này, Dãy hoạt hóa học em cần của kim loại: những kiến K,Na,Mg,Al,Zn,Fe,Pb, thức gì từ (H), Cu, Ag, Au. chương 2?. ?. II. Bài tập (Bài 3/SGK/69). Có 4 kim loại A,B,C,D đứng sau Mg trong dãy HĐHH. Biết rằng: - A và B tác dụng với dd HCl giải =>HA,B đứng trước H phóng khí 2. - C và D không phản ứng với dd HCl. => C,D đứng sau H B đứng trước A của A và - B tác=> dụng với dd muối giải phóng A. D đứng trước C của C và - D tác => dụng với dd muối giải phóng C. Hãy xác định thứ tự sắp xếp nào sau đây là đúng (theo chiều hoạt động hóa học giảm dần: a. B,D,C,A b. D,A,B,C..
<span class='text_page_counter'>(14)</span> I. Kiến thức cần nhớ: 1. Tính chất hóa học của kim loại. 2. Tính chất hóa học của nhôm và sắt có gì giống và khác nhau ? Giống nhau. Khác nhau. - Al, Fe đều có tính chất hóa học của kim loại. - Đều không phản ứng với HNO3 đặc, nguội và H2SO4 đặc, nguội.. ?. 2 kim loại là nhôm và sắt có những tính chất hóa học gì chung?.
<span class='text_page_counter'>(15)</span> I. Kiến thức cần nhớ:. Để phân biệt 2 kim 1. Tính chất hóa học của kim loại. loại là nhôm và sắt ta dùng hóa chất nào sau đây: a.dd NaCl. 2. Tính chất hóa học của nhôm và sắt có gì b.HNO3 đặc, nguội. giống và khác nhau ? c.Dd NaOH. Giống - Al, Fe đều có tính chất hóa học của d.H2SO4đặc, nguội. nhau kim loại.. - Đều không phản ứng với HNO3 đặc, nguội và H2SO4 đặc, nguội.. Khác - Al có phản ứng với kiềm. nhau.
<span class='text_page_counter'>(16)</span> I. Kiến thức cần nhớ:. ?. 1. Tính chất hóa học của kim loại. Hoàn thành sơ đồ phản 2. Tính chất hóa học của nhôm và sắt có ứng hóa học sau đây ? gì giống và khác nhau: Giống nhau: - Al, Fe đều có tính chất hóa học của. kim loại.. t0. 2Al + 3Cl2 -->….. 2Al + 6HCl --> ……. .+3H2. - Đều không phản ứng với HNO3 đặc, t0 2Fe + 3Cl2 --> …… nguội và H2SO4 đặc, nguội.. Khác - Al có phản ứng với kiềm. nhau. Fe + 2HCl --> …+ H2.
<span class='text_page_counter'>(17)</span> I. Kiến thức cần nhớ:. ?. 1. Tính chất hóa học của kim loại. Hoàn thành sơ đồ phản 2. Tính chất hóa học của nhôm và sắt có ứng hóa học sau đây ? gì giống và khác nhau: Giống nhau: - Al, Fe đều có tính chất hóa học của. kim loại.. t0. 2Al + 3Cl2 ---> ….. 2Al + 6HCl---> ……+ 3H2. - Đều không phản ứng với HNO3 đặc, t0 2Fe + 3Cl ---> nguội và H2SO4 đặc, nguội.. Khác - Al có phản ứng với kiềm. nhau. ……. Fe + 2HCl --->…… + H2.
<span class='text_page_counter'>(18)</span> I. Kiến thức cần nhớ:. ?. 1. Tính chất hóa học của kim loại. Hoàn thành sơ đồ phản 2. Tính chất hóa học của nhôm và sắt có ứng hóa học sau đây ? gì giống và khác nhau: Giống nhau: - Al, Fe đều có tính chất hóa học của. kim loại.. t0. 2AlCl3 2Al + 3Cl2 ….. 2AlCl. 3 +3H2 2Al + 6HCl …….. - Đều không phản ứng với HNO3 đặc, t0 2Fe + 3Cl nguội và H2SO4 đặc, nguội.. Khác - Al có phản ứng với kiềm. nhau. - Khi tham gia phản ứng tạo hợp chất Al chỉ có hóa trị III, còn sắt tạo thành hợp chất trong đó Fe có hóa trị (II) hoặc (III).. 2FeCl3 …… Sắt (III) clorua Fe + 2HCl FeCl ……2 + H2 Sắt (II) clorua.
<span class='text_page_counter'>(19)</span> I. Kiến thức cần nhớ: 1. Tính chất hóa học của kim loại. 2. Tính chất hóa học của nhôm và sắt có gì giống và khác nhau: 3. Hợp kim của sắt: thành phần, tính chất và sản xuất gang, thép:. GANG Thành phần. Hàm lượng cacbon 2-5%. Tính chất. Giòn, không rèn, không dát mỏng được.. Sản xuất. - Trong lò cao. - Nguyên tắc: Dùng CO khử các oxit sắt ở t0 cao: to. 3CO + Fe2O3 3CO2 + 2Fe. THÉP Hàm lượng cacbon <2% Đàn hồi, dẻo và cứng. -Trong lò luyện thép -Nguyên tắc: Oxi hóa các nguyên tố C, Mn, Si, S, P, … có trong gang. o t. FeO + C Fe + CO.
<span class='text_page_counter'>(20)</span> I. Kiến thức cần nhớ:. Thế nào là sự ăn mòn kim loại ?. 1. Tính chất hóa học của kim loại.. - Sự ăn mòn kim loại : là sự phá hủy kim loại và hợp kim do tác dụng hóa học trong môi trường.. 2. Tính chất hóa học của nhôm và sắt có gì giống và khác nhau: Những yếu tố ảnh hưởng đến sự ăn mòn kim loại ? 3. Hợp kim của sắt: thành + Môi trường mà chúng tiếp xúc. phần, tính chất và sản xuất + Nhiệt độ của môi trường… gang, thép: Biện pháp bảo vệ kim loại không 4. Sự ăn mòn kim loại và bảo bị ăn mòn ? vệ kim loại không bị ăn mòn: + Ngăn không cho kim loại tiếp xúc với môi trường + Chế tạo những hợp kim ít bị ăn mòn..
<span class='text_page_counter'>(21)</span> I. Kiến thức cần nhớ: 1. Tính chất hóa học của kim loại. 2. Tính chất hóa học của nhôm và sắt có gì giống và khác nhau:. II. Bài tập: Bài tập 4: Viết các phương trình hóa học biểu diễn sự chuyển đổi sau đây: (2). (1). a.Al Al2O3 Al (1). 3. Hợp kim của sắt: thành phần, tính chất và sản xuất gang, thép: 4. Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn:. (2). b.Fe2O3 Fe FeSO4 Trả lời: to a. (1) 4Al + 3O2 2Al2O3 b.. (2) 2Al2O3. đp nc criolit. (1) Fe2O3 +3CO (2) Fe + H2SO4(Loãng). to. 4Al + 3O2 2Fe + 3CO2 FeSO4 + H2.
<span class='text_page_counter'>(22)</span> II. Bài tập: (Bài 5/SGK- Tr 69) Cho 9,2 gam một kim loại A phản ứng với khí clo dư tạo thành 23,4 gam muối. Hãy xác định kim loại A, biết rằng A có hóa trị I. Hướng dẫn: - Để xác định kim loại A ta phải tìm được khối lượng mol của A. B1: Viết PTHH B2: Lập và giải phương trình đại số tìm khối lượng mol của A (Dựa vào tỉ lệ phản ứng về khối lượng các chất liên quan trong PTHH và dữ kiện đề bài cho ). B3: Kết luận .. Giải: Gọi khối lượng mol của kim loại là A. PTHH: 2A + Cl2 2ACl 2(MA+35,5) 2MA 9,2 g 23,4 g Ta có pt: 9,2. 2(MA+35,5)= 2MA. 23,4 => MA = 23 Vậy A là Na (natri).
<span class='text_page_counter'>(23)</span> HƯỚNG DẪN HỌC Ở NHÀ 1. Nắm vững kiến thức vừa luyện tập. 2. Hoàn thành các bài tập còn lại trong SGK. 3. Mỗi nhóm đọc kĩ nội dung bài thực hành. Chuẩn bị sẵn bản tường trình bài thực hành theo mẫu: Tên TN. Hóa chất. Thao tác. (Ghi trước). (Ghi trước). (Ghi trước). Hiện tượng. Giải thích – Kết luận.
<span class='text_page_counter'>(24)</span>