Bai 26 Clo
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (104.17 KB, 5 trang )
<span class='text_page_counter'>(1)</span>Ngày soạn: Ngày dạy: Tuần: 16 Tiết: 31. BÀI 26: CLO (TIẾT 1) I. Mục tiêu 1. Kiến thức - HS biết được tính chất vật lí của clo. - Tính chất hoá học của clo - Một số ứng ứng dụng của clo - Biết phương pháp điều chế khí clo trong phòng thí nghiệm và trong công nghiệp. 2. Kĩ năng - Biết dự đoán tính chất hoá học của clo và kiểm tra dự đoán bằng thí nghiệm hoá học. - Biết thao tác một số thí nghiệm - Viết được phương trình phản ứng minh hoạ cho tính chất hoá học - Biết quan sát sơ đồ, nghiên cứu sgk để rút ra các kiến thức về tính chất hoá học ứng dụng, điều chế II. Chuẩn bị: - Bình đựng khí clo, dây đồng, đèn cồn, ống nghiệm, cốc, bình đựng khí - Dd kiềm, khí clo. - Sơ đồ thùng điện phân dd muối ăn. III. Tiến trình bài giảng 1. Tổ chức 2. Kiểm tra bài cũ - HS 1: Tính chất vật lí và hoá học của phi kim - HS 2: Làm bài tập 3 3. Bài giảng Phương pháp HĐ 1: Tìm hiểu tính chất vật lí của clo - Giáo viên cho HS quan sát bình đựng khí clo - HS quan sát trạng thái, màu sắc, nhận xét về mùi của khí clo. - HS đọc thông tin từ sgk hoàn thiện. Nội dung I. Tính chất vật lí Clo là chất khí không màu, mùi hắc. Clo nặng gấp 2,5 lần không khí tan được trong nước. Clo độc..
<span class='text_page_counter'>(2)</span> tính chất vật lí của clo HĐ 2: nghiên cứu tính chất hoá học của clo - HS nhắc lại tính chất của phi kim và dự đoán tính chất hoá học của clo. II. Tính chất hoá học 1. Clo có tính chất hoá học của phi kim không? a. Tác dụng với kim loại 3Cl2 + 2Fe 2FeCl2 Cl2 + Cu CuCl2 Nhận xét: clo phản ứng với hầu hết kim loại tạo thành muối clorua.. - HS nêu ví dụ phản ứng của clo với hiđro, với sắt, viết phương trình hoá học. b.Tác dụng với hiđro - Giáo viên thực hiện phản ứng của Clo phản ứng dễ dàng với hiđro tạo clo với đồng thành khí hiđro clorua - HS quan sát hiện tượng, giải thích, Cl2 + H2 2HCl viết phương trình hoa học của clo Clo có tính chất hoá học của phi với đồng kim. Clo là phi kim hoạt động hoá - Giáo viên thông báo: clo không học mạnh. phản ứng trực tiếp với oxi 2. Clo còn có tính chất hoá học nào - HS kết luận về tính chất hoá học khác? của clo a. Tác dụng với nước Giáo viên nêu vấn đề:ngoài một số tính - Thí nghiệm: Dẫn khí clo vào cốc chất hoá học của phi kim clo còn có tính nước, nhúng mẩu giấy quì tím chất nào khác? vào dd thu được. - Giáo viên làm thí nghiệm biểu diễn - Hiện tượng: dd nước clo có màu clo tác dụng với nước vàng lục, giấy quì tím chuyển - HS quan sát trạng thái, màu sắc, sang màu đỏ sau đó mất màu nhận xét về mùi nước clo. Quan sát ngay. màu quì tím trước và sau khi tiếp - PTHH: xúc với nước clo Cl2 + H2O HCl + HClO - Giáo viên giải thích hiện tượng b. Tác dụng với dd NaOH - Giáo viên: Sự hoà tan clo vào nước - Thí nghiệm: Dẫn khí clo vào ống là hiện tượng vật lí hay hiện tượng nghiệm đựng dd NaOH. Nhỏ 1-2 hoá học? giọt dd vừa tạo thành vào giấy - Giáo viên làm thí nghiệm biểu diễn quì tím. phản ứng của clo với dd kiềm - Hiện tượng: dd tạo thành không - HS quan sát trạng thái màu sắc của màu, giấy quì tím mất màu khí clo và của dd NaOH trước và - Nhận xét: clo đã phản ứng với sau phản ứng, sự biến đổi của giấy dd NaOH. quì và dự đoán chất tạo thành sau Cl2 + 2NaOH NaCl +NaClO + H2O phản ứng. Dd 2 muối NaCl và NaClO gọi là - HS rút ra nhận xét chung nước giaven.
<span class='text_page_counter'>(3)</span> - HS tóm tắt tính chất hoá học cơ bản của clo - Giáo viên kết luận về tính chất hoá học của clo 4. Củng cố - Tóm tắt ý chính phần đã học - Sử dụng bài tập 1,2 để củng cố 5. Hướng dẫn học ở nhà - Học bài và làm bài tập về nhà số 4,5,6,10 - Hướng dẫn làm bài tập 10 IV. Rút kinh nghiệm. Ngày soạn: Ngày dạy: Tuần: 17 Tiết: 32. BÀI 26: CLO (TIẾT 2) IV. Mục tiêu 3. Kiến thức - HS biết được tính chất vật lí của clo. - Tính chất hoá học của clo - Một số ứng ứng dụng của clo - Biết phương pháp điều chế khí clo trong phòng thí nghiệm và trong công nghiệp. 4. Kĩ năng - Biết dự đoán tính chất hoá học của clo và kiểm tra dự đoán bằng thí nghiệm hoá học. - Biết thao tác một số thí nghiệm - Viết được phương trình phản ứng minh hoạ cho tính chất hoá học - Biết quan sát sơ đồ, nghiên cứu sgk để rút ra các kiến thức về tính chất hoá học ứng dụng, điều chế V. Chuẩn bị:.
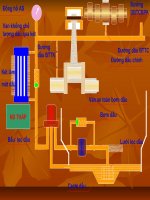
<span class='text_page_counter'>(4)</span> - Bình đựng khí clo, dây đồng, đèn cồn, ống nghiệm, cốc, bình đựng khí - Dd kiềm, khí clo. - Sơ đồ thùng điện phân dd muối ăn. VI. Tiến trình bài giảng 1. Tổ chức: 2. Kiểm tra bài cũ - HS 1: nêu tính chất vật lí và hoá học của clo - HS 2: Làm bài tập 6 3. Bài giảng 4. Phương pháp Nội dung HĐ 3: Tìm hiểu những ứng dụng của III. ứng dụng của clo clo - Khử trùng nước sinh hoạt Giáo viên cho học sinh xem sơ đồ và - Tẩy trắng vải, sợi, bột giấy nêu những ứng dụng của clo - Điều chế nhựa PVC, chất dẻo, chất HS khác có thể bổ sung từ kiến thức màu, cao su... thực tế - Điều chế nước giaven, chất màu, clorua vôi, HĐ 4: Phương pháp điều chế khí clo IV. Điều chế khí clo - Giáo viên lắp dụng cụ điều chế 1. Điều chế khí clo trong phòng thí khí clo nghiệm - Giáo viên làm thí nghiệm, yêu - Đun nóng nhẹ dd HCl đậm đặc với cầu HS quan sát hiện tượng chất oxi hoá mạnh như MnO2. Có - Giáo viên cho học sinh thảo luận khí màu vàng lục, mùi hắc xuất tại sao thu khí clo bằng cách đẩy hiện không khí mà không thu bằng - Thu khí clo vào bình bằng cách cách đẩy nước? Lọ đựng H2SO4 đẩy không khí đặc có tác dụng gì? 4HCl + MnO2 MnCl2 + Cl2 + 2H2O - HS mô tả tóm tắt cách điều chế 2. Điều chế clo trong công nghiệp và thu khí clo trong phòng thí Điện phân dd NaCl bão hoà có màng nghiệm ngăn xốp. - Giáo viên cho cho học sinh quan Khí clo thu được ở cực dương, khí sát sơ đồ bình điện phân mô tả hiđro thu được ở cực âm, dd là NaOH quá trình điều chế clo trong công 2NaCl + 2H2O điện phân có màng ngăn Cl2 + nghiệp. H2 + 2NaOH - HS dự đoán sản phẩm và viết PT 5. Củng cố - Giáo viên cho HS thảo luận nhóm, báo cáo kết quả, rút ra kiến thức cần nhớ - Sử dụng bài tập 7,8 để củng cố.
<span class='text_page_counter'>(5)</span> 6. Hướng dẫn học ở nhà - Học bài và làm bài tập về nhà số 9,11 - Hướng dẫn làm bài tập 11. IV. Rút kinh nghiệm.
<span class='text_page_counter'>(6)</span>