Ôn tập gk hóa vô cơ đh cn hcm
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (77.32 KB, 5 trang )
Phân nhóm VA gồm các nguyên tố: N, P, As, Sb, Bi
Cấu hình electron lớp ngồi cùng: n s2n p3
Số oxi hóa đặc trưng của nhóm: -3
Do có 5 electron lớp ngồi cùng nên có xu hướng nhận thêm 3
electron nhằm bão hịa phân lớp ngồi cùng biểu hiện tính phi kim
nhưng cũng có thể nhường 5 electron nhằm bão hịa lớp ngồi cùng
biểu hiện tính kim loại. thể hiện tính oxi hóa : X + 3e- = X 3−¿ ¿
Đặc tính phi kim giảm dần từ N đến Bi
Phân nhóm VIA gồm các nguyên tố: O, S, Se, Te, Po
Cấu hình electron lớp ngồi cùng: n s2n p4
Số Oxi hóa:
O: -2, -1, +1, +2
S: -2, +2, +4, +6
Te: -2, +2, +4, +6
Po: +2, +4, +6
Do chỉ còn thiếu hai electron nữa là các ngun tố có lớp vỏ
electron ngồi cùng bảo hòa, nên xu hướng chung đặc trưng cho cả
nhóm là nhận thêm hai electron để tạo nên anion X 2-, thể hiện tính
oxi hóa : X + 2e- = X2Đặc tính phi kim giảm dần trong dãy các nguyên tố O - S - Se -Te Po. Oxigen là phi kim điển hình cịn Po là một kim loại.
Phân nhóm VIIA gồm các nguyên tố: F, Cl, Br, I, At
Cấu hình electron lớp ngồi cùng: n s2n p5
Số oxi hóa:
F: -1, 0
Cl: -1, 0, +1, +3, +5, +7
Br: -1, 0, +1, +3, +5, +7
I: -1, 0, +1, +3, +5, +7
Atatin là ngun tố khơng có trong thiên nhiên
-
Các nguyên tử halogen X chỉ còn thiếu một electron ở lớp
ngồi cùng là có được vỏ electron bền của khí hiếm
-
Dể dàng kết hợp thêm một electron tạo thành ion X-
-
Các halogen là những nguyên tố phi kim rất điển hình.
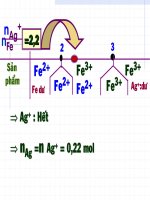
Anh (Chị) hãy cho biết dung dịch nước cường thủy là gì?
Tính oxi hóa của dung dịch nước cường thủy mạnh hơn hay
yếu hơn so với dung dịch HNO3 ban đầu? Giải thích? Viết
phương trình phản ứng hịa tan Vàng và Platin vào dung dịch
nước cường thủy?
Nước cường thủy: Hỗn hợp HNO3 và HCl theo tỷ lệ 1 : 3 (theo
thể tích) được gọi là nước cường thủy.
Nước cường thủy có tính oxi hóa mạnh hơn so với HNO3 ban đầu
Vì hoạt tính của nước cường thủy (hỗn hợp HNO 3 và HCl theo tỷ lệ
1 : 3) có vai trị của Clo mới sinh ([Cl] có tính oxi hóa mạnh).
HNO3 + HCl NO + [Cl] + H2O
Viết phương trình phản ứng hịa tan Au và Pt trong nước
cường thủy?
Au + HNO3 + 3HCl → AuCl3 + NO + 2H2O
3Pt + 4HNO3 + 12HCl → 3PtCl4 + 4NO + 8HH2O
Anh (Chị) hãy cho biết nước Javen là gì? Hãy trình bày
phương pháp điều chế nước Javen (trong cơng nghiệp)? Giải
thích tại sao nước Javen có tính oxi hóa mạnh nên được dùng
làm chất sát trùng, tẩy màu?
Nước Javen: là dung dịch nước của NaCl + NaClO được tạo nên
khi cho khí Cl2 phản ứng với dung dịch NaOH nguội.
Phương pháp điều chế nước Javen (trong công nghiệp):
Trong công nghiệp, nước javen được điều chế bằng điện phân dung
dịch NaCl 15 - 20% khơng có màng ngăn với điện cực âm là Fe, điện
cực dương là Ti.
Phương trình phản ứng
Bước 1: 2NaCl + 2H2O → 2NaOH + Cl2 + H2
Bước 2: Cl2 + 2NaOH → NaCl + NaClO + H2O
Nước Javen có tính oxi hóa mạnh nên được dùng làm chất
sát trùng, tẩy màu: Vì NaClO là muối của axit rất yếu, dễ tác dụng
với CO2 trong khơng khí tạo thành axit hipoclorơ. Do HClO có tính oxi
hóa mạnh, nên HClO có tác dụng sát trùng, tẩy màu, khử độc.
Các axit HX (X là halogen: F, Cl, Br, I) đều là axit mạnh trừ
axit HF (là một axit yếu có K a = 6,6.10-4). Hãy giải thích vì
sao và lấy ví dụ minh họa.
- Các axit HX (X: Cl, Br, I) là những axit mạnh: do Cl, Br, I có độ âm
điện lớn nên liên kết H-X phân cực mạnh → H trong liên kết trở nên
linh động. Trong nước các phân tử này phân ly mạnh tạo thành ion
H+ (H3O+)
HX + H2O = X- + H3O+
- HF là axit yếu: mặc dù F có độ âm điện lớn (xấp xỉ 4), lớn hơn các
halogen còn lại, tuy nhiên do có độ âm điện cao và bán kính bé nên
H-F tồn tại ở dạng polyme mạch thẳng (HF) n (n: 2-6) do tạo liên kết
hiđro: (... H-F... H-F...H-F...)n. Liên kết hiđro sẽ làm cho nguyên tử H
bị giữ chặt hơn và việc tách ion hiđroni H+ ra sẽ khó khăn hơn =>
HF có tính axit yếu.
2HF + H2O = H3O++ HF2Anh (Chị) hãy trình bày phương pháp điều chế Axit
sulfuric H2SO4 trong cơng nghiệp? Viết phương trình phản
ứng minh họa? Nêu ứng dụng của axit sulfuric H2SO4?
Phương pháp tiếp xúc
Bước 1: Điều chế SO2 từ S hay FeS2. Khí SO2 sinh ra lọc sạch bụi
và các tạp chất như SeO2, As2O3, PH3, hơi H2O…
4FeS2 + 11O2 → 2Fe2O3 + 8HSO2
Bước 2: 2SO2 + O2 = 2SO3 (450oC và xúc tác V2O5)
Bước 3: hỗn hợp khí SO2, O2, SO3 sinh ra đem làm nguội tới 50 oC
rồi cho tan trong dung dịch H2SO4 đậm đặc 98H,2%. Sau đó đem
Oleum H2SO4.xSO3 thu được pha loãng thành acid H 2SO4 đậm đặc
98H,2%.
Ứng dụng của axit H2SO4
H2SO4 được sử dụng nhiều nhất và rẻ tiền nhất:
- Dùng để sản xuất phân bón; Muối sunfat, tinh chế dầu mỏ;
- H2SO4 dùng nhiều trong các ngành tổng hợp hữu cơ như chất
nổ, phẩm nhuộm, dược phẩm, Dùng làm chất điện ly trong acquy
chì, Là hóa chất thơng dụng trong phịng thí nghiệm.
* Điều chế HNO3
+ Trong công nghiệp HNO3 được điều chế từ NH3
-Oxy NH3 bằng Oxy tinh thiết hoặc khơng khí đư, chất xút tác là
hợp kim Pt chứa 10% Rh
4NH3 + 5O2 = 4NO + 6H2O
-làm nguội khí NO bằng oxy khơng khí và hòa tan sản phẩm vào
nước
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
-khí NO sinh ra trong qua trình hịa tan được đưa trở lại dây
chuyền sản xuất
Ứng dụng
-HNO3 phản ứng hầu hết các hợp chất hữu cơ nên được sử dụng
nhiều trong ngành luyện kim, tinh lọc, xi mạ. Hỗn Hợp Nước cường
to hoàn tan được vàng và Pt
-Sản xuất chất hữu cơ: Sơn, Bột màu, Thuốc nhuộm vải
-Trong nhà máy sữa dùng HNO3 làm chất tẩy rửa các đường ống, bề
mặt kim loại.
*Điều chế O3
Ozon được điều chế bằng cách phóng điện êm qua khí oxy khơ. Thu
được hỗn hợp khí Oxy và Ozon trong đó tỉ lệ Ozon khoảng chiếm
10% thể tích. Cho khí oxy đi qua các thiết bị phóng điện êm ghép nối
tiếp, tỉ lệ thu được Ozon sẽ cao hơn. Làm lạnh hỗn hợp khí Oxy và
Ozon bằng Oxy lỏng khí Ozon sẽ hóa lỏng và tách ra khỏi hỡn hợp.
Ứng dụng
-Ozon là một chất diệt khuẩn tốt, một lượng nhỏ trong khơng khí có
thể làm khơng khí trở nên trong lành. Nhưng với nồng độ lớn trở nên
có hại
-Trong thực tế Ozon được dùng để khử trùng nước sinh hoạt, để ozon
hóa các hợp chất hữu cơ
-
-
Theo chiều tăng dần số oxh dương của Cl số nguyên tử O gắn
với Cl trong phân tử tăng hút electron của liên kết H-O về phía
liên kết Cl-O làm mật độ electron của liên kết H-O giảm dẫn
đến sự phân cực làm dễ dàng cắt đứt liên kết H do đó tính axit
tăng
Theo chiều tăng dần số oxh dương của Cl số electron tham gia
tạo liên kết σ , π càng tăng, làm tăng bậc liên kết Cl-O, Độ bền
liên kết tăng
Tính oxh rất mạnh – tính oxh mạnh – thể hiện tính oxh trong
mt axit – oxh yếu trong dd khơng thể hiện tính oxh