Bài giảng điều khiển quá trình 6 doc
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (471.22 KB, 11 trang )
53
- Tính phi tuyến
- Sự tương tác giữa các biến quá trình
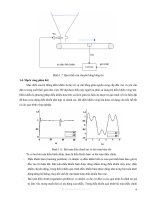
4. Ví dụ thiết bị phản ứng liên tục
Xét thiết bị phản ứng liên tục trên hình 3.7. Giả sử dung dịch vào chứa A nguyên chất, trong bình
xẩy ra phản ứng một chiều A B, tạo ra sản phẩm là tổng hợp của A và B. Tốc độ phản ứng riêng được
ký hiệu là k (s
-1
). Nồng độ ở đây có đơn vị là mol/m
3
(số mol trên một đơn vị thể tích) và được ký hiệu là
c. Ngoài các giả thiết được đặt ra tương tự như bình chứa chất lỏng trên đây, ta coi tốc độ phản ứng tổng
thể tỷ lệ trực tiếp với nồng độ của A trong bình (Phản ứng bậc nhất). Như vậy, số mol của A mất di do
phản ứng trên một đơn vị thời gian là - Vkc
A
.
Hình 3.7. Thiết bị phản ứng liên tục.
Ta có thể sử dụng phương trình cân bằng vật chất toàn phần (3.5) như trong ví dụ bình chứa:
FF
dt
dV
0
(3.12)
Các phương trình cân bằng thành phần cho cấu tử A và B được viết thành:
AAA
A
VkcFccF
dt
Vcd
00
)(
(3.13)
AB
B
VkcFc
dt
Vcd
)(
(3.14)
Trong ba phương trình cân bằng vật chất trên đây thì chỉ có hai phương trình là độc lập với nhau. Thông
thường ta sử dụng hai phương trình (3.12) và (3.13).
Khai triển đạo hàm vế trái phương trình (3.13) ta có:
AAA
A
A
VkcFccF
dt
dc
V
dt
dV
c
00
Thay thế đạo hàm của thể tích từ phương trình (3.12) và và rút gọn, ta nhận được phương trình vi phân
chỉ chứa đạo hàm của biến nồng độ:
54
0
0
A
n
A
A
c
V
F
ck
V
F
dt
dc
(3.15)
Mô hình quá trình bao gồm hai phương trình vi phân (3.12) và (3.15).
Khối lượng riêng
Vì mục đích đơn giản hoá, trong bốn ví dụ trên ta đều coi khối lượng riêng là không thay đổi. Tuy
nhiên trong nhiều trường hợp, đặc biệt là liên quan đến chất khí hoặc hơi, khối lượng riêng không thể coi
là tham số hằng, khối lượng riêng một chất lỏng hoặc một chất khí phụ thuộc vào những tính chất vật lý
như nhiệt độ, áp suất và thành phần.
),,( xTPf
(3.16)
Khối lượng riêng của một chất lỏng có thể coi là hằng số nếu như nhiệt độ và thành phần không thay đổi
lớn. Trong khi đó khối lượng riêng của chất khí cần phải thể hiện qua hệ số phụ thuộc áp suất, thể tích và
nhiệt độ. Từ phương trình đơn giản và rất thông dụng áp dụng cho chất khí lý tưởng trong đó:
P - áp suất tuyệt đối (kPa)
V – thể tích (m
3
)
n – hằng số mol (kg.mol)
R – hằng số khí lý tưởng = 8.31447 kPa.m
3
/kg.mol.K = 8.31447J/K.mol
ta xác định được khối lượng riêng của chất khí lý tưởng với khối lượng phân tử M thông qua công thức
RT
MP
V
nM
v
(3.17)
3.3.2. Phương trình cân bằng năng lượng
Định luật bảo toàn năng lượng áp dụng cho hệ nhiệt động học, hay còn gọi là định luật thứ nhất
của nhiệt động học được diễn đạt như sau:
Biến thiên năng lượng tích luỹ
=
Tổng dòng năng lượng đưa vào
-
Tổng dòng năng lượng dẫn
ra
+
Tổng công suất nhiệt hấp thụ
-
Công tiêu hao ra bên ngoài
Năng lượng toàn phần của một hệ thống động học U
bao gồm nội năng U
1
, thế năng U
P
và động năng U
K
KPI
UUUU
(3.19)
Trong nhiều quá trình nhiệt, thế năng và động năng cũng như công sinh ra có thể coi là không
đáng kể so với nội năng và nhiệt năng, vì thế có thể bỏ qua. Khi đó phương trình (3.19) có thể viết thành
qhh
dt
dU
n
1j
j
Ra
j
Ra
i
Vao
m
1i
i
Vao
I
(3.20)
trong đó
U
I
– nội năng của hệ thông (J)
ω
Vào
– lưu lượng khối lượng dòng vào hệ thống (kg/s hoặc kg/phút)
ω
Ra
– lưu lượng khối lượng dòng ra hệ thống (kg/s hoặc kg/phút)
55
h
vào
– enthalpy của dòng vào (tính trên đơn vị khối lượng, j/kg)
h
Ra
– enthalpy của dòng ra (tính trên đơn vị khối lượng, j/kg)
q – tổng lưu lượng nhiệt (công suất cấp nhiệt) bổ sung cho hệ thống thông qua dẫn nhiệt, bức xạ
nhiệt, hoặc phản ứng hoá học (J/s hoặc j/phut).
Enthalpy
Enthalpy trên một đơn vị khối lượng được định nghĩa là
VPuh
Δ
ˆ
(3.21)
trong đó
u – nội năng tính trên một đơn vị khối lượng (J/kg)
P - áp suất trên thành ống (N)
V
ˆ
- thể tích riêng (nghịch đảo của khối lượng riêng , m
3
/kg)
Đối với các chất lỏng, thành phần năng lượng
VP
ˆ
không đáng kể, do vậy phương trình (3.20) trở thành:
qhh
dt
dh
n
j
Ra
j
Ra
m
i
i
Vao
i
Vao
1
¹
1
(3.22)
Enthalpy là một đại lượng phụ thuộc vào thành phần, nhiệt độ và áp suất nhưng chủ yếu vào nhiệt độ h =
f(P, T, x). Đây là một quan hệ phi tuyến và tương đối phức tạp. Tuy nhiên, đối với nhiều bài toán mô
hình hoá ta có thể sử dụng các công thức đơn giản hoá, nếu như độ chính xác của mô hình không đòi hỏi
quá cao. Với định nghĩa nhiệt dung riêng tại một áp suất không đổi:
constP
P
T
h
C
(3.24)
và giả thiết enthalpy tại nhiệt độ quy chiếu T
ref
là h
Ref
, ta có thể viết
)(
ReRe fPf
TTChh (3.25)
Trong trường hợp áp suất và thành phần thay đổi không quá lớn, ta có thể sử dụng quan hệ đơn giản giữa
enthalpy và nhiệt độ:
TCh
P
(3.26)
cho các chất lỏng, cũng như:
vPv
TCh
(3.27)
trong các chất khí và hơi, trong đó
V
là nhiệt hoá hơi trung bình. Trong hai phương trình trên, bản thân
nhiệt dung riêng C
P
(trong điều kiện áp suất không thay đổi) cũng là một hàm phụ thuộc nhiệt độ. Một
cách gần đúng ta có thể ứng dụng dạng đa thức:
TCC
PP
0
(3.28)
Trong trường hợp cần độ chính xác cao, enthalpy của một chất lỏng đồng nhất sẽ được biểu diễn lại theo
nhiệt độ sau:
56
)(
2
)()(
2
0
2
0000
0
TTTTChdTTChh
T
T
PP
(3.29)
Enthalpy của một hỗn hợp chất lỏng gồm nc cấu tử được xác định một cách đơn giản bằng cách lấy trung
bình của từng cấu tử
nc
i
ii
nc
i
iii
mx
mhx
h
1
1
(3.30)
trong đó:
x
i
– phần khối lượng của cấu tử thứ i trong hỗn hợp
m
i
– khối lượng của phân tử cấu tử i
h
i
– enthalpy riêng của cấu tử thứ i (J/kg)
1. Ví dụ thiết bị gia nhiệt
Quay trở lại ví dụ về gia nhiệt trong phần 3.2.3 (Hình 3.3). Việc xây dựng mô hình cho hầu hết
các quá trình trao đổi nhiệt nói chung dựa trên cơ sở phương trình cân bằng nhiệt lượng và phương trình
truyền nhiệt cho trạng thái xác lập. Tuy nhiên ở đây ta tạm thời dừng lại chỉ áp dụng phương trình cân
bằng nhiệt lượng. So với nhiệt lượng, động năng và thế năng trong một bộ trao đổi nhiệt là không đáng
kể, vì thế có thể bỏ qua. Ở trạng thái xác lập, nhiệt lượng do dòng gia nhiệt toả ra đúng bằng nhiệt lượng
do dòng quá trình hấp thụ
)()(
1221 CCCHHH
hhhh
(3.31)
Sử dụng quan hệ giữa enthalpy và nhiệt độ trong (3.25) và coi nhiệt dung riêng của từng dòng không thay
đổi, phương trình cân băng nhiệt ở trạng thái ổn định trở thành:
)()(
1221 CCPCCHHPHH
TTCTTC
(3.32)
2. Ví dụ quá trình trao đổi nhiệt trực lưu
Quá trình pha trộn trực lưu được mở rộng thêm vấn đề trao đổi nhiệt trực tiếp giữa hai dòng và
minh hoạ trên hình 3.8. Các ký hiệu cũng như tính toán được giữ nguyên. ở đây ta đưa ra các giả thiết như
sau:
- Dòng chảy chế độ xoáy và lấp kín các dường ống, nên thời gian trễ có thể xác định được từ lưu
lượng
- Quá trình tao đổi nhiệt diễn ra lý tưởng, có nghĩa là nhiệt độ T ở dòng ra là đồng nhất.
- Nhiệt lượng tiêu hao ra môi trường xung quanh có thể bỏ qua.
- Động năng và thế năng là không đáng kể so với nhiệt năng.
- Khối lượng riêng của dòng vào và dòng ra không thay đổi đáng kể.
57
Hình 3.8. Quá trình trao đổi nhiệt trực lưu.
Ta cũng lưu ý rằng, trong quá trình trao đổi nhiệt trực lưu không có sự tích luỹ năng lượng, mặt
khác ta chỉ quan tâm đến giá trị các biến tại những vị trí quan sát cố định. Động học của hệ thống thể hiện
ở những phần tử trễ (do quá trình vận chuyển), phương trình cân bằng nhiệt chỉ phản ánh đặc tính của hệ
ở trạng thái xác lập.
Với giả thiết và phân tích trên đây, phương trình cân bằng nhiệt (3.21) được áp dụng và cho ta:
)()()()()()(
2222211111
tTtFthtFthtF
(3.33)
trong đó h
1
, h
2
và h lần lượt là enthalpy của các dòng vào và dòng ra. Sử dụng quan hệ giữa enthalpy và
nhiệt độ (3.25) và coi nhiệt độ riêng của hai dòng chảy là như nhau, phương trình (3.33) sau khi rút gọn
các số hạng liên quan tới h
Ref
và T
Ref
được biểu diễn với biến nhiệt độ sau:
ρF(t)T(t))θ(t)Tθ(tFρ)θ)T(tθ(tFρ
222221111
(3.34)
Tất nhiên có thể tiếp tục đơn giản hoá phương trình (3.34) bằng cách coi
1
=
2
= hoặc sử dụng biến
lưu lượng khối lượng (kí hiệu ω) thay cho biến lưu lượng thể tích.
)()()()()()(
22221111
tTttTttTt
(3.35)
3. Ví dụ bình chứa nhiệt
Sơ đồ bình chứa nhiệt tự tràn được minh hoạ trên hình 3.9. Bình chứa trung gian có vai trò giảm
giao động trong nhiệt độ của một dòng quá trình. Để đơn giản hoá, trước hết ta giả thiết rằng hệ thống
khuấy trộn hoạt động lý tưởng, có nghĩa là nhiệt độ đồng nhất và luôn bằng nhiệt độ ra. Khối lượng riêng
và nhiệt dung riêng C
p
được coi là thay đổi không đáng kể trong phạm vi làm việc, nên giữa dòng vào,
dòng ra và trong bình chứa cũng không có sự khác nhau về những giá trị này. Tiếp theo, các thành phần
động năng, thế năng và phần nhiệt tổn thất ra bên ngoài được coi là không đáng kể so với nhiệt đối lưu.
Phương trình cân bằng nhiệt trước hết được biểu diễn với enthalpy theo (3.22) :
hFhF
dt
Vhd
00
)(
(3.36)
Do bình chứa tự tràn nên V= const và F
0
= F. Áp dụng (3.25), sau khi rút gọn, ta có phương trình cân
bằng nhiệt biểu diễn theo biến nhiệt độ:
58
)(
0
TT
V
F
dt
dT
(3.37)
Hình 3.9. Bình chứ nhiệt.
3.3.3. Phương trình cân bằng nhiệt
Hầu hết các quá trình công nghệ liên quan đến quá trình truyền nhiệt. Vì vậy bên cạnh các phương
trình cân bằng nhiệt lượng thì các phương trình mô tả truyền nhiệt có vai trò hết sức quan trọng trong mô
hình hoá quá trình. Hiện tượng truyền nhiệt được chia làm ba loại là dẫn nhiệt đối lưu và bức xạ.
1. Dẫn nhiệt
Khi tồn tại chênh lệch nhiệt độ trong một vật thể liên tục, nhiệt được truyền theo chiều giảm nhiệt
độ mà không cần xẩy ra hiện tượng chuyển động vĩ mô. Theo định luật Fourier, lưu lượng nhiệt tỷ lệ
thuận và ngược dấu với gradient của nhiệt độ. Với dòng nhiệt một chiều qua bề mặt A, ta có:
dz
dT
k
dA
dq
(3.38)
q – nhiệt lượng (công suất nhiệt) theo hướng vuông góc với tiết diện
A – diện tích bề mặt dẫn nhiệt
z – khoảng cách theo chiều vuông góc với tiết diện
k – hệ số dẫn nhiệt (phụ thuộc vào vật liệu và nhiệt độ)
2. Đối lưu
Đối lưu là hình thức truyền nhiệt thông qua các dòng chảy vĩ mô (một chiều hoặc luân chuyển), ví
dụ từ một bề mặt nóng tới một dòng chảy hoặc giữa hai dòng chảy ngược chiều. Trường hợp truyền nhiệt
đối lưu giữa một bề mặt (tường, lớp chất lỏng, hạt rắn) với một dòng chảy đóng một vai trò hết sức quan
59
trọng trong các quá trình công nghệ. Công suất truyền nhiệt qua một bề mặt được tính theo định luật
Newton:
)(
fs
TTk
A
q
(3.39)
trong đó:
T
s
– nhiệt độ lớp bề mặt
T
f
– nhiệt độ trung bình của dòng chảy
k – hệ số nhiệt đối lưu (phụ thuộc vào đặc tính dòng chảy và đặc tính nhiệt của lưu chất).
Hình 3.10. Truyền nhiệt qua lớp tường.
Trường hợp hai dòng chảy trao đổi nhiệt gián tiếp với nhau qua một bức tường (Hình 3.10, ví dụ thành
ống dẫn), hệ số truyền nhiệt tổng thể được xác định từ hệ số truyền nhiệt của bức tường, bề dày của bức
tường và hệ số truyền nhiệt đối lưu. Tuy nhiên, đây là quan hệ tương đối phức tạp, phụ thuộc vào nhiều
yếu tố, vì vậy cũng có thể xác định thông qua thực nghiệm. Công suất truyền nhiệt sẽ được tính theo công
thức
)(
21
TTuAq
(3.40)
trong đó:
u – hệ số truyền nhiệt tổng thể
T
1
– nhiệt độ trung bình của dòng chảy thứ nhất
T
2
– nhiệt độ trung bình của dòng chảy thứ 2Hai hình thức khác của truyền nhiệt đối lưu là
gây ra trao đổi nhiệt giữa các phần trong chất lỏng hoặc chất khí đối lưu tự nhiên (ví dụ do hiện tượng
khuyếch tán, chênh lệch về khối lượng riêng), và đối lưu cưỡng bức (với dụ gây ra bởi hệ thống máy bơm
hoặc hệ thống khuấy trộn). Đây là các biện pháp công nghệ ít liên quan tới việc xây dựng mô hình toán
học cho quá trình.
3. Bức xạ
Bức xạ là hiện tượng tuyền năng lượng qua không gian thông qua sóng điện từ. Tới một bề mặt,
năng lượng đó có thể được hấp thụ, được phản xạ hoặc được truyền tiếp. Khi phần năng lượng đó được
60
hấp thụ sẽ chuyển sang nhiệt lượng. Gọi hệ số hấp thụ là , hệ số phản xạ là và hệ số truyền nhiệt là ,
ta có quan hệ cơ bản sau đây:
1
(3.41)
Một vật đen được coi là một vật có khả năng hhấp thụ mạnh nhất, tức là có hệ số hấp thụ bằng 1.
Ngược lại, một vật đen cũng có khả năng phát xạ mạnh nhất, tức là hệ số phát xạ = 1. Năng lượng bức
xạ của vật đen tỷ lệ với luỹ thừa bậc 4 của nhiệt độ và tính theo định luật Stefan – Boltzmann:
4
b
σTW
(3.42)
trong đó:
W
b
= công suất phát xạ trên một đơn vị diện tích
- hằng số Stefan – Boltzmann
T – nhiệt độ tuyệt đối
Như vậy, hê số phát xạ của một vật bất kỳ chính là tỷ số giữa công suất phát xạ của vật đó so với
công suất phát xạ của vật đen:
b
W
W
ε (3.43)
Công suất phát xạ toàn phần của của một vật qua một diện tích sẽ được tính theo công thức:
4
111
TAq
(3.44)
Theo định luật kirchhoff, công suất phát xạ của hai vật ở trạng thái cân bằng nhiệt độ đặt cùng một môi
trường sẽ có quan hệ như sau:
2
2
1
1
ww
(3.45)
3.3.4. Phương trình động học phản ứng hoá học
* Tốc độ phản ứng
Tốc độ phản ứng riêng k là một hệ số phụ thuộc vào nhiệt độ, thường được biểu diễn theo
Arrhenius dưới dạng một hàm luỹ thừa:
RTE
ekk
/
0
(3.46)
trong đó k
0
được coi là một hằng số, E là năng lượng kích hoạt thể hiện mức độ phụ thuộc nhiệt độ và R
là hằng số khí lý tưởng. Cả hai tham số k
0
và E cần được xác định từ thực nghiệm. Phương trình (3.46)
thể hiện một quan hệ phi tuyến mạnh. Cũng cần lưu ý rằng, sự phụ thuộc của tốc độ phản ứng riêng vào
nhiệt độ theo cấp luỹ thừa như trên chỉ đúng trong trường hợp lý tưởng (không hạn chế về không gian tiếp
xúc và lưu lượng tham gia phản ứng), cũng như không xẩy ra quá trình chuyển khối (bốc hơi, ngưng tụ).
Tốc độ phản ứng tổng thể phụ thuộc vào tốc độ phản ứng riêng và nồng độ của các chất tham gia
phản ứng. Đối với phản ứng phụ thuộc chính tới một chất đầu vào (A B + C + ), tốc độ phản ứng tổng
thể cũng thường là một hàm luỹ thừa đối với nồng độ A:
61
n
A
cTkr )( (3.47)
trong đó số mũ n có thể coi là số nguyên hoặc là phân số, trường hợp n = 1 còn được gọi là phản ứng bậc
nhất, n = 2 được gị là phản ứng bậc 2. Đối với phản ứng có hai chất tham gia (A + B C + D + ), ta có
thể sử dụng công thức
b
B
a
A
ccTkr )( (3.48)
* Điểm cân bằng hoá học
Điểm cân bằng hoá học trong một hệ thống phản ứng đạt được khi
0
i
nc
i
i
(3.49)
trong đó
i
– hệ số hoá học lượng pháp của cấu tử thứ i trong hỗn hợp (có dấu âm đối với chất tham gia
phản ứng và dương với sản phẩm)
i
– thế năng hoá học của cấu tử thứ i.
Thế năng hoá học của một cấu tử trong hỗn hợp chất khí được xác định theo công thức
iii
PRT ln
0
(3.50)
trong đó
0
i
- thế năng hoá học chuẩn của cấu tử thứ i
p
i
- áp suất riêng của cấu tử thứ i.
Ví dụ, trong một phản ứng với hai chất khí A và B (A B) ta có thể viết
0
AABB
0)ln()ln(
00
AAABBB
PRTPRT
(3.51)
hay là
RT
P
P
BBAA
K
A
A
B
B
P
00
ln
(3.52)
Biểu thức trong dấu ngoặc ở vế trái được định nghĩa là hằng số cân bằng hoá học (K
P
). Hằng số
này nói lên tỉ lệ cân bằng giữa sản phẩm và chất tham gia phản ứng. Lưu ý rằng, vế phải của (3.52) chỉ
còn phụ thuộc vào nhiệt độ.
3.3.5. Phương trình cân bằng pha
Đối với một hỗn hợp gồm hai pha (ví dụ pha lỏng và pha hơi), cân bằng pha được định nghĩa là
trạng thái mà thế năng hoá học của mỗi cấu tử ở hai pha bằng nhau:
II
i
I
i
(3.53)
Các bài toán tiêu biểu đặt ra liên quan tới điểm cân bằng pha là tính toán điểm sôi, điểm sương
hoặc điểm bốc cháy. Quan hệ mấu chốt ở đây là quan hệ giữa nhiệt độ, áp suất và cấu tử hỗn hợp trong
62
các pha. Trong thực tế người ta sử dụng nhiều quan hệ đơn giản hoặc phức tạp khác nhau phục vụ các
tính toán này. Sau đây sẽ tóm tắt một số quan hệ thông dụng tồn tại hai pha lỏng và hơi.
Định luật Dalton
Định luật Dalton áp dụng cho thể hơi có đặc tính lý tưởng. Tại điều kiện áp suất không quá cao, áp
suất riêng P
i
của mỗi cấu tử chính bằng áp suất chung P nhân với phần mol của cấu tử trong hỗn hợp y
i
:
ii
PyP (3.54)
Định luật Raoult
Định luật Raoult áp dụng cho chất lỏng lý tưởng, thể hiện qua quan hệ:
i
nc
i
i
PxP
1
,
P
Px
y
ii
i
(3.55)
trong đó
x
i
- phần mol của cấu tử thứ i trong pha lỏng
y
i
- phần mol của cấu tử thứ i trong pha hơi
P
i
- áp suất hơi của cấu tử thứ i.
áp suất hơi của một cấu tử là một hàm chỉ phụ thuộc vào nhiệt độ, thường được biểu diễn dưới dạng:
)/( BTA
i
i
eP
(3.56)
Đối với chất lỏng không lý tưởng, định luật Raoult được mở rộng như sau:
iii
PxP
(3.57)
trong đó:
i
được gọi là hệ số hoạt độ trong cấu tử thứ i. Hệ số hoạt độ của một cấu tử sẽ bằng 1 khi cấu tử
đó có đặc tính lý tưởng. Các hệ số hoạt độ phụ thuộc vào thành phần và nhiệt độ.
Độ bay hơi tương đối
Trong một chất lỏng, độ bay hơi tương đối của cấu tử thứ i so với cấu tử j được định nghĩa là:
jj
ii
ij
xy
xy
/
/
(3.58)
Độ bay hơi tương đối là một tham số ít thay đổi trong nhiều quá trình, vì vậy rất hay được sử dụng. Ví dụ
đối với quá trình hai cấu tử, ta có độ bay hơi tương đối của cấu tử dễ bay hơi so với cấu tử khó bay hơi là:
)1/)1(
/
xy
xy
(3.59)
Biết , ta dễ dàng xác định phần mol của cấu tử nhẹ trong thể hơi trong công thức
63
x
x
y
)1(1
(3.60)
Hệ số cân bằng pha lỏng – hơi (giá trị K)
Hệ số cân bằng pha lỏng – hơi hay gọi tắt là giá trị K cũng rất hay được sử dụng. Nó được định
nghĩa là phần mol của cấu tử trong pha hơi chia cho tỷ lệ mol của chính cấu tử đó trong pha lỏng:
iii
xyK /
(3.61)
Giá trị K là một hàm phụ thuộc trước hết vào nhiệt độ và thành phần, sau đó là vào áp suất.
3.4. Phân tích bậc tự do của mô hình
Khi thiết kế hệ thống nhất thiết phải kiểm tra tính nhất quán của mô hình và một số tính chất khác
của mô hình quá trình. Trên cơ sở đó ta có thể đưa ra phân tích và kiểm chứng sự lựa chọn các biến điều
khiển và các biến được điều khiển thực.
3.4.1. Bậc tự do của hệ thống
Trong một số mô hình quá trình các biến không thể điều khiển độc lập được mà sự điều khiển các
biến ràng buộc lẫn nhau. Ví dụ áp suất, nhiệt độ và tốc độ bay hơi cảu nồi hơi là các đại lượng có quan hệ
ràng buộc với nhau, không thể điều khiển hoàn toàn độc lập theo ý muốn.
Số bậc tự do của hệ thống được hiểu là số lượng tối đa các vòng điều khiển đơn tác động độc lập
có thể sử dụng, hay nói cách khác là số lượng tối đa biến đầu vào có thể can thiệp độc lập để tác động tới
đầu ra. Xác định số bậc tự do của mô hình cho phép đánh giá tính nhất quán, tính điều khiển được và mô
phỏng được của mô hình.
Về mặt toán học, số lượng biến tự do của hệ thống được định nghĩa:
N
f
= N
v
– N
e
(3.62)
N
v
– Số lượng biến quá trình mô tả hệ thống và N
e
– số lượng mối quan hệ độc lập giữa các biến. Trước
hết, ta hãy xét sự liên hệ giữa số bậc tự do với khả năng giải được cũng như mô phỏng được của mô hình.
Về nguyên tắc số lượng phương trình trong một mô hình phải đúng bằng số biến phụ thuộc nếu chúng ta
muốn có nghiệm xác định, ngược lại số biến cần tìm nhiều hơn số phương trình sẽ dẫn đến vô số nghiệm.
Như vậy số bậc tự do của mô hình phải đúng bằng số biến tự do (số biến đầu vào) mới đảm bảo tính nhất
quán của mô hình. Muốn giải được (mô phỏng được) các biến đầu vào phải được biết.
Tiếp theo ta bàn đến sự liên quan giữa bậc tự do của mô hình quá trình với số biến có khả năng
điều khiển được một cách độc lập. Về nguyên tắc để điều khiển được n biến ra một cách độc lập là phải
có ít nhất n biến điều khiển. Khi một mô hình quá trình đã đảm bảo tính chất nhất quán số biến đầu vào
đúng bằng số bậc tự do và cần được phân biệt thành các biến điều khiển và biến nhiễu. Như vậy, số bậc tự
do của mô hình trừ đi số biến nhiễu phải bằng hoặc lớn hơn số biến điều khiển cần thiết. Số lượng vòng
điều khiển phản hồi tối đa có thể xây dựng được khi số biến điều khiển bằng số bậc tự do.