Phương Pháp, Kỹ Thuật Giải Toán Hóa Học HYDROCACBON phần 2 pdf
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (225.15 KB, 8 trang )
29
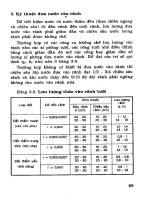
R
ư
ợ
u
600
o
C, cacbon hoaït tính
n
CHCH
2
OCOCH
3
n
CH
2
=CHOCOCH
3
xt,t
o
,p
Ví dụ 3: Đề bài không cho điều kiện phản ứng, chỉ cho biết duy nhất CTPT của một chất
+ Bổ túc chuỗi phản ứng sau :
A ® D + F
D ® F + C
F + Br
2
® G
G + KOH ® J + …+…
J ® B (tam hợp)
B + Cl
2
® C
6
H
6
Cl
6
J + C ® D
2J ® X
X + C ® E
GIẢI :
Nhận xét : giữa các phản ứng đều có mối liên hệ với nhau, mỗi chữ cái ứng với một
chất nhất định và các chất không trùng nhau.
Ở bài này, từ phản ứng tạo 666, ta tìm được B, dựa vào các dấu hiệu khác, suy luận tìm ra
các chất còn lại
Phân tích đề :
B + Cl
2
® C
6
H
6
Cl
6
Þ B : C
6
H
6
J ® B Þ J : C
2
H
2
F + Br
2
® G Þ G có hai nguyên tử Brom trong phân tử.
Mà G + KOH ® C
2
H
2
(J) Þ G : C
2
H
4
Br
2
Þ F : C
2
H
4
C
2
H
2
(J) + C®D Þ C : H
2
và D : C
2
H
6
(D không thể là C
2
H
4
được vì trùng F)
D®C
2
H
4
(F) + C
A ® D(C
2
H
6
) + F(C
2
H
4
) Þ A : C
4
H
10
Vậy A : C
4
H
10
; C:H
2
; D:C
2
H
6
; F : C
2
H
4
; G:C
2
H
4
Br
2
; J:C
2
H
2
Ptpứ :
C
4
H
10
¾¾¾®¾
o
tCracking ,
C
2
H
6
+ C
2
H
4
C
2
H
6
¾®¾
o
t
C
2
H
4
+ H
2
C
2
H
4
+ Br
2
® C
2
H
4
Br
2
C
2
H
4
Br
2
+ 2KOH ¾®¾ C
2
H
2
+ 2KBr + 2 H
2
O
3C
2
H
2
C
6
H
6
C
6
H
6
+ 3Cl
2
® C
6
H
6
Cl
6
C
2
H
2
+ 2H
2
¾¾®¾
CtNi,
o
C
2
H
6
30
Vớ d 4 :
Vit s phn ng tng hp PVC t ỏ vụi v than ỏ.
GII :
S :
CaCO
3
CaO
CaC
2
C
2
H
2
C
2
H
3
Cl
CH
2
CH
Cl
n
1000
o
C
+ C
loứ ủieọn
+ H
2
O
+ HCl
truứng hụùp
v Bi tp tng t :
Hon thnh cỏc chui phn ng sau. Ghi y iu kin phn ng :
1)
Rửụùu butylic
(1)
Butilen
Butan
Metanaxetilen
PE
Etilen glicol
Etilen
(2)(3)
(4)
(5)
(6)
(7)
2)
C
2
H
4
C
2
H
5
OHC
2
H
4
Etyl Clorua
Etilen glico
l
PE
(1)
(2)
(3)
(4)
(5)
3)
CH
3
COONa
Al
4
C
3
C
3
H
8
C
CH
4
CO
2
CH
3
Cl
(1)
(2)
(3)
(4)
(5)
(6)
C
2
H
2
4)
Ankan A
B
xt,t
o
D
E
PP
cao su Isopre
n
CCH
2
CH
3
CH
3
n
5)
ỏ vụiđvụi sngđcanxicacbuađaxetilenđvinyl axetilenđDivinylđcaosu Buna
6*)
31
C
x
H
y
(A)
A
1
B
1
A
2
A
3
TNT
B
2
B
3
Etyle
n
Đáp án : A: CH
4
; A
1
:C
2
H
2
; A
2
:C
6
H
6
; A
3
: C
6
H
5
CH
3
;
B
1
:C
2
H
6
; B
2
: C
2
H
5
Cl; B
3
: C
2
H
5
OH
7*)
CxHy(X)
X
1
X
2
cao su Buna
X
4
(
1
)
(2)
+ X
3
(3)
(
4
)
(5)
C
2
H
5
OH
X
4
(6)
(7)
Đáp án : X:C
2
H
2
; X
1
:C
4
H
4
(vinyl axetilen); X
2
: C
4
H
6
(Butadien-1,3) ; X
3
: C
6
H
5
CH=CH
2
; X
4
:
C
2
H
4
; X
5
: C
2
H
5
OH
8*)
+H
2
H
2
Oxt
Buna S
BunaN
A
6
A
5
A
4
A
3
A
2A
1
A
t
o
Biết A và A
3
có cùng số C.
Đáp án : A:C
4
H
10
; A
1
:C
2
H
4
; A
2
: C
2
H
5
OH; A
3
:C
4
H
6
(Divinyl); A
5
:C
4
H
8
; A
6
:CH
3
-
CH(OH)-CH
3
9*)
Từ khí thiên nhiên viết phương trình phản ứng điều chế caosu Isopren, cao su
Cloropren, Caosu Buna N, CCl
4
. Cho các chất vô cơ và điều kiện thí nghiệm coi như đủ.
10) Viết phương trình phản ứng tổng hợp tổng hợp caosu từ chất đầu là isopentan. Các
điều kiện phản ứng và các chất vô cơ coi như đủ.
11) Viết phương trình phản ứng điều chế C
2
H
5
OH từ khí cracking.
32
II.1.3 TÁCH – TINH CHẾ
II.1.3.1 Tách các hydrocacbon :
v Ngun tắc :
Tách rời là tách riêng tất cả ngun chất ra khỏi hỗn hợp bằng cách tách dần từng
chất một. Thí nghiệm này khó, đòi hỏi phải chọn hố chất thích hợp để tách và hồn
ngun lại chất đó.
Sơ đồ :
A,B
A (nguyên chất)
BX
+ X
+ Y
B (nguyên chất)
XY (loại bỏ)
v Phương pháp:
* Phương pháp vật lý :
- Phương pháp chưng cất để tách rời các chất lỏng hòa lẫn vào nhau, có thể dùng
phương pháp chưng cất rồi ngưng tụ thu hồi hóa chất.
- Phương pháp chiết (dùng phễu chiết) để tách riêng những chất hữu cơ tan được
trong nước với các chất hữu cơ khơng tan trong nước (do chất lỏng sẽ phân thành 2 lớp)
- Phương pháp lọc (dùng phễu lọc) để tách các chất khơng tan ra khỏi dd.
* Phương pháp hóa học :
- Chọn những phản ứng hóa học thích hợp cho từng chất để lần lượt tách riêng các
chất ra khỏi hỗn hợp, đồng thời chỉ dùng những phản ứng hóa học mà sau phản ứng dễ
dàng tái tạo lại các chất ban đầu.
- Một số phản ứng tách và tái tạo:
Hidrocacbon
Phản ứng để tách Phản ứng tái tạo Phương pháp thu hồi
Anken
cc
R-CH=CH
2
+ Br
2
®
R-CHBr-CH
2
Br
R-CHBr-CH
2
Br
¾¾®¾
C
o
tZn,
R-CH=CH
2
Thu lấy khí anken
bay ra (hoặc chiết
lấy anken lỏng phân
lớp)
Etilen
CH
2
=CH
2
CH
2
=CH
2
+ H
2
SO
4
®CH
3
–CH
2
OSO
3
H
CH
3
–CH
2
OSO
3
H
¾¾®¾
C
o
tZn,
CH
2
=CH
2
+H
2
SO
4
33
Ankin-1 v
axetilen
R-C
CH
2R-C
CH +
Ag
2
O ắắắđắ
C
o
3
t,NH
2R-C
CAg + 2H
2
O
RCCAg + HCl
đ
RCCH + AgCl
Lc b kt ta thu
hi ankin lng hoc
thu ly ankin khớ.
Benzen v
cỏc ng
ng ca
benzen
Khụng tan trong
nc v trong cỏc dd
khỏc nờn dựng
phng phỏp chit
tỏch.
- Nu cú anken v ankin thỡ tỏch ankin trc bng dd AgNO
3
/NH
3
vỡ ankin cng cho
phn ng cng vi dd Br
2
nh anken.
v Bi tp vớ d :
Tỏch riờng tng khớ ra khi hn hp khớ gm CH
4
, C
2
H
4
, C
2
H
2
v CO
2
.
GII :
Nhn xột: CO
2
tan trong dd nc vụi trong, CH
4
, C
2
H
4
, C
2
H
2
thỡ khụng, nờn dựng cỏc phn
ng bng trờn tỏch:
S tỏch
CH
4
C
2
H
2
C
2
H
4
CO
2
Dd Ca(OH)
2
CaCO
3
CH
4
C
2
H
4
C
2
H
2
Dd AgNO
3
/NH
3
AgC
CAg
(vaứng)
CH
4
C
2
H
4
Dd Brom
C
2
H
4
Br
2
Zn
C
2
H
4
t
o
CH
4
t
o
CO
2
HCl
C
2
H
2
Li gii v phng trỡnh phn ng:
ã Dn hn hp khớ qua dd Ca(OH)
2
d, thu c CaCO
3
CO
2
+ Ca(OH)
2
đ CaCO
3
+ H
2
O
ã Thoỏt ra ngoi l hn hp khớ CH
4
, C
2
H
4
, C
2
H
2
c dn qua dd AgNO
3
/NH
3
thỡ
C
2
H
2
b gi li trong C
2
Ag
2
, cỏc khớ CH
4
, C
2
H
4
thoỏt ra
C
2
H
2
+ 2AgNO
3
(dd) + 2NH
3
đ C
2
Ag
2
+ 2NH
4
NO
3
ã Tip tc dn hn hp khớ CH
4
, C
2
H
4
qua dd nc Br thỡ C
2
H
4
b gi li, CH
4
thoỏt
ra ta thu c CH
4
C
2
H
4
+ Br
2
đ C
2
H
4
Br
2
ã Tỏi to CO
2
bng cỏch nhit phõn kt ta CaCO
3
ã Tỏi to C
2
H
2
bng cỏch cho kt ta C
2
Ag
2
tỏc dng vi dd HCl
C
2
Ag
2
+ 2HCl đ C
2
H
2
- + 2AgCl
ã Tỏi to C
2
H
4
bng cỏch cho cht lng C
2
H
4
Br
2
tỏc dng vi Zn/ru:
34
C
2
H
4
Br
2
rửụùu
C
2
H
4
+ ZnBr
2
+ Zn
v Bi tp tng t :
Tỏch ri cỏc khớ sau ra khi hn hp gm :
a) Benzen, styren, phenol
b) NH
3
, butin-1, butadien v butan
c) Khớ HCl, butin-1 v butan
II.1.3.2 Tinh ch :
v Nguyờn tc : Tinh ch l lm sch húa cht nguyờn cht no ú bng cỏch loi
b i tp cht ra khi hn hp (nguyờn cht v tp cht).
v Phng phỏp : Dựng húa cht tỏc dng vi tp cht m khụng phn ng vi
nguyờn cht to ra cht tan hoc to ra cht kt ta lc b i.
S tinh ch :
A,B
A(nguyeõn chaỏt)
BX (loaùi boỷ)
+X
Trong ú X l húa cht ta phi chn tỏc dng vi B loi B ra khi hn hp.
v Bi tp vớ d :
Cỏc phng trỡnh phn ng u l nhng phng trỡnh phn ng quen thuc ó gp trờn.
Do ú phn hng dn gii ch a ra cỏc s tinh ch.
Vớ d 1 :
Tinh ch (lm sch) Propilen cú ln propin, propan v khớ sunfur
GII :
Lu ý : SO
2
v C
3
H
6
u lm cho phn ng vi dd Brom nờn phi tỏch SO
2
trc ri mi
dựng dd Brom tỏch ly C
3
H
6
ra khi hn hp ri tinh ch.
S tinh ch
ddAgNO
3
/NH
3
C
3
H
6
C
3
H
4
C
3
H
8
SO
2
C
3
H
6
,C
3
H
8
SO
2
CH
3
C
2
Ag
dd Ca(OH)
2
CaSO
3
C
3
H
6
C
3
H
8
ddBr
2
C
3
H
8
C
3
H
6
Br
2
Zn
C
3
H
6
Vớ d 2:
35
Tinh chế C
6
H
6
có lẫn C
6
H
12
, C
6
H
5
CH
3
GIẢI :
Sơ đồ :
ddBr
2
C
6
H
6
C
6
H
12
C
6
H
5
CH
3
C
6
H
12
Br
2
C
6
H
6
C
6
H
5
CH
3
DdKMnO
4
C
6
H
6
C
6
H
5
COOH
Ví dụ 3:
Tinh chế Styren có lẫn benzen, toluen, hexin-1.
GIẢI :
Sơ đồ :
C
8
H
8
Zn
C
8
H
8
Br
2
C
6
H
6
C
6
H
5
CH
3
ddBr
2
C
6
H
5
CCAg
C
8
H
8
,C
6
H
6
C
6
H
5
CH
3
ddAgNO
3
/NH
3
C
8
H
8
C
6
H
6
C
6
H
5
CH
3
C
5
H
11
CCH
v Bài tập tương tự :
1) Tinh chế C
3
H
8
lẫn NO
2
và H
2
S, hơi nước
2) Tinh chế C
2
H
6
lẫn NO, NH
3
, CO
2
3) Làm sạch etan có lẫn etilen và làm sạch etilen có lẫn etan.
4) Làm sạch etan có lẫn axetilen và ngược lại
5) Làm sạch etilen có lẫn axetilen và ngược lại.
36
II.1.4 NHẬN BIẾT – PHÂN BIỆT
v Phương pháp:
Tổng quát:
- Làm thí nghiệm với các mẫu thử
+ Chỉ dùng những phản ứng đặc trưng của hidrocacbon để nhận biết
+ Các phản ứng dùng để nhận biết phải đơn giản, dễ thực hiện và dấu hiệu phản ứng
quan sát được (màu sắc, ¯, sủi bọt khí, …)
- Khi có cả chất hữu cơ và vô cơ nên phân biết chất vô cơ trước, nếu được.
Cách nhận biết vài chất khí vô cơ quen thuộc:
· CO
2
, SO
2
: làm đục nước vôi trong nhưng SO
2
tạo kết tủa vàng khi sục vào dd H
2
S
hoặc làm mất màu nâu đỏ của dd nước Brom.
2H
2
S + SO
2
¾®¾ 3S¯(vàng) + H
2
O
SO
2
+ Br
2
+ H
2
O ¾®¾ 2HBr + H
2
SO
4
· H
2
O (hơi) : đổi màu trắng của CuSO
4
khan thành xanh
· N
2
, khí trơ : không cháy
· NH
3
: làm xanh màu quì tím ẩm hoặc tạo khói trắng (NH
4
Cl) với khí HCl
· HCl (khí) : làm quì tím ẩm hóa đỏ hoặc tạo khói trắng với NH
3
(khí)
· HCl (dd) : làm đỏ quì tím , sủi bọt CO
2
với CaCO
3
.
· NO : chuyển thành nâu khi gặp không khí (NO + ½ O
2
® NO
2
-)
Đỏ nâu
· NO
2
: khí màu nâu đỏ
· H
2
: cho qua CuO nung nóng, CuO chuyển từ màu đen sang màu đỏ.
CuO + H
2
¾®¾ Cu + H
2
O
(đen) (đỏ)
· CO : cho lội qua dd PdCl
2
, sản phẩm khí thu được cho sục vào dd nước vôi trong
dư thì nước vôi trong bị đục.
CO + PdCl
2
+ H
2
O ¾®¾ CO
2
+ Pd + 2HCl
CO
2
+ Ca(OH)
2
¾®¾ CaCO
3
¯ + H
2
O
Thứ tự tương đối để nhận biết các hydrocacbon
Hidrocacbon Thuốc thử Dấu hiệu Phương trình phản
ứng
Ankin đầu mạch dd AgNO
3
/NH
3
¯vàng nhạt CHºCH + 2AgNO
3
+ 2NH
3
®
AgCºCAg¯ +