Bài giảng chế biến khí : QUÁ TRÌNH NITRO HÓA part 1 ppt
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (149.3 KB, 5 trang )
CHƯƠNG VI: QUÁ TRÌNH NITRO HÓA
§1. NHỮNG ĐẶC TRƯNG VỀ QUÁ TRÌNH NITRO HÓA
- Định nghĩa: Quá trình nitro hóa là quá trình đưa một hoặc nhiều nhóm -NO
2
vào
trong các hợp chất trung gian. Đây là một trong những quá trình cơ bản trong
CNTHHC và HD vì cho sản phẩm có nhiều ứng dụng: sản xuất thuốc nổ, sản xuất
nước hoa, sản xuất sơn và vecni, các dung môi, các hợp chất amin.
- Phân loại: tùy thuộc vào việc gắn nhóm -NO
2
ở nguyên tử C, N, O phân thành các
quá trình: + C nitro hóa
+ O nitro hóa
+ N nitro hóa
Trong 3 dạng này thì C nitro hóa được quan tâm nhiều nhất và được chia thành:
+ nitro hóa các hydrocacbon thơm
+ nitro hóa các hydrocacbon mạch thẳng
- Quá trình này có thể tiến hành trong pha lỏng hoặc pha khí với tác nhân nitro hóa
thường dùng là HNO
3
hoặc N
2
O
5
(pentoxit dinitơ) hoặc N
2
O
4
(teroxit dinitơ)
- Các phương pháp thực hiện quá trình C nitro hóa :
+ thế 1 nguyên tử H bằng 1 nhóm -NO
2
+ thế 1 nhóm chất nào đó trên nhân thơm bằng 1 nhóm -NO
2
+ cộng nhóm -NO
2
vào nối đôi
→ trong đó phương pháp thứ nhất là phổ biến nhất
- Cơ chế: Quá trình nitro hóa có thể xảy ra theo cơ chế gốc (O
2
N
+
) hoặc ion (O
2
N
*
) tùy
thuộc vào điều kiện phản ứng:
1. Khi nitro hóa hydrocacbon thơm, dưới tác động của xúc tác, phản ứng xảy ra
theo cơ chế cation
Xúc tác : có 2 loại
+ xúc tác có proton HA: H
2
SO
4
, H
3
PO
4
; trong đó a. H
2
SO
4
là phổ biến nhất
+ xúc tác không proton: BF
3
→ xúc tác Lewis
1
F
H - O - NO
2
+ BF
3
HO - B
-
- F + O
2
N
+
F
1.1. Trường hợp tác nhân nitro hóa là HNO
3
- Xúc tác HA
- Xúc tác Lewis
- Sau đó ion O
2
N
+
sẽ tấn công vào nhân thơm
1.2. Trường hợp tác nhân nitro hóa là N
2
O
4
N
2
O
4
là dạng dime của NO
2
NO
2
ở điều kiện thường là chất khí, khi hạ nhiệt độ thì dime hóa tạo N
2
O
4
Khi có mặt của xúc tác acid H
2
SO
4
quá trình xảy ra theo cơ chế sau:
O
2
N - NO
2
↔ O
2
N
+
+ O
2
N
-
O
2
N
-
+ H
2
SO
4
↔ HNO
2
+ HSO
4
-
HO - NO + H
2
SO
4
↔ ON
+
+ H
2
O + HSO
4
-
H
2
O + H
2
SO
4
↔ H
3
O
+
+ HSO
4
-
N
2
O
4
+ 3H
2
SO
4
↔ O
2
N
+
+ ON
+
+ H
3
O
+
+ 3 HSO
4
-
→
Vậy cứ một phân tử N
2
O
4
thì tạo ra một gốc O
2
N
+
1.3. Trường hợp tác nhân nitro hóa là N
2
O
5
Khi có mặt của xúc tác acid H
2
SO
4
quá trình xảy ra theo cơ chế sau:
2
+ O
2
N
+
+
+
H
NO
2
NO
2
+ H
+
HA H
+
+ A
-
H - O - NO
2
+ H
+
H - O
+
- NO
2
(nhanh)
H
H - O
+
- NO
2
H
2
O + O
2
N
+
H
tự phân hủy
O
2
N - O - NO
2
↔ O
2
N
+
+ O
3
N
-
O
3
N
-
+ H
2
SO
4
↔ HNO
3
+ HSO
4
-
HO - NO
2
+ H
2
SO
4
↔ O
2
N
+
+ H
2
O + HSO
4
-
H
2
O + H
2
SO
4
↔ H
3
O
+
+ HSO
4
-
N
2
O
5
+ 3H
2
SO
4
↔ 2 O
2
N
+
+ H
3
O
+
+ 3 HSO
4
-
→ Vậy cứ một phân tử N
2
O
5
thì tạo ra hai gốc O
2
N
+
→ Khi dùng N
2
O
5
thì hiệu quả hơn dùng N
2
O
4
* Tương tự như phản ứng thế Clo, do ảnh hưởng của nhóm -NO
2
trong nhân
thơm rất lớn nên vận tốc của các giai đoạn nitro hóa tiếp theo giảm đi rõ rệt so với các
giai đoạn trước.
2. Khi nitro hóa hydrocacbon parafin, dưới tác động của nhiệt hoặc chất khơi
mào, phản ứng xảy ra theo cơ chế gốc tự do
3
HONO
2
HO
*
+ NO
2
*
HO
*
+ RH R
*
+ H
2
O
hay NO
2
*
+ RH R
*
+ HNO
2
R
*
+ NO
2
*
RNO
2
phân rã
NO
2
§2. CÁC QUÁ TRÌNH NITRO HÓA THEO NGUYÊN TỬ CACBON
I. Nitro hóa các hydrocacbon thơm
- Nitro hóa các hydrocacbon thơm (Ar) là quá trình thế 1 nguyên tử H trên nhân thơm
bằng một nhóm NO
2
+
. Quá trình này thường xảy ra trong pha lỏng ở nhiệt độ cao với
tác nhân nitro hóa là HNO
3
, N
2
O
4
, N
2
O
5
với sự có mặt của H
2
SO
4
.
Phương trình phản ứng: ArH + HNO
3
↔ ArNO
2
+ H
2
O
- Trong các hydrocacbon thơm được dùng trong công nghiệp thì Benzen, Toluen,
Naphtalen được dùng nhiều nhất vì sản phẩm của chúng có nhiều ứng dụng trong công
nghiệp để sản xuất các hợp chất amin, chất nổ, chất màu
Sau đây là một số quá trình nitro hóa hydrocacbon thơm.
1. Sản xuất nitrobenzen
- ở điều kiện thường: là một chất lỏng màu vàng nhạt có t
s
= 210,9
o
C, t
nc
= 5,7
o
C;
- độc ; được dùng làm dung môi và trong sản xuất anilin
- tác nhân nitro hóa là hỗn hợp sulfonitro hoặc chỉ dùng HNO
3
có nồng độ cao
1.1. Nitro hóa benzen bằng hỗn hợp Sulfonitro
- Quá trình này thường thực hiện theo phương thức gián đoạn
- Hỗn hợp sulfonitro có thành phần như sau: HNO
3
= 32 ÷ 39%
H
2
SO
4
= 53 ÷ 60%
H
2
O ≈ 8%
Tỷ lệ tối ưu: H
2
SO
4
: HNO
3
: H
2
O = 53 : 35 : 12
- Tỷ lệ Sulfonitro : Benzen = 2 ÷ 2,5 (sao cho đảm bảo HNO
3
: C
6
H
6
≈ 0,8)
- nhiệt độ : gồm 2 chế độ chia theo 2 giai đoạn
+ giai đoạn1: t = 50 ÷ 55
o
C ; τ = 2 ÷ 3h
+ giai đoạn 2: nhiệt độ cao hơn, khoảng 90
o
C
4
1.2. Nitro hóa benzen bằng HNO
3
đậm đặc: Đây là quá trình liên tục chỉ dùng a.
HNO
3
đậm đặc có nồng độ 60 ÷ 65%. TBPƯ là tháp chóp.
5
tác nhân
đun nóng
tác nhân
lạnh
hơi
nước
cặn acid
H
2
O
Sulfonitro
C
6
H
6
2
3
4
5
6
7
8
1
H
2
O
xút
cặn
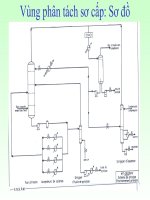
Hình 1: Sơ đồ công nghệ nitro hóa Benzen bằng hỗn hợp Sulfonitro
1. thiết bị nitro hóa 5. thùng chứa
2. thiết bị lắng gạn 6. tháp chưng
3. bể chứa nitrobenzen thô 7. thiết bị ngưng tụ hồi lưu
4. thiết bị rửa 8. bể chứa nitrobenzen sạch