Bài giảng chế biến khí : QUÁ TRÌNH HALOGEN HÓA part 5 pdf
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (785.18 KB, 5 trang )
CH
2
= CH
2
+ Cl
2
CH
2
= CH
2
H
2
C - Cl H
2
C - CH
2
Cl → Cl H
2
C
+
Cl Cl
phức π phức σ
+ FeCl
3
- FeCl
4
-
+ FeCl
4-
- FeCl
3
2. CLO HÓA OLEFIN: chia làm 2 quá trình
- cộng Cl vào nối đôi (Cl
2
, HCl, HOCl): → phổ biến
- thế H trên nguyên tử C no hoặc không no bằng nguyên tử Cl trong pha khí
2.1. Cộng vào nối đôi
• Cộng Cl
2
:
Phản ứng cộng Cl
2
vào nối đôi có thể tiến hành trong pha khí hoặc pha lỏng
o pha khí: cơ chế chuỗi gốc ở nhiệt độ cao
Cl
*
+ C = C → Cl - C - C
*
Cl - C - C
*
+ Cl
2
→ Cl - C - C - Cl + Cl
*
o pha lỏng: cơ chế cộng ái điện tử với sự tạo thành phức π và σ trung gian
dưới tác dụng của xúc tác acid không proton (FeCl
3
, AlCl
3
) đồng thời xúc
tác này vừa làm dung môi cho quá trình
Trong 2 quá trình này quá trình pha lỏng được ứng dụng nhiều trong công nghiệp.
Phản ứng :
Nguyên tắc clo hóa pha lỏng: sục chất phản ứng dạng khí cũng như khí Cl
2
loãng đã sấy khô qua sản phẩm lỏng; phản ứng xảy ra trong pha lỏng ở 70 ÷ 100
o
C.
• Cộng bằng HOCl: phản ứng này được gọi là phản ứng clohydrin
21
Cl
2
+ H
2
O → HClO + HCl
HClO + H
+
→ H
2
O Cl
+
Cl - CH
2
- CH
2
+
CH
2
- CH
2
(cation hydrat của Cl) phức σ Cl OH
etylen clohydrin
+ CH
2
=
CH
2
+ H
2
O
- H
+
CH
2
= CH
2
CH
2
= CH
2
CH
3
- CH
2
+
CH
3
- CH
2
Cl
↓
HCl
phức π phức σ
+HC
l
2
+ MCl
3
- MCl
4
-
+
MCl
4
-
Khi thực hiện phản ứng với dung dịch nước Clo cơ chế phản ứng như sau:
Đối với đồng đẳng của etylen và những dẫn xuất của chúng, khi tham gia phản
ứng cộng hợp HClO thì nguyên tử Cl sẽ đính với nguyên tử C dễ hidro hóa nhất.
Chẳng hạn: CH
3
- CH = CH
3
+ Cl
2
+ H
2
O → CH
3
- CHOH - CH
3
Cl
1 - clopropanol - 2
• Cộng bằng HCl
- Phản ứng cộng HCl vào olefin được thực hiện khi có tác động của xúc tác
Phản ứng: CH
2
= CH
2
+ HCl → CH
3
- CH
2
Cl
Xúc tác là các acid không proton thường là FeCl
3
hoặc AlCl
3
Phản ứng thực hiện theo cơ chế ái điện tử:
- Đối với những đồng đẳng của etylen và những dẫn xuất của chúng, khi tham gia
phản ứng cộng HCl thì tuân theo qui tắc Maccopnhicop
Chẳng hạn: R - CH = CH
2
+ HCl → R - CHCl - CH
3
2.2. Các sản phẩm của phản ứng cộng Clo vào olefin
2.2.1. Vinyl clorua (VCM): t
s
= -13,4
o
C ; t
nc
= -153,8
o
C ; d
4
20
= 0,9834
Sản lượng VCM trên thế giới được sản xuất từ 1,2-DCE là chủ yếu, một
phần nhỏ đi từ C
2
H
2
.
2.2.2. Dicloetan (1,2 - DCE): t
s
= 83,5
o
C ; t
nc
= -35,3
o
C ; d
4
20
= 1,253
Ứng dụng:
22
CH
2
= CH
2
CH
2
= CH
2
Cl - CH
2
- CH
2
+
CH
2
- CH
2
↓ Cl OH
Cl → Cl
phức π phức σ etylen clohydrin
+ H
2
O
- H
+
+ Cl
2
-
- Cl
+
-
- khoảng 85% : sản xuất VCM
- 10% : sản xuất dung môi chứa Clo như 1,1,1- triclo etan
- Còn lại:
+ sản xuất etylen diamin
→ dùng làm chất ức chế ăn mòn acid
→ điều chế etylen diamin tetra acetic acid (EDTA) : chất tạo phức
vòng càng (chelat)
+ sản xuất cao su chịu xăng dầu: polysulfit → có mùi, không lão hóa
n CH
2
Cl - CH
2
Cl + n Na
2
SO
4
→ (-CH
2
- CH
2
- S
4
-)
n
+ 2n NaCl
+ dùng làm chất dẫn Pb trong xăng có nước Pb
2.3. Các phương pháp sản xuất VCM
Các phương pháp sản xuất VCM hiện nay có hoặc không thông qua giai
đoạn tạo thành DCE gồm 5 quá trình chính sau:
- Hydroclo hóa: cộng acid HCl vào C
2
H
2
- Clo hóa: cộng Cl
2
vào C
2
H
4
và crackinh DCE
- Kết hợp hydroclo hóa và clo hóa với nguyên liệu là C
2
H
2
và C
2
H
4
- Oxyclo hóa C
2
H
4
- Kết hợp Cl
2
hóa và oxyclo hóa C
2
H
4
2.3.1. Quá trình hydroclo hóa C
2
H
2
Phản ứng: CH ≡ CH + HCl → CH
2
= CHCl ∆H
298
=-24,6 kcal/mol
- phản ứng xảy ra trong pha khí
23
+ Cl
2
(pha lỏng)
ánh sáng
t
o
+ HCl
CH
2
Cl - CH
2
Cl CH
2
= CHCl CH
3
- CHCl
2
CH
3
- CCl
3
+ HCl
CH
2
NH
2
+ 4 HO-CH
2
-CN
- 4H
2
O
HCHO + HCN
CH
2
NH
2
CH
2
- N(CH
2
CN)
2
CH
2
- N(CH
2
CN)
2
+ H
2
O
CH
2
- N(CH
2
COOH)
2
CH
2
- N(CH
2
COOH)
2
EDTA
- xúc tác: HgCl
2
trên chất mang là than hoạt tính
- thiết bị phản ứng: + loại ống chùm, xúc tác đặt trong ống, h
ô
≈ 3m; Φ
ô
≈ 5 cm
+ t
pư
= 150 ÷ 250
o
C
+ p ≈ 1,5 bar
+ có thể làm lạnh bằng dầu → sản xuất hơi nước
+ nếu sử dụng HCl khô thì có thể dùng thép Cacbon, không
cần dùng thép chống ăn mòn nhưng yêu cầu nguyên liệu phải sạch,
C
2
H
2
không chứa các hợp chất của S, P gây ăn mòn thiết bị; HCl
không chứa Cl
2
nếu không sẽ gây nổ.
- phản ứng phụ: CH
2
= CHCl + HCl → CH
3
- CHCl
2
(1,1 - DCE)
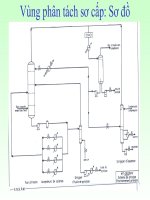
Sơ đồ công nghệ :
Hình 4: Sơ đồ công nghệ hydroclo hóa acetylen sản xuất VCM
24
Một vài thông số: + TBPƯ có H = 4m, Φ
tb
= 2m
+ Thời gian sống của xúc tác : 2000h
+ Hỗn hợp khí sau khi rửa tách hoàn toàn HCl được nén đến áp
suất 7 bars và làm lạnh để tách nước.Tại thiết bị làm lạnh này phần khí không
ngưng được tách ra và đưa qua cột hấp thụ và stripping để làm tinh khiết phần C
2
H
2
chưa chuyển hóa. Phần lỏng thu được sẽ cho qua cột stripping để tiếp tục tách nước;
sau đó VC sẽ được tinh chế bằng chưng cất ở 4 ÷ 5 bars, nhiệt độ thấp.
Công nghệ mới: Phần nặng đi ra từ tháp tinh chế VC chứa chủ yếu là 1,1-
DCE sẽ được dùng như một dung môi hấp thụ C
2
H
2
để tách khí thải, khi đó điều
kiện làm việc của tháp stripping sẽ mềm hơn.
2.3.2. Quá trình clo hóa C
2
H
4
C
2
H
4
rẻ hơn C
2
H
2
từ 2 đến 3 lần. Các quá trình gần đây đều áp dụng công
nghệ Clo hóa hay Oxyclo hóa C
2
H
4
hay áp dụng cả 2 quá trình này để sản xuất 1,2 -
DCE sau đó sẽ crackinh 1,2 - DCE để tổng hợp VC.
Phản ứng : (1) CH
2
= CH
2
+ Cl
2
→ CH
2
Cl - CH
2
Cl ∆H
298
= - 52 kcal/mol
(2) CH
2
Cl - CH
2
Cl → CH
2
= CHCl + HCl ∆H
298
= + 16 kcal/mol
+ Phản ứng (1): có thể tiến hành trong pha khí, tuy nhiên quá trình trong pha lỏng
với xúc tác clorua kim loại phổ biến hơn. Môi trường lỏng ở đây là DCE hồi lưu.
Yêu cầu đối với nguyên liệu:
- C
2
H
4
có độ sạch cao để tránh sản phẩm phụ vì các halogenua của C
3
, C
3
=
rất
khó tách khỏi VCM
- Cl
2
phải sạch và được pha loãng bằng không khí để ức chế các phản ứng
Clo hóa sâu hơn tạo ra triclo
Sơ đồ công nghệ:
25