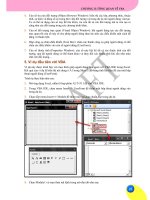
quy trình chuyển gen vào giống thuốc lá C9-1 nhằm tạo cây thuốc lá chuyển gen kháng bệnh khảm lá
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.77 MB, 48 trang )
LỜI CẢM ƠN
Tôi xin bày tỏ lòng biết ơn sâu sắc tới TS. Lê Quỳnh Liên, Phòng Công Nghệ
Tế Bào Thực Vật, Viên Công Nghệ Sinh Học đã tận tình hướng dẫn, chỉ bảo,
giúp đỡ tôi trong suốt quá trình thực hiện khóa luận này.
Tôi xin bày tỏ lòng biết ơn tới PGS.TS. Chu Hoàng Hà, ThS. Phạm Thị Vân
cùng tập thể cán bộ, học viên, sinh viên Phòng Công Nghệ Tế Bào Thực Vật,
Viện Công Nghệ Sinh Học đã tạo điều kiện làm việc, giúp đỡ và truyền đạt
nhiều kinh nghiệm làm việc quý báu trong suôt quá trình hoàn thành khóa
luận này.
Em xin chân thành cảm ơn các thầy cô giáo khoa Công Nghệ Sinh Học, Viện
Đại Học Mở Hà Nội đã nhiệt tình giảng dạy và tạo điều kiện thuận lợi cho
em học tập và nghiên cứu.
Cuối cùng, tôi xin bày tỏ lòng biết ơn sâu sắc tới gia đình và bạn bè nhứng
người đã luôn bên tôi, động viên và góp ý cho tôi trong suốt quá trình học tập
và thực hiện khóa luận.
Hà Nội, tháng 05 năm 2011
Sinh viên
Nguyễn Thị Thu Hiền
1
DANH MỤC CÁC CHỮ VIẾT TẮT
ADN Deoxyribonucleic Acid
ARN Ribonucleic Acid
Bp Base pair
dNTPs Deoxy Nucleoside Triphosphate
LB Luria and Bertani
PCR Polymerase Chain Reaction
Taq Thermus aquaticus
IAA Indolaxetic Acid
NAA α- naphthalenneacetic Acid
PVY Ptato virus
TMV Tobacco Mosaic virus
CMV Cucumber Mosaic virus
MS Môi trường cơ bản theo Murashige và Skoog
BAP 6- benzenladenine
Gus Gen mã hóa enzyme β-glucuronidase
RM Môi trường ra rễ
RNAi RNA interfence
X-gluc 5-bromo-4- chloro-3- indolyl glucuronide
EDTA Ethylene Diamine tetra- acetate Acid
2
MỞ ĐẦU
Thuốc lá là một trong những cây trồng vừa có giá trị về kinh tế vừa là cây mô
hình quan trọng trong nghiên cứu công nghệ sinh học cây trồng. Vì vậy,
thuốc lá là một trong những đối tượng được sử dụng nhiều nhất trong các
nghiên cứu cơ bản và ứng dụng đặc biệt là làm đối tượng chuyển gen.
Khảm lá bệnh rất phổ biến trên cây thuốc lá, bệnh khảm lá gây thiệt hại
nghiêm trọng đến năng suất và chất lượng thuốc lá, nhất lá đối với thuốc lá
sợi vàng. Bệnh khảm thuốc lá do hai loại virus TMV (Tobacco mosaic virus)
và CMV (Cucumber mosaic virus) gây ra. Trong đó, TMV loại virus có phổ
ký chủ rất rộng có tới 230 loài thuộc 32 họ và là một trong virus gây hại trên
thực vật được mô tả sớm nhất ở nước ta.
Những phương pháp thông dụng để khắc phục bệnh khảm lá như sử dụng
giống kháng bệnh, giống sạch bệnh và các biện pháp canh tác( trồng luận
canh cây thuốc lá với cây lúa, vệ sinh đồng ruộng ). Tuy nhiên, những biện
pháp này không những chỉ có tác dụng làm giảm bớt sự lây lan và phát triển
của bệnh, chủ yếu chỉ manh tính chất phòng trừ chứ không thể chống lại bệnh
này mà còn đòi hỏi nhiều thời gian, công sức và ảnh hưởng xấu tới môi
trường.
Hiện nay, nhờ những tiến bộ mới trong kỹ thuật di truyền mà người ta đã tạo
ra các giống cây trồng có khả năng kháng lại bệnh do virus gây ra bằng cách
đưa gen mã hóa protein vỏ (coat protein gene) của virus vào genome của thực
vật.
Xuất phát từ cơ sở thực tiễn trên, giống thuốc lá C9-1 đã được lựa chọn cho
nghiên cứu “ Nghiên cứu qui trình chuyển gen vào giống thuốc lá C9-1 nhằm
tạo cây thuốc lá chuyển gen kháng bệnh khảm lá” với các nội dung và mục
đích nghiên cứu: (1) Chuẩn hóa phương pháp chuyển gen vào giống thuốc lá
C9-1 thông qua cấu trúc mang chỉ thị gus; (2) Tạo cây thuốc lá chuyển gen
mang cấu trúc TMV-RNAi; (3) Bước đầu phân tích cây chuyển gen bằng
phương pháp PCR
3
Chương I: TỔNG QUAN TÀI LIỆU
1.1. GIỚI THIỆU CHUNG VỀ CÂY THUỐC LÁ
1.1.1. Phân loại
Cây thuốc lá có tên khoa học là: Nicotinana.sp thuộc ngành hạt kín
Angiosper, lớp 2 lá mầm Dicotylndones, phân lớp Asteridae, bộ hoa mõm sói
Scrophulariales, họ cà Solanaceae, chi Nicotiana. Trong chi Nicotiana có 50-
70 loài, đa số là dạng cỏ, một số dạng thân đứng, hầu hết là các dạng dại phụ.
Căn cứ vào hình thái, màu sắc của hoa người ta phân chia thành 4 loại chính:
- Loài Nicotiana tabacum L.: có hoa màu hồng hay đỏ tươi. Đây là loại
phổ biến nhất chiếm 90% diện tích thuốc lá trên thế giới.
- Loài Nicotiana rustica L.: có hoa màu vàng, chiếm 10% diện tích thuốc
lá trên thế giới.
- Loài Nicotiana petunioide L.: có hoa màu trắng, phớt hồng hay tím.
Thường chỉ có trong vườn thực vật phục vụ nguồn dự trữ gen cho lai
tạo, ít được dùng trong sản xuất.
- Loài Nicotiana polidiede L. : có hoa màu trắng. Loài này cũng ít được
dùng trong sản xuất, chủ yếu chỉ có trong vườn thực vật học của một số
quốc gia.
4
Hình 1.1: Cây thuốc lá (Nicotiana tabacum L.)
Trên thế giới cây thuốc lá được trồng chủ yếu ở Châu Á với diện tích
canh tác khoảng 2.500.000ha, Châu Mĩ là 1.600.000ha và Châu Phi
khoảng 326.000ha với nhiều loại thuốc lá khác nhau trong đó giống thuốc
lá sợi vàng phổ biến nhất.Vùng trồng thuốc lá cho chất lượng cao tập trung
chủ yếu ở một số bang của nước Mĩ, Cu Ba, Ấn Độ.Tại Việt Namcây
thuốc lá được canh tác từ Bắc chí Nam, chủ yếu ở các tỉnh sau: Cao Bằng
và Lạng Sơn (khu vực phía Bắc), Đà Nẵng, Gia Lai và Dak Lak (khu vực
miền Trung), Ninh Thuận (khu vực Tây nguyên) và Tây Ninh (khu vực
phía Nam).
1.1.2. Giá trị của cây thuốc lá
Thuốc lá (Nicotiana tabacum L.) là loại cây công nghiệp ngắn ngày có
tầm quan trọng bậc nhất về kinh tế trên thị trường thế giới không chỉ đối với
trên 33 triệu nông dân của trên 120 quốc gia, mà còn cho cả toàn bộ nền công
nghiệp - từ các nhà máy chế biến, cuốn điếu, sản xuất phụ gia, phụ liệu đến cả
hệ thống phân phối tiêu thụ, thậm chí cả một phần ngành sản xuất các vật tư
5
nông nghiệp phục vụ cho cây thuốc lá như phân bón, thuốc bảo vệ thực vật
[10], [15].Trồng thuốc lá có hiệu quả cao hơn nhiều so với các loại cây trồng
khác (1000- 1200 USD/ tấn lá khô) [8]. Các hãng sản xuất thuốc lá của các
nước tư bản đều nhận được nguồn lợi nhuận khổng lồ từ cây thuốc lá.
Ở nước ta, cây thuốc lá cũng mang lại giá trị kinh tế cao, sử dụng hiệu quả đất
đai, góp phần tạo công ăn việc làm, tận dụng được nguồn lao động của địa
phương, tăng thu nhập cho người lao động. Lợi nhuận cao từ sản xuất thuốc lá
đã sự quan tâm của nhiều cấp chính quyền trong cả nước, tại một số tỉnh miền
núi phía Bắc như Cao Bằng, Lạng Sơn, cây thuốc lá đã nằm trong cơ cấu
cây trồng truyền thống, thực sự mang lại hiệu quả kinh tế cao.
Tại An Giang nhờ vào cây thuốc lá nên giải quyết được khoảng 200 lao động
với thu nhập trung bình 30.000- 40.000 đồng/ ngày [49].
Năm 2010, Tổng công ty thuốc lá Việt Nam đạt kim ngạch xuất khẩu trên 175
triệu USD, tăng 17% so với năm 2009. Xuất siêu gần 54 triệu USD, nộp ngân
sách vượt mốc 5.000 tỉ đồng, tăng 6% so với năm 2009 [47]. Đời sống, việc
làm và thu nhập của người lao động được bảo đảm ổn định.
Đối với ngành công nghệ sinh học cây thuốc lá được sử dụng như thực vật mô
hình cho những nghiên cứu cơ bản cũng như ứng dụng nhờ khả năng dễ dàng
tiến hành nuôi cấy in vitro và chuyển gen [26].
1.1.3 . Thực trạng phát triển vùng thuốc lá nguyên liệu tại Việt Nam
Là loại cây công nghiệp ngắn ngày có giá trị kinh tế cao hiện thuốc lá được
trồng ở nhiều địa phương trong cả nước. Diện tích trồng thuốc lá năm 2008
khoảng 25.000 ha. Theo định hướng của chính phủ, dự kiến diện tích trồng
thuốc lá năm 2010 là 39.200 ha và phát triển ổn định tới năm 2020 là 40.300
ha [50]. Theo đánh giá của các chuyên gia, nguyên liệu thuốc lá vàng sấy của
6
nước ta có chất lượng tương đối tốt, có thể thay thế được nguyên liệu Trung
Quốc. Công ty TNHH Một Thành viên Viện KTKT thuốc lá là đơn vị đi đầu
trong nghiên cứu chọn tạo giống thuốc lá đã phát triển sản xuất đại trà các
giống thuốc lá K326, C9-1, K176 đồng thời sản xuất thử nghiệm thành công
một số giống lai như VTL1H, VTL5H tại vùng núi phía Bắc (theo báo cáo
Văn phòng chương trình KC06) hay khảo nghiệm một số giống như RGH04,
PVH09, PVH51 trên khu vực đất cát ở Gia Lai. Những nghiên cứu của Công
ty TNHH Một Thành viên Viện KTKT thuốc lá cho thấy sự quan tâm của
Tổng công ty thuốc lá Việt Nam trong công tác phát triển giống mới nhằm
thúc đẩy sự phát triển vùng thuốc lá nguyên liệu tại nước ta. Đặc thù của sản
xuất thuốc lá điếu là phải có sự phối trộn nhiều loại nguyên liệu thuốc lá từ
các vùng khác nhau để tạo nên tính phong phú của sản phẩm. Hàng năm,
ngành thuốc lá vẫn phải nhập khẩu một lượng đáng kể nguyên liệu từ các
nước trên thế giới và nguyên liệu trong nước cũng được xuất khẩu với số
lượng đến chục ngàn tấn. Sản xuất thuốc lá vẫn là một lĩnh vực kinh tế cần
thiết khi ngành thuốc lá Việt Nam đóng góp cho ngân sách Nhà nước trên
bảy ngàn tỷ đồng mỗi năm. Hút thuốc lá có ảnh hưởng xấu đến sức khỏe
người tiêu dùng nên nhà nước có chủ trương hạn chế sản xuất thuốc lá điếu
cho tiêu thụ nội địa. Hiện nay thuốc lá nguyên liệu sản xuất trong nước chưa
đáp ứng đủ nhu cầu cho các nhà máy thuốc điếu, mặt khác nhu cầu nguyên
liệu cho xuất khẩu khá lớn nên Chính phủ khuyến khích phát triển sản xuất
nguyên liệu trong nước. Chiến lược phát triển Ngành thuốc lá Việt nam đến
năm 2020 đã được Chính phủ phê duyệt, trong đó nhấn mạnh chủ chương
phát triển thuốc lá nguyên liệu để hạn chế nhập khẩu, tăng cường xuất khẩu,
tạo công ăn việc làm và nâng cao hiệu quả kinh tế cho nhà nông [50]. Vùng
trồng thuốc lá của Việt Nam tập trung chủ yếu tại các tỉnh miền núi, nên việc
phát triển trồng thuốc lá tại đây sẽ hiện thực hoá chủ trương của Đảng và Nhà
nước “Xóa đói, giảm nghèo” cho đồng bào các dân tộc miền núi. Chín tỉnh
trồng thuốc lá tập trung tại Việt Nam (gồm Cao Bằng, Lạng Sơn, Thái
7
Nguyên, Bắc Giang, Gia Lai, Đắc Lắc, Ninh Thuận Bình Thuận và Tây
Ninh) do tổng công ty hỗ trợ phát triển đã chiếm hơn 90% diện tích vùng
trồng thuốc lá nguyên liệu tại Việt Nam. Trong những năm qua, Tổng công
ty cũng đã không ngừng mở rộng thị trường xuất khẩu thuốc lá nguyên liệu
và thuốc điếu với giá trị kim ngạch xuất khẩu năm 2008 đạt trên 80 triệu
USD.
1.2. MỘT SỐ BỆNH THƯỜNG GẶP Ở CÂY THUỐC LÁ
1.2.1. Bệnh virus trên cây thuốc lá
Trong sản xuất nông nghiệp thiệt hại do bệnh virus gây ra là rất lớn. Đối với
cây hàng năm, sự thiệt hại thể hiện qua việc giảm năng suất hoặc gây mất
mùa toàn bộ trong vụ. Đối với cây lâu năm, cây thân gỗ bệnh virus không
những làm giảm chất lượng và năng suất ngay đối với cây bị nhiễm bệnh mà,
mà còn có nguy cơ lây lan cho các cây khỏe mạnh những năm sau [1]. Hiện
nay, có khoảng hơn 2000 loại virus thực vật đã được phát hiện và nghiên cứu,
trong số đó khoảng một nửa là những loài gây hại chính cho cây trồng. Mức
độ thiệt hại do các bệnh virus gây ra cho cây trồng là rất nghiêm trọng, có thể
lên tới 95 - 100%. Sự thiệt hại không những chỉ dừng ở mức độ suy giảm về
năng suất mà còn ảnh hưởng cả đến chất lượng sản phẩm thu hoạch [2].
Riêng đối với cây thuốc lá thiệt hại về kinh tế do virus gây ra ở thuốc lá khá
lớn lên tới hàng chục tỷ đồng [40]. Bệnh virus không những làm giảm năng
suất, chất lượng cây thuốc lá, mà còn là nguy cơ truyền bệnh cho cây khỏe
những năm sau. Mặt khác,virus không thể tiêu diệt, phòng trừ như những
bệnh vi khuẩn, nấm, mà chúng tiềm tàng tích lũy dần dần trong cây và làm
thoái hoá giống [3].
Một số loại bệnh virus trên cây thuốc lá
8
Bảng 1.1: Bệnh virus trên thuốc lá [52]
Tên bệnh Tên virus gây bệnh
Khảm linh lăng Alfalfa mosaic virus( virus khảm linh lăng)
Quăn ngọn cúc tần Beet curty top virus ( virus gây bệnh quăn ngọn cúc tần)
Ngọn cây bụi Tái tổ hợp Tobacco vein distorting virus (virus gây biến nạp gân
thuốc lá) và tobacco bushy top virus (virus ngọn cây bụi thuốc lá)
Khảm cà chua Cucumber mosaic virus (virus gây bệnh khảm dưa chuột)
Vàng hoại tử rau
diếp
Vàng hoại tử rau diếp(trong Nicotiana glutinosa)
Còi cọc cây lạc Peanut stunt virus
Bệnh hình hoa
hồng
Tái tổ hợp Tobacco vein distorting virus ( virus gây bệnh biến dạng
gân lá thuốc lá) và tobacco mottle virus( virus gây đốm thuốc lá)
Kỵ axit thuốc lá Tobacco etch virus (virus gây bệnh kỵ axit thuốc lá)
Xoăn thuốc lá Tobacco leaf curl virus (Virus gây xoăn thuốc lá)
Khảm thuốc lá Tobacco mosaic virus( virus gây bệnh khảm thuốc lá) và Satellite
tobacco mosaic virus (virus gây bệnh khảm thuốc lá vệ tinh)
Hoại tử thuốc lá Tobacco necrosis virus (virus gây hoại tử thuốc lá)
Bung hạt thuốc lá Tobacco rattele virus (virus gây bung hạt thuốc lá)
Đốm vòng thuốc
lá
Tobacco ring spot virus (virus gây bệnh đốm vòng thuốc lá)
Sọc thuốc lá Tobacco streak virus (virus gây bệnh sọc thuốc lá)
Còi cọc thuốc lá Tobacco stunt virus (virus gây bệnh còi cọc thuốc lá)
Vằn gân thuốc lá Tobacco vein mottling virus (virus gây bệnh vằn gân thuốc lá)
Héo đốm cà chua Tomato spotted wilt virus (virus gây bệnh héo đốm cà chua)
Viền gân lá Potato virus ( virus Y khoai tây)
U vết thương Wound tumor virus (virus gây bệnh khối u vết thương)
1.2.2. Bệnh khảm lá do virus
9
Bệnh khảm lá do virus gây ra là bệnh rất phổ biến trên cây thuốc lá, gây
hại nghiêm trọng đến năng suất và chất lượng của lá thuốc, nhất là đối với
thuốc lá sợi vàng. Bệnh còn có tên là bệnh “hoa lá vàng”. Bệnh nặng và phân
bố rộng ở nhiều nơi và vào bất kỳ mùa vụ nào trong năm [3].
Bệnh xuất hiện càng sớm thì càng ảnh hưởng đến năng suất, tỉ lệ phục hồi
hoàn toàn khá thấp (2,3- 5,2%). Tuy nhiên, phẩm chất của lá thuốc thường bị
tác hại nghiêm trọng hơn so với tác hại về năng suất: lá thuốc bị bệnh, sau khi
sấy, lá sẽ bị nâu đen, dòn, dễ bị nát vụn ra, không có mùi vị thơm ngon và hút
nặng.
Biểu hiện của bệnh khảm lá đầu tiên là các lá non ngả màu vàng nhạt, lá nhỏ
lại biến thành dạng khảm. Trên bề mặt của lá có biểu hiện của các vết khảm
loang lổ, màu sắc chỗ đậm, chỗ nhạt. Ngoài ra còn có các biểu hiện khác như:
phiến lá nhăn nheo, lồi lõm do các gân lá bị kìm hãm sinh trưởng trong khi
thịt lá vẫn phát triển, kích thước lá bị thu nhỏ lại.
Ngoài đồng, đôi khi cây bệnh ở dạng tiềm ẩn (không biểu lộ triệu chứng ra
ngoài) ở các mức độ khác nhau [3]:
• Ẩn bệnh toàn phần: cây hoàn toàn không biểu lộ triệu chứng;
• Ẩn bệnh cục bộ: chỉ có vài triệu chứng ở lá ngọn nhưng không
tiêu biểu lắm;
• Ẩn bệnh tạm thời: chỉ biểu lộ triệu chứng ở giai đoạn sau của
bệnh;
• Ẩn bệnh vĩnh viễn: không biểu lộ triệu chứng trong suốt giai
đoạn cây phát triển.
Do TMV cần thời gian ủ bệnh tương đối dài nên hiện tượng ẩn bệnh có thể
giải thích do do cây bị nhiểm bệnh vào giai đoạn trưởng thành nên TMV
không kịp gây ra triệu chứng. Tuy nhiên năng suất và phẩm chất thuốc vẫn bị
10
ảnh hưởng nghiêm trọng. Chỉ có thể phát hiện được cây ẩn bệnh bằng phương
pháp phản ứng huyết thanh. Ngoài ra, trong điều kiện nóng (>30
o
C), cây cũng
dễ bị mất triệu chứng.
Hình 1.2: Bệnh khảm lá trên cây thuốc lá
TMV và CMV là hai loại virus gây bệnh khảm phổ biến và nghiêm trọng nhất
cho cây thuốc lá hiện nay.
CMV thuộc loại Cucumovirus, họ Bromovirus. Đây là virus thực vật có phổ
cây bệnh rộng nhất với khoảng trên 1000 loài cây khác nhau [29].Virus có
dạng hình tròn kích thước 28- 30mm, CMV lây lan qua vật chủ trung gian chủ
yếu là qua rệp. Genome của CMV bao gồm 3 sợi RNA đơn dương (RNA1,
RNA2 và RNA3) chứa 5 khung đọc mở (ORF).
11
Hình 1.3: Sơ đồ cấu trúc genome CMV
Các chủng CMV đã được phân chia thành hai nhóm I và II dựa vào huyết
thanh học [42] [22], lai acid nucleic [50], trình tự gen [27]. Phân nhóm I và II
có mối quan hệ khá xa nhau và genmon của chúng chỉ có 75% nucleotid
tương đồng. Trong đó phân nhóm I lại được chia thành IA và IB, độ tương
đồng của chúng lên tới 92%-95% [29] [31]. Các chủng CMV phân nhóm IA
và II xuất hiện hầu như khắp thế giới trong khi các chủng CMV phân nhóm
IB chủ yếu có mặt ở Châu Á [21] [9].
Trong ba RNA của CMV, RNA3 xảy ra sự tái tổ hợp thường xuyên hơn
RNA1 và RNA2 [31]. Vì vậy có rất nhiều nghiên cứu dựa trên RNA3 để đánh
giá bảng đa dạng di truyền và xây dựng cây phát sinhc ủa chủng CMV
TMV thuộc loại Tobamovirus, phổ ký chủ virus TMV có tới 230 loài thuộc
32 họ và là một trong virus gây hại trên thực vật được mô tả sớm nhất ở nước
ta. Đây là một trong những virus gây bệnh thực vật được mô tả sớm nhất bởi
Mayer (1886), Iwanowshi (1882), Allard (1914), Stanley (1935). Ở Việt Nam,
12
có thể có hai dòng TMV chủ yếu: dòng mạnh và dòng yếu. Dòng mạnh sẽ làm
cây biến dạng nhiều, thường lá có dạng sợi chỉ. Dòng yếu làm cây biến dạng
ít hơn, thường chỉ gây khảm lá. Bệnh có thể mất triệu chứng ở thấp hơn 11˚ C
hoặc cao hơn 37˚C [4].
Virus TMV là virus đơn dương (ssRNa) có hình cuộn xoắn, dạng que hoàn
chỉnh của TMV có 2130 đơn vị capsid ( capsomeres), cứ 16 capsomeres tạo
thành một vòng xoắn. Mỗi capsomeres có 158 amino acid và có trọng lượng
1800 Daltons. Virion có chiều dài 300 mm và đường kính là 18mm [34].
TMV là virus RNA đơn dương (ssRNA) có hình cuộn xoắn [9].
Hình 1.4: Hình ảnh hiển vi virus TMV
Hình 1.5: Sơ đồ cấu trúc genome của TMV
13
6,395 nt
MP
RdRp CP
Helicase
RdRp: replicase; CP: protein vỏ; helicase: enzyme liên quan tới quá
trình duỗi xoắn;
MP: protein vận chuyển. Chiều mũi tên thể hiện chiều dịch mã
Virus TMV xâm nhiễm vào cây thông qua con đường cơ giới do tiếp xúc
virus thâm nhập vào các tế bào thông qua vết thương và qua khí khổng lá,
thân hoặc rễ mà không qua côn trùng. TMV có độ bền vững cao đối với nhiệt
độ. Đa số TMV bị mất hoạt tính ở 90-100
o
C trong 10 phút, nhưng vẫn còn
một số rất ít TMV tồn tại và chúng còn khả năng gây bệnh tùy theo chủng [4].
1.3. BIỆN PHÁP KHẮC PHỤC
Bện virus là bệnh khó phòng chống, chúng không thể tiêu diệt xử lý bằng các
chất hóa học như những bệnh nấm, vi khuẩn hay sâu bọ. Hiện nay đã có rất
nhiều phương pháp được đưa ra nhằm chống lại bệnh virus như:
1.3.1. Sử dụng giống kháng bệnh:
Sử dụng các loại giống đã được nghiên cứu có thể kháng lại những virus
gây bệnh. Phương pháp này đem lại hiệu quả cao, không gây ô nhiễm môi
trường và tạo được cây sạch bệnh. Tuy nhiên hạn chế của biện pháp này đó là
số lượng biện pháp gặp nhiều hạn chế về số lượng giống kháng bệnh cũng
như nguồn vật liệu di truyền kháng virus phục vụ cho cho công tác lai tạo
giống.
1.3.2. Sử dụng giống sạch bệnh
Giống sạch bệnh thu từ cây thuốc lá khỏe chọn giống chống bệnh bằng cách
lai với các giống thuốc lá dại.Sử dụng nguồn vật liệu giống sạch bệnh được
xem là biện pháp quan trọng nhất để hạn chế bệnh virus ở nhiều loại cây
trồng. Nhược điểm của biện pháp này là các loại cây trồng có thể bị nhiễm
virus trong quá trình canh tác trên đồng ruộng.
14
1.3.3. Các biện pháp canh tác
• Luân canh: nên luân canh với lúa (thuốc lá - luá - lúa - thuốc lá) vì
trong điều kiện ngập nước, phần lớn TMV sẽ bị tiêu diệt. Tránh độc
canh hoặc luân canh với cây trồng cạn.
• Vệ sinh đồng ruộng: làm sạch cỏ dại, thiêu hủy xác cây bệnh trước và
sau khi thu hoạch, phát hiện bệnh sớm và thiêu hủy cây bệnh, , cẩn
thận khi tiếp xúc với cây bệnh. Không nên để vụ thuốc tái sinh ở
những ruộng bị nhiễm bệnh[51].
- Phòng trị bệnh cho cây con ở vườn ươm: đây là biện pháp có hiệu quả kinh
tế cao. Chọn đất sạch mầm bệnh để làm vườn ươm, cách xa ruộng sản xuất
đại trà. Chỉ chọn cây con không bệnh đem đi trồng.
- Sử dụng các biện pháp kiểm soát côn trùng trung gian truyền bệnh: các loại
rệp, bọ trĩ.
1.3.4. Sử dụng biện pháp công nghệ sinh học
Thành công trong việc ứng dụng công nghệ sinh học trong tạo giống
cây trồng kháng bệnh virus được đánh dấu bởi công bố của Beachy và cộng
sự năm 1986 khi những cây thuốc lá chuyển gen mã hóa protein vỏ của TMV
(cấu trúc dạng sense) đã biểu hiện tính kháng với virus này [14]. Sau đó
Beachy và cộng sự đã phát triển những thí nghiệm của mình thành phương
pháp CP tạo cây trồng kháng virus. Phương pháp này đã được áp dụng tạo
những dòng cây chuyển gen kháng nhiều loại virus gây bệnh trên thực vật hai
lá mầm và sau đó là thực vật một lá mầm [21]. Tuy vậy, các cây chuyển gen
này chỉ kháng được duy nhất một chủng virus mang gen mã hóa protein vỏ
mà nó chuyển vào. Điều này gây trở ngại trong việc phát triển các giống cây
trồng kháng virus dựa trên phương pháp CP do độ đa dạng của virus thường
khá cao [32]
15
Cho tới những năm cuối thế kỷ 20, cấu trúc dạng kẹp tóc (ihpRNA) hay kỹ
thuật RNAi được xem là một kỹ thuật hiện đại và hữu hiệu nhất trong việc
chống lại các bệnh do virus gây ra ở thực vật. Năm 2004, Baulcombe đã công
bố cơ chế hoạt động của siRNA và coi đó là một cơ chế quan trọng trong việc
kháng lại virus ở thực vật. Các bước chính trong kỹ thuật này bao gồm: (1)
thiết kế các vector chuyển gen mang cấu trúc RNAi, (2) biến nạp vector
chuyển mang cấu trúc RNAi vào cây thông qua vi khuẩn Agrobacterium
tumefaciens làm bất hoạt các mRNA của virus gây bệnh, (3) sàng lọc các cây
chuyển gen mang cấu trúc RNAi và kiểm tra tính kháng virus của các cây
chuyển gen [38]. Tính hiệu quả của kỹ thuật RNAi trong việc tạo cây trồng
chuyển gen mã hoá protein của virus (gen mã hóa protein vỏ CP, enzyme
phiên mã RdRp,…) có khả năng kháng lại chính virus đó đã được chứng minh
bằng thực tế trong những nghiên cứu tạo cây trồng kháng các loại virus khác
nhau như: Potato virus Y PVY [43][33]cucumber mosaic virus CMV, Plum
pox potyvirus PPV [18], Tobacco mosaic virus TMV và Potato virus Y
PVY[35], Tomato yellow leaf curl virus TYLCV [46]Rice tungro bacilliform
virus RTBV, African cassava mosaic virus ACMV [41] … Trong những
nghiên cứu này, cấu trúc RNAi có chứa trình tự gen của virus lặp lại đảo
chiều thường được sử dụng để chuyển vào cây và sẽ được biểu hiện thành
RNA sợi đôi dạng kẹp tóc (hairpin RNA, hpRNA) trong cây chuyển gen từ đó
kích thích cơ chế RNAi hoạt động khi có sự xâm nhập của virus vào cây.
Người ta đã nhận thấy rằng khi vùng đệm của hpRNA được lặp lại với một
trình tự intron (ihpRNA) thì kết quả ihpRNA tạo ra sự bất hoạt gen là cao
nhất[33][44]. Năm 2007, Bonfim và cộng sự đã tạo ra được một dòng cây đậu
chuyển gen kháng virus BGMV (Bean golden mosaic virus) với tính kháng
lên đến 93%. Cũng năm này, Shinichiro Kamachi và cộng sự [ 26] đã công bố
kết quả tạo ra được một số dòng thuốc lá chuyển gen CP trong cấu trúc
ihpRNA có khả năng kháng cao với virus cucumber green mottle mosaic
virus CGMMV đến thế hệ T2 (12/14 số cây kiểm tra) và những siRNA đã
được phát hiện trong những dòng cây chuyển gen này. Nói chung, hầu hết các
cây chuyển gen làm chậm sự tích lũy virus và làm chậm hoặc giảm nhẹ các
triệu chứng bệnh[19]
Cho đến nay đã có các loại cây trồng chuyển gen kháng bệnh virus
16
được công nhận và trồng thương mại như: Đu đủ chuyển gen kháng bệnh đốm
vòng (papaya ringspot virus, PRSV) đã được công nhận và trồng ở Mỹ, Trung
Quốc, Philippine; Bí đao chuyển gen kháng ba loại vi rút Cucumber mosaic
virus, Watermelon mosaic virus, Zucchini yellow mosaic virus, đã được công
nhận và trồng ở Mỹ; Ớt và cà chua chuyển gen kháng Cucumber mosaic
virus, được công nhận và trồng ở Trung Quốc … Ngoài ra rất nhiều các loại
cây trồng chuyển gen kháng bệnh virus khác đang trong giai đoạn khảo
nghiệm để được công nhận là giống cây trồng thương mại như: Sắn chuyển
gen kháng African cassava mosaic virus (Begomovirus); Ngô chuyển gen
kháng Maize steak virus (Mastrevirus); Khoai tây chuyển gen kháng đồng
thời 3 loại virus Potato virus X (Potexvirus), Potato virus Y (Potyvirus),
Potato leafroll virus (Polerovirus); Lúa chuyển gen kháng Rice Tungro
viruses (Tungrovirus); Khoai lang chuyển gen kháng Sweet potato feathery
mottle virus (Potyvirus
Các cấu trúc gen có nguồn gốc từ virus gây bệnh được sử dụng chuyển vào
cây trồng để tạo tính kháng có thể là các loại khác nhau như: các cấu trúc của
virus theo chiều xuôi (sense) hay chiều ngược (antisense), các cấu trúc dạng
kẹp tóc (inverted repeats/hairpin) và các miRNA nhân tạo có đích là các trình
tự gen của virus gây bệnh, hay kỹ thuật RNAi “RNA interference”, đang được
quan tâm nhiều và ứng dụng rộng rãi.
1.3.4.1. Giới thiệu chung về công nghệ RNAi trong tạo cây trồng kháng virus
1.3.4.2. Cơ chế hoạt động của RNAi
RNAi là cơ chế ức chế sự biểu hiện vật chất di truyền ở giai đoạn RNA. Ở
thực vật có ba con đường ức chế RNA trong đó con đường đầu tiên là sự
ức chế gen sau phiên mã PTGS (post-transcriptional gen silencing) qua
trung gian là các RNA nhỏ có vai trò ức chế siRNA (short interfering
RNA) được sử dụng phổ biến nhất trong những nghiên cứu tạo cây chuyển
gen kháng virus. Quá trình này xảy ra ở tế bào chất và là con đường quan
17
trọng trong tế bào thực vật nhiễm virus nơi mà sợi RNA kép hoặc cấu trúc
thứ cấp của RNA virus sợi đơn có thể sao chép gián tiếp. Trong trường
hợp virus DNA, dsRNA có thể được tạo ra nhờ quá trình phiên mã bổ sung
liên tiếp [13]. Cơ chế cũng xảy ra tương tự như ở động vật. Khi có sự xâm
nhập của dsRNA, Dicer bản chất là RNaseIII đặc hiệu cho dsRNA cắt
những chuỗi kép RNA này ra những đoạn ngắn hơn, khoảng 21-25
nucleotide, gọi là siRNA . Sau đó, các siRNA kép hình thành được tách ra
làm hai chuỗi đơn, và chỉ một chuỗi đơn RNA với đầu 5' có lực bắt cặp
base (base-pairing) nhỏ nhất tiếp tục liên kết với Argonaute trong phức hệ
RISC. Tiếp đó, phức hệ RISC đã gắn đoạn siRNA nhận biết các mRNA
của tế bào có trình tự tương đồng với trình tự của đoạn chuỗi đơn siRNA
này. Sau khi nhận dạng mRNA qua việc bắt cặp các base tương đồng với
trình tự của chuỗi đơn siRNA, mRNA bị cắt đứt ở khoảng giữa của chuỗi
kép siRNA-mRNA thành những đoạn nhỏ khoảng 12 nucleotid từ đầu 3’.
Sau khi bị cắt đứt, mRNA nhanh chóng bị tiêu huỷ bởi các RNA nuclease
[16] (Hình 1.6).
18
Hình 1.6: Cơ chế hoạt động RNAi.
1.4. MỘT SỐ THÀNH TỰU TẠO CÂY CHUYỂN GEN KHÁNG VIRUS Ở
VIỆT NAM.
Ở Việt Nam gần đây đã có một số nghiên cứu theo hướng ứng dụng kỹ
thuật RNAi trong tạo giống cây trồng chuyển gen chống lại các bệnh do virus
gây ra. Phòng Công nghệ tế bào thực vật – Viện Công nghệ sinh học do GS.
Lê Trần Bình và PTS. Chu Hoàng Hà đứng đầu là nhóm nghiên cứu đầu tiên
ở Việt Nam đã thành công trong việc ứng dụng kỹ thuật RNAi trong tạo cây
chuyển gen kháng virus. Một trong những kết quả của đề tài cấp Viện
KH&CN Việt Nam được tiến hành trong 2 năm 2007-2008: “Nghiên cứu ứng
dụng kỹ thuật RNAi trong tạo giống cây trồng chuyển gen kháng bệnh virus”
là đã tạo được các cây thuốc lá chuyển gen kháng virus khảm dưa chuột
(CMV), kháng virus khảm thuốc lá (TMV) và kháng đồng thời cả 2 loại virus
trên. Năm 2009, ứng dụng RNAi, Phạm Thị Vân và cộng sự [7] (Phòng Công
19
Nghệ Tế Bào Thực Vật, Viện Công Nghệ Sinh Học) đã tạo được dòng thuốc
lá chuyển gen ở thế hệ T
0
kháng virus CMV với tỷ lệ 64,6%, kháng TMV với
tỷ lệ 74,5% và kháng đồng thời hai loại virus TMV và CMV với tỷ lệ
70,8%[7]. Kết quả này cho thấy tiềm năng ứng dụng to lớn kỹ thuật RNAi
trong việc tạo giống cây trồng kháng virus.
Kỹ thuật RNAi cũng đã được tiếp tục nghiên cứu ứng dụng trong đề tài trọng
điểm cấp nhà nước thuộc chương trình phát triển công nghệ sinh học (KC04-
03/06-10) với mục đích tạo cây đu đủ và cây ăn quả có múi chuyển gen kháng
bệnh virus. Đề tài đã được nghiệm thu cấp nhà nước trong tháng 9/2010. Một
trong những kết quả đạt được của đề tài là đã tạo ra được các dòng đu đủ
chuyển gen có khả năng kháng hoàn toàn với virus đốm vòng.
Bên cạnh cây trồng chuyển gen kháng virus cũng đã có rất nhiều thành công
trong việc tạo cây có khả năng kháng bệnh cây trồng, kháng vi khuẩn, kháng
côn trùng có hại hay cây chuyển gen chống chịu với điều kiện sinh thái bất lợi
mang lại hiểu quả kinh tế cao[6]. Tất cả đang mở ra một thời kì mới cho nền
nông nghiệp Việt Nam.
20
CHƯƠNG 2. VẬT LIỆU VÀ PHƯƠNG PHÁP
2.1. VẬT LIỆU
2.1.1.Vật liệu thực vật
Hạt giống thuốc lá C9-1 do công ty TNHH Một thành viên KTKT thuốc lá lai
tạo.
2.1.2.Chủng vi khuẩn và vector chuyển gen:
- Chủng Agrobacterium tumafaciens CV58C1 mang vector
pCB_GUS
Hình 2.1. Vector pCB_GUS
- Chủng Agrobacterium tumafaciens CV58C1 mang vector
TMV_RNAi
2.1.3.Hóa chất và thiết bị sử dụng
21
- Hóa chất: Bacto pepton, Yeast extract, NaCl, Agarose, Sucrose,
Glucose, Trypton, KCl, EDTA, MgCl
2
, NaOH. Các loại kháng sinh :
kanamycin, rifamycine, cefotaxime, streptomycine, spectinmycine. Các chất
điều hòa sinh trưởng như: BAP, NAA, và các hóa chất thông dụng của các
hãng Fermentas, Invitrogen, Mecrck, Sigma
- Môi trường được sử dụng trong nghiên cứu nuôi cấy mô tế bào và nuôi
cấy vi khuẩn dùng cho thí nghiệm chuyển gen gồm: MS, môi trường lây
nhiễm lỏng IM, môi trường tạo mô sẹo, môi trường tạo chồi, môi trường ra rễ
và môi trưởng nuôi khuẩn LB. Thành phần như trong phụ lục 1.
- Máy móc và thiết bị: Buồng cấy vô trùng , máy đo pH, máy đo OD, tủ
nuôi lắc, nồi khử trùng, máy ly tâm lạnh,máy điện di, cùng với các thiết bị
khác của Phòng Công Nghệ Tế Bào Thực Vật, Viện Công Nghệ Sinh Học.
2.2. PHƯƠNG PHÁP NGHIÊN CỨU
2.2.1.Tạo nguyên liệu thí nghiệm:
2.2.1.1.Khử trùng hạt bằng khí Clo
Khử trùng toàn bộ dụng cụ trước thí nghiệm
Đặt cốc thủy tinh chứa 100ml Javen vào bình khử trùng. Hạt thuốc lá được
cho bình pyrex (dung tích 100ml). Bình Pyrex mở hé 1/3 nắp lọ đặt bên cạnh
cốc thủy tinh chứa dung dịch Clo. Bổ sung vào cốc đựng Javen 3ml HCl, hỗn
hợp này sẽ tạo ra khí Clo có tác dụng khử trùng hạt thuốc lá. Đậy kín bình
khử trùng và dán parafin.
Sau 4h lấy hạt đã khử trùng ra để trong box cấy 30 phút để bay hết khí rồi tiến
hành gieo hạt.
2.2.1.2. Gieo hạt
Gieo hạt vào môi trường MS (100 hạt/ bình)
Sau 4 ngày hạt bắt đầu nảy mầm. Khi cây phát triển được 1 tuần, đánh giá tỉ
lệ nảy mầm và cấy chuyển sang môi trường MS mới.
2.2.2.Chuyển gen vào cây thuốc lá thông qua trung gian vi khuẩn
Agrobacterium tumafaciens
2.2.2.1.Tạo dịch huyền phù vi khuẩn Agrobacterium
- Lấy chủng khuẩn từ ống giữ chủng và cấy vạch lên môi trường LB đặc
có bổ sung các kháng sinh chọn lọc ( Cefotaxime 25mg/l, kanamycin 50mg/l
đối với chủng A.tumerfaciens mang vecter chuyển gen chứa câu trúc
22
pCB_GUS; Rifamycine 50mg/l, streptomycine 100mg/l, spectinomycine
100mg/l đối với chủng vi khuẩn A.tumerfaciens mang vecter chuyển gen chứa
cấu trúc TMV_RNAi) nuôi trong tủ ổn nhiệt 28˚C trong thời gian 48 giờ.
- Lấy một khuẩn lạc riêng biệt phát triển tốt trên đĩa khuẩn và cấy vào 2
ml LB lỏng có bổ sung các loại kháng sinh chọn lọc như khi nuôi ở môi
trường LB đặc. Bình nuôi lỏng được đặt trong máy lắc với tốc độ 200 vòng/
phút ở nhiệt độ 28˚C nuôi qua đêm. Lấy 0.5ml dịch huyền phù chuyển sang
50ml LB lỏng (không kháng sinh) nuôi phục hồi khuẩn trong vòng 4h . Ly
tâm 4000v/p trong 10p ở 4˚C và hòa tan trong dung dịch IM (MS, pH 5.8)
lỏng. Sử dụng vi khuẩn A.tumerfaciens có mật độ đạt OD
600
=0.7 -1.0 để biến
nạp.
2.2.2.2. Tạo nguyên liệu chuyển gen
Chọn lá có kích thước vừa phải ở các cây con khỏe mạnh 2 tuần tuổi. Dùng
dao cắt bốn cạnh mép lá để gây tổn thương, tạo thành các mảnh lá có hình
vuông kích thước khoảng 0,25 cm
2
. Lá bị tổn thương sau đó được đặt úp trong
môi trường lây nhiễm IM để tránh bị khô.
2.2.2.3.Nhiễm khuẩn và đồng nuôi cấy
Ngâm khoảng 30 mảnh lá trong đĩa petri chứa 20 ml dung dịch IM có bổ sung
100µl dịch khuẩn Agrobacterium. Các mảnh lá được ngâm trong dung dịch
trên trong 30 có lắc nhẹ trong vòng 30 phút. Sau đó đặt vào bình chứa môi
trường MS,1mg/l BAP, 30g/l glucose,8g/l agar, pH5,8.
Hình 2.3 : Các mảnh lá được ngâm trong dung dịch IM có bổ sung dịch
khuẩn
2.2.2.4.Tái sinh và chọn lọc cây chuyển gen
23
Sau 3 ngày chuyển các mảnh lá sang môi trường tạo chồi chứa MS, 1mg/l
BAP,30g/l glucose,8g/l aga,pH 5,8 và có chứa các kháng sinh 50mg/l
kanamycine, 250mg/l Cefotaxime.
Sau 3- 4 tuần xuất hiện các chồi nhỏ từ các mảnh lá. Tiến hành tách các chồi
nhỏ và cấy trên môi trường MS, 30g/l glucose,8g/l aga,pH 5,8 và có chứa các
kháng sinh 50mg/l kanamycine, 250mg/l Cefotaxime.
2.2.2.5.Tạo rễ và cây hoàn chỉnh
Khi các xuất hiện các chồi và các chồi đạt chiều cao khoảng 2- 3 cm tiến hành
tách các chồi nhỏ này và chuyển sang môi trường ra rễ ( MS + 0,1mg/l NAA,
30g/l glucose,8g/l aga, pH 5,8)
Sau 3 .tuần các cây in vitro được đưa ra ngoài môi trường. Cây non được
chuyển sang môi trường cát + trấu ( 50% trấu, 50% cát) và chuyển ra trồng
trong nhà lưới.
2.2.3.Phân tích cây chuyển gen bằng phương pháp nhuộm mô hóa tế bào
Thu mẫu từ các cây con sau 2 tuần phát triển trong nhà lưới. Đối với những
cây được chuyển cấu trúc pCB_GUS, biểu hiện của gen gus được kiểm tra
bằng nhuộm trong dung dịch X-gluc (50 mM Na2HPO4 và NaH2PO4; pH7;
10mM[K3(Fe(CN)6]; 10mM K4[(Fe(CN)6]; 10 mM Na2EDTA; 0,1%
Triton-100; 1,5mM X-glucuronide). Mẫu lá thuốc lá được ngâm trong dung
dịch X-gluc và ủ trong tủ ổn nhiệt ở nhiệt độ 37ᵒC, thời gian ủ từ 24- 48 giờ.
Sau thời gian ủ , mẫu được rửa sạch bằng nước cất khử trùng và ngâm vào
dung dịch cồn 70% nhằm loại bỏ diệp lục. Sau khi loại bỏ diệp lục, mẫu được
đưa lên kính hiển vi soi nổi, quan sát và chụp ảnh.
2.2.4. Phân tích sự có mặt của cấu trúc chuyển gen TMV_RNAi bằng
phương pháp PCR
ADN tổng số từ lá thuốc lá được tách chiết và sử dụng làm khuôn mẫu cho
phản ứng PCR với cặp mồi đặc hiệu nhằm xác định sự có mặt của gen chuyển
trong các dòng thuốc lá. Sản phẩm PCR được điện di kiểm tra trên gel
agarose 0,8%.
2.2.4.1. Tách chiết ADN tổng số
Tách ADN tổng số được tiến hành theo các bước sau:
24
(1) Lấy 100mg lá non (trong ống effendorf 1.5ml) nghiền trong nitơ lỏng
cho tới khi thành dạng bột mịn
(2) Bổ sung 500µl dung dịch đệm (0,2M Tris-HCl pH9.0; 0,4M LiCl;
25mM EDTA pH8.0; 1%SDS) vào từng ống. Ly tâm 13000 vòng/ phút, trong
5 phút
(3) Hút 350µl dịch trong ở phía trên ra từng ống effendol mới
(4) Bổ sung 350µl isopropanol vào từng ống, mix đều
(5) Ly tâm 13000 vòng/phút trong 15 phút. Loại bỏ dịch nổi, thu tủa
(6) Làm khô bằng máy Speeed Vac
(7) Hòa tan ADN trong 40µl H
2
O deion
2.2.4.2. Thực hiện phản ứng PCR
Phản ứng PCR được tiến hành với cặp mồi TMV-Fi/ TMV-Ri [8] với trình tự
như sau:
TMV-Fi: 5’- CACCATGAAACCTTCACCACA-3’
TMV-Ri: 5’- CTAGGTCCAAACCAAACCAG-3’
Bảng 2.1. Thành phần phản ứng PCR với cặp mồi đặc hiệu TMV-Fi/ TMV-Ri
STT Thành phần Thể tích (x1) (µl)
1 H
2
O deion 10,1
2 Dung dịch đệm 2
3 MgCl
2
25mM 2
4 dNTP
s
1,6
5 Primer TMV-Fi 0,8
6 Primer TMV- RI 0,8
7 Taq polymerase 1u/µl 0,2
8 Template 2,5
Tổng 20
Bảng 2.2. Thành phần phản ứng PCR
Bước Phản ứng Nhiệt độ (0C) Thời gian Chu kỳ
1 Biến tính 94 3 phút 1
2 Biến tính 94 1 phút
3 Gắn mồi 52 50 giây 25
25