Bài 17. Phản ứng oxi hóa khử
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (898.51 KB, 7 trang )
1
Từ Đức Hà
Từ Đức Hà
+ 1e
+ 2e
+ 1e
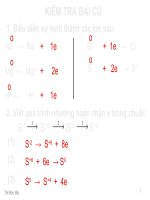
KIỂM TRA BÀI CŨ
Na → Na
+
Mg → Mg
2+
H
→ H
+
Cl → Cl
-
S → S
2-
o
o
o
o
o
+ 1e
+ 2e
1. Biểu diễn sự hình thành các ion sau:
2. Viết quá trình nhường hoặn nhận e trong chuỗi:
S
-2
→ S
+6
+ 8e
S
-2
S
+6
S
0
S
+4
1
→
2
→
3
→
S
+6
+ 6e → S
0
S
0
→ S
+4
+ 4e
(1)
(2)
(3)
2
Từ Đức Hà
Từ Đức Hà
3
Từ Đức Hà
Từ Đức Hà
Thí nghiệm: Sự khử CuO bằng H
2
4
Từ Đức Hà
Từ Đức Hà
Tóm lại:
5
Từ Đức Hà
Từ Đức Hà
Như vậy:
Phản ứng oxi hóa - khử là phản ứng hóa
học trong đó có sự chuyển electron giữa các
chất tham gia phản ứng.
Hay: Phản ứng oxi hóa - khử là phản
ứng trong đó có sự thay đổi số oxi hóa của
một số nguyên tố.
Sự oxi hóa và sự khử bao giờ cũng diễn
ra đồng thời trong một phản ứng oxi hóa khử.
6
Từ Đức Hà
Từ Đức Hà
BÀI TẬP ÁP DỤNG
Bài 1. Xác định chất oxi hóa, chất khử trong các ptpư sau:
2NH
3
+ 3CuO → 3Cu + N
2
+ 3H
2
O
2Al + 3H
2
SO
4
→ Al
2
(SO
4
)
3
+ 3H
2
O
Bài 2: Viết quá trình oxi hóa, quá trình khử trong các pứ:
Fe + CuSO
4
→ FeSO
4
+ Cu H
2
+ Cl
2
→ 2HCl
………………………… …………………………
…………………… …… …………………………
Bài 3. Những phương trình phản ứng oxi hóa - khử là:
Al + 4HNO
3
→ Al(NO
3
)
3
+ NO + 2H
2
O
ZnO + 2HNO
3
→ Zn(NO
3
)
2
+ H
2
O
4Fe(OH)
2
+ O
2
→ 2Fe
2
O
3
+ 4H
2
O
2FeCl
2
+ Cl
2
→ 2FeCl
3
Khử Oxi hóa
Oxi hóaKhử
Fe → Fe
+2
+ 2e
Cu
+2
+ 2e
→ Cu
H
2
→ 2H
+
+ 2e
Cl
2
+ 2e
→ 2Cl
-
7
Từ Đức Hà
Từ Đức Hà
BÀI TẬP ÁP DỤNG
Bài 4. Cho sơ đồ phản ứng sau:
FeO → Fe → FeCl
2
→ Fe(NO
3
)
2
→ Fe(OH)
2
→ Fe(OH)
3
Số phản ứng thuộc loại phản ứng oxi hóa – khử là:
A. 1 B. 2 C. 3 D. 4
Bài 5: Trong các chất : Fe, FeCl
2
, FeCl
3
, Fe(NO
3
)
2
, Fe(OH)
3
,
FeSO
4
, Fe
2
O
3
.
Số chất có cả tính oxi hoá và tính khử là:
A. 2 B. 3 C. 4 D. 5