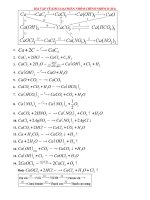Bài 10 kim loại phân nhóm chính nhóm II
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (713.74 KB, 28 trang )
PHẦN I :
KIỂM TRA BÀI CŨ
Câu 1 : Viết phương trình biểu diễn
Na 2 CO 3 → NaHCO 3 →NaOH
1
3
2
4
5
6
→ NaCl →Na → H 2 → Cu .
Câu 2 : Phân biệt các dung dòch
sau đây bằng 1 thuốc thử :
a. Na 2 CO 3 , K3 PO 4 và Na 2 SO 4
b. NaCl , KCl , AgNO 3,và NH4 NO 3
Câu 3 : Tại sao các dung dòch
NaHCO3 và Na2CO3 có phản ứng
kiềm ?
Giải thích, viết phương trình phản ứng
minh họa.
PHAN II :
Baứi 10 :
KIM LOAẽI PHAN
NHOM CHNH NHOM
II
I - Vò trí – cấu tạo
1. Vò trí nguyên tố
Nguyên tố Be
Mg
Ca
Sr
Ba Ra
Chu kì
2
3
4
5
6
7
Số thứ tự
Z
4
12
20
38
56
88
Khối lượng
9
24
40
88 137 226
Nguyên tử
- Radi là nguyên tố phóng xạ có hạt nhân không bền
- Ca, Sr Ba gọi là kim loại kiềm thổ
2.Cấu tạo nguyên tử
Có 2 e ở lớp ngoài cùng, cũng là nguyên tố
nhóm s, đủ 2e.
Bán kính nguyên tử tương đối lớn, chỉ nhỏ
hơn kim loại kiềm.
Lực hút giữa hạt nhân với e ngoài cùng
yếu, hơi lớn hơn kim loại kiềm cùng chu kì.
Rất dễ nhường 2e ngoài cùng nên cũng có
tính khử mạnh, chỉ kém kim loại kiềm
cùng chu kì :
M -2e →
M2+
3. Cấu tạo tinh thể :
Be và
đều.
Ca và
diện.
Ba và
khối.
Mg : lăng trụ lục giác
Sr : lập phương tâm
Ra : lập phương tâm
Tinh thể lập phương tâm khối Ba, Ra
Có 9 ion dương ở đỉnh và ở tâm của khối.
Tinh thể lập phương tâm diện : Ca, Sr
Có 14 ion dương, gồm 8 ở đỉnh và 6 ở tâm các mặt.
Tinh thể lăng trụ lục giác đều : Be, Mg
có 17 ion dương ở đỉnh, ở tâm và ở mặt trung trực
II - Lí tính :
Nguyên tố
Be
Mg
Ca
128
650
t0 sôi
2770
1110
Khối lượng
riêng
1.85
1.74
t0 nóng chảy
Độ cứng
Màu ngọn lửa
2
Sr
838
Ba
768
7.4
114 1380 1640
0
2,5
2.6
3.5
1
1.8
Giải
thích
Không
theo qui
luật vì
mạng
tinh thể
khác
nhau
Liên kết
kim loại
yếu
III- Hóa tính :
1.Tác dụng với đơn chất
a.Với Ôxi tạo ôxít
0
M +
1/2
O2
Thí dụ : Mg + ½ O2
t
=
MO
=
MgO
to
* ở t0 6000C tạo Peoxit
Ba + O2
600 0 C
=
BaO2
b.Vôùi Halogen :
Taïo muoái halogenua
t0
M + X2 = MX2
Thí dụ :
t0
Ca + Cl2 =
CaCl2
c.Vụựi lửu huyứnh :
Taùo muoỏi sunfua
M + S
Thớ d :
Ba + S
t0
=
t0
=
MS
Ba S
2.Tác dụng với hợp chất :
a.Với H2O :
α .Be và Mg :
Chỉ phản ứng ở nhiệt độ cao
Thí dụ :
0
600 C
↑
MgO
+
H
Mg + H2O =
2
β. Ca, Sr, Ba ( ôû t0 thöôøng)
M + 2 H2O =
Thí dụ :
Ba+ 2H2O
=
M(OH)2 + H2↑
↑
Ba(OH)2 + H2
b.Vôùi axít :
α . axít HCl,H2SO4loaõng ,coù
khí H2 ↑ bay ra :
M + 2H+ =
M
2+
+ H2
↑
Thí dụ :
Mg + 2 HCl
=
MgCl2 + H2 ↑
β . HNO3, H2SO4 ññ
* HNO3, ññ: có khí NO2 bay ra
Th í dụ :
Be + 4 HNO3ññ = Be(NO3)2 + 2 NO2
+
↑
2H2O
* H2SO4 ủủ: taùo thaứnh khớ SO2
hoaởc S hoaởc H2 S
Thớ d :
Ca + 2 H2SO4 ủủ = CaSO4 +SO2 + 2 H2O
* HNO3 loaõng : có khí NO bay ra
Th í dụ :
3 Mg+ 8 HNO3loaõng = 3Mg(NO3)2
+ 2NO + 4H2O
c.Với Bazơ :
Chỉ có Beri có tính lưỡng tính mới
tác dụng với Bazơ
2 NaOH
+ Be =
Na2BeO2 + H2 ↑
Natri berilat
d.Với dung dòch muối
α. Be
và Mg tạo ra kim loại
Th í dụ : Mg + CuSO4 =
MgSO4 +Cu
Mg+ NH 4Cl → không phản ứng
β.Ca, Sr, Ba: tạo ra khí H2 và hidrôxít
kim loại
Th í dụ :
Ca + FeCl2 + 2H2O = Fe(OH)2 ↓ + CaCl2 +H2↑
IV- Ñieàu cheá :
MX2
ñpnc
=
M + X2
Thí dụ :
ñpnc
CaCl2
=
Ca + Cl2
PHẦN III :
CỦNG CỐ BÀI
I. VỊ TRÍ CẤU TẠO :
1.
2.
3.
Vị trí Nguyên tố.
Cấu tạo nguyên tử.
Cấu tạo tinh thể.
V - Ứng dụng
Beri tạo ra hợp kim cứng, đàn hồi,
làm vỏ máy bay, tàu biển.
Mg tạo ra hợp kim nhẹ, bền, chế tạo máy
bay, tên lửa.
Cr làm chất khử để tách kim loại, tách
oxi, S.