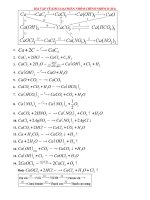kim loại phân nhóm chính nhóm II trong bảng HTTH
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (100.63 KB, 2 trang )
kim loại phân nhóm chính nhóm II trong bảng HTTH
I. Vị trí của kim loại phân nhóm chính nhóm II trong bảng HTTH
Kim loại các phân nhóm chính nhóm II có các nguyên tố sau:
beri (Be), magie (Mg), canxi ( Ca), stronti (Sr), bari (Ba), rađi (Ra).
Trong mỗi chu kì, nguyên tố này đứng liền sau kim loại kiềm (trừ chu kì 1)
II. Tính chất vật lí của kim loại phân nhóm chính nhóm II
- Nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp ( trừ beri)
- Độ cứng tuy có cao hơn kim loại kiềm nhưng chúng là những kim loại mềm hơn
nhôm.
- Khối lượng riêng tương đối nhỏ, chúng là những kim loại loại nhẹ hơn nhôm (trừ
bari).
Những kim loại này có tính chất vật lí nêu trên là do ion kim loại có bán kính tương đối
lớn, điện tích nhỏ, lực liên kết kim loại trong mạng tinh thể yếu
Kim loại các phân nhóm chính nhóm II có nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng
riêng biến đổi không theo một quy luật nhất định như kim loại kiềm là do các kim loại các
phân nhóm chính nhóm II có những kiểu mạng tinh thể không giống nhau.
III. Tính chất hóa học của kim loại các phân nhóm chính nhóm II
Kim loại các phân nhóm chính nhóm II là những nguyên tố nhóm s, nguyên tử có 2
electron hóa trị ( ), phần còn lại có cấu tạo giống nguyên tử khí trơ đứng trước trong
HTTH.
Những kim loại các phân nhóm chính nhóm II có bán kính nguyên tử tương đối lớn. từ
những đặc điểm trên, chúng ta dễ dàng suy ra kim loại các phân nhóm chính nhóm II là
những chất khử mạnh, trong các hợp chất chúng có số oxi hóa là +2. Tính khử của kim loại
này thể hiện qua các phản ứng hóa học sau:
1. Trong không khí, ở nhiệt độ thường, Be và Mg bị oxi hóa chậm tạo thành màng oxit bảo
vệ cho kim loại. Các kim loại còn lại tác dụng với Oxi của không khí mãnh liệt hơn. Khi
đốt nóng kim loại các phân nhóm chính nhóm II đều cháy trong không khí tạo thành oxit:
2. Kim loại các phân nhóm chính nhóm II khử dễ dàng ion (hoặc viết là )
trong dung dịch axit ( ) thành hiđro tự do:
Kim loại các phân nhóm chính nhóm II có thể khử của dung dịch loãng xuống
:
3. Trong nước ( ở nhiệt độ thường ), Be không có phản ứng, Mg khử chậm, các kim loại
còn lại khử nước mạnh mẽ và tạo ra dung dịch bazơ:
Vì vậy các kim loại Ca, Sr, ba được gọi là những kim loại kiềm thổ
IV. Ứng dụng
Kim loại beri tạo ra những hợp kim cứng, đàn hồi, không bị ăn mòn, dùng chế tạo máy
bay, vỏ tầu biển...
Kim loại magie tạo ra những hợp kim có đặt tính nhé và bền, dùng chế tạo máy bay, tên
lửa..
Kim loại canxi dùng làm chất khử để tách một số kim loại khỏi hợp chất, tách oxi, lưu
huỳnh ra khỏi thép....
Các kim loại kiềm thổ còn lại ít có ứng dụng trong thực tế
V. Điều chế kim loại các phân nhóm chính nhóm II
Phương pháp chính để điều chế là điện phân muối halogenua của chúng ở dạng nóng chảy.
Phương trình biểu diễn điện phân dạng tổng quát có thể biểu diễn dưới dạng: