Bài giảng Hoá học Hữu cơ dành cho sinh viên
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (669.51 KB, 74 trang )
TRƯỜNG ĐẠI HỌC NÔNG LÂM HUẾ
DỰ ÁN HỢP TÁC VIỆT NAM – HÀ LAN
BÀI GIẢNG
HOÁ HỮU CƠ
Người biên soạn: Phan Thị Diệu Huyền
Huế, 08/2009
CHƯƠNG I. MỘT SỐ NỘI DUNG CƠ BẢN CỦA LÝ THUYẾT
HÓA HỮU CƠ
1.1. Phản ứng hữu cơ
1.1.1. Phân loại hợp chất hữu cơ
1.1.1.1. Phân loại theo nhóm chức
Hợp chất cơ bản của Hoá hữu cơ là hydrocacbon. Các chất khác được xem là
dẫn xuất của hydrocacbon, các dẫn xuất nầy được hình thành bằng cách thay thế
một hay nhiều nguyên tử H trong hydrocacbon bằng các nhóm chức khác, chẳng
hạn: -OH, -CO-, -COOH, -NH2 ....
Khi phân tử có một nhóm chức ta có hợp chất đơn chức, có nhiều nhóm
chức đồng nhất ta có hợp chất đa chức, có nhiều nhóm chức khác nhau ta có hợp
chất tạp chức.
1.1.1.2. Phân loai theo mạch C
Mach C có thể hở, vòng, mạch thẳng, phân nhánh, mạch no, không no ...
Về cơ bản người ta phân thành 2 loại chính: mạch hở và mạch vòng, trong
mỗi loại lại có những dạng khác nhau.
- Mạch hở
(liên kết đơn)
+ Hợp chất no: chỉ chứa liên kết
+ Hợp chất không no: chứa liên kết bội (đôi, ba)
- Mạch vòng
+ Đồng vòng: các nguyên tố tạo vòng đều là C
+ Dị vòng: nguyên tố tạo vòng ngoài C còn các nguyên tố khác
Các dị tố thường gặp: O, S, N ...
1.1.2. Phân loại phản ứng hữu cơ
1.1.2.1. Phản ứng thế (S: Substitution)
Phản ứng thay thế nhóm thế này bằng nhóm thế khác
Ví dụ:
CH4
as
+
Cl2
+
CH3 Cl
Cl2
+
NaOH
CH3 Cl
bột Fe
+ HCl
(S R: thế gốc tự do)
Cl + HCl (SE: thế electronphin)
CH3OH
Tổng quát:
1
+ NaCl (SN: thế nucleophin)
R-X + Y
R- Y + X
( X: nhóm bị thế, Y: nhóm thế )
1.1.2.2. Phản ứng cộng (A: Addition)
Phản ứng kết hợp một hay nhiều nhóm thế vào phân tử chưa no.
Phản ứng thường xảy ra trong các hợp chất có nối đôi, nối ba.
Ví dụ:
CH3 - CH = CH2 + HCl
CH3 - CHCl - CH3
CH3 - CH = O
CH3 - CH(CN) - OH (AN)
+
HCN
(AE)
peroxit
CH3 - CH = CH2 + HBr
1.1.2.3. Phản ứng tách
CH3 - CH2 - CH2Br
(AR)
(E: Elimination)
Phản ứng loại một hay nhiều nhóm nguyên tử ra khỏi phân tử
Ví dụ:
H2 SO4
CH3 - CH2OH
CH2 = CH2 + H2O
1800 C
kiềm/rượu
CH3 - CHCl - CH3
CH3 - CH = CH2 + HCl
1.2. Bản chất liên kết trong Hoá hữu cơ
Có nhiều loại liên kết nhưng trong Hoá hữu cơ liên kết quan trọng nhất là
liên kết cộng hoá trị.
Theo quan điểm hiện đại liên kết cộng hoá trị được hình thành do sự xen phủ
các orbital nguyên tử (AO), orbital nhận được gọi là orbital phân tử (MO). Tuỳ vào
sự xen phủ người ta phân biệt 2 loại liên kết sau:
1.2.1. Liên kết
(xen phủ trục)
Liên kết này được hình thành do sự xen phủ cực đại của các cặp orbital: s-s, s-p,
p-p.Trục đối xứng trùng với đường thẳng nối liền với 2 hạt nhân nguyên tử.
Mô tả:
s - s
s - p
p - p
Các orbital p ở dạng lai hoá có hình quả tạ đôi không cân đối.
Đặc điểm:
- Liên kết tương đối bền, do vậy các chất được cấu tạo bởi chỉ liên kết nầy
ở điều kiện thường khá trơ về mặt hoá học.
2
- Các nhóm thế nối với nhau bằng liên kết
1.2.2. Liên kết
có thể quay quanh trục liên kết.
(xen phủ bên)
Liên kết nầy được hình thành do sự xen phủ từng phần của các cặp orbital: pp, p-d, d-d. Trục đối xứng có thể song song hoặc cắt nhau.
Mô tả:
Các orbital p ở dạng chưa lai hoá có hình quả tạ đôi cân đối.
Đặc điểm:
- Liên kết
kém bền
- Các nhóm thế nối nhau bằng liên kết
không thể quay tự do được
1.3. Cấu trúc phân tử hợp chất hữu cơ
Thuyết cấu tạo hoá học của ButLeRop ra đời đã giải quyết được rất nhiều
vấn đề trong đó nổi bậc nhất là hiện tượng đồng phân.
Có 2 loại đồng phân:
1.3.1. Đồng phân cấu tạo (mặt phẳng)
- Đồng phân mạch C
- Đồng phân nhóm chức
- Đồng phân vị trí nhóm chức
- Đồng phân liên kết
Ưu nhược điểm của đồng phân cấu tạo
Ưu điểm: phản ánh được cấu tạo của chất từ đó cho phép dự đoán được tính
chất đặc trưng của chất đó.
Ví dụ:
C2H5-OH: có H linh động
C2H6O
CH3-O-CH3: không có H linh động
Nhược điểm: Chưa phản ánh được cấu tạo thực sự (cấu trúc) của các chất, từ
đó chưa giải thích được một vài hiện tượng thực tế.
1.3.2. Đồng phân không gian (lập thể)
3
1.3.2.1. Thuyết tứ diện của C
Van Hop và Lơ Ben đã tìm ra cấu trúc đặc biệt của C (năm 1874), hai ông
đưa ra thuyết tứ diện của C.
Nội dung:
"Trong hợp chất hữu cơ 4 hoá trị của C hướng ra 4 đỉnh của một hình tứ
diện, các góc ở tâm đều bằng nhau và bằng 1090 28' ".
Mô tả:
a
1090 28’
b
C
0
109 28’
d
c
Có 2 loại đồng phân không gian:
1.3.2.2. Đồng phần hình học
1. Định nghĩa: là loại đồng phân gây nên do sự phân bố khác nhau trong không gian
của các nhóm thế xung quanh một bộ phận cố định (nối đôi, vòng no)
a. Trường hợp nối đôi
Phân tử có 1 nối đôi sẽ có 2 đồng phân hình học được gọi là cis và trans (nếu
nối đôi là C=C), gọi là syn và anti (nếu nối đôi là C = N hay N = N).
Hai nhóm thế giống nhau nằm cùng phía đối với nối đôi thì gọi là đồng
phân dạng cis hay syn.
Ngược lại nằm khác phía thì gọi là trans hay anti.
H
H
C
H
C
HOOC
COOH
C
COOH
HOOC
H
dạng cis
C6 H5
dạng trans
C6 H5
N
C
C6 H5
N
N
dạng syn
N
dạng anti
b. Trường hợp vòng no: cũng tương tự
4
C6 H5
OH
OH
OH
dạng cis
dạng trans
OH
2. Điều kiện để có đồng phân hình học
- Phân tử phải có nối đôi hay vòng no.
- Hai nhóm thế gắn với mỗi C của nối đôi hay vòng no phải khác nhau.
1.3.2.3. Đồng phân quang học
1. Định nghĩa:
Những đồng phân có tính chất lý, hoá giống nhau chỉ khác nhau về khả năng
làm quay mặt phẳng phân cực của ánh sáng phân cực gọi là đồng phân quang học
của nhau.
Chất làm quay mặt phẳng phân cực gọi là chất quang hoạt.
mặt phẳng bị lệch
chất hoạt quang
as phân cực
nicol
as tự nhiên
Khi cho ánh sáng phân cực đi qua chất hoạt quang mặt phẳng dao động của
ánh sáng bị lệch đi một góc ( : góc quay cực) được đo bằng máy phân cực kế.
Chất làm quay mặt phẳng sang trái (
Chất làm quay mặt phẳng sang phải (
< 0) gọi là chất quay trái
> 0) gọi là chất quay phải
Khi trộn 50% đồng phân quay trái với 50% đồng phân quay phải ta thu được
hỗn hợp gọi là biến thể racemic
2. Điều kiện để có đồng phân quang học
5
Điều kiện cơ bản là phân tử phải có cấu hình bất đối xứng, một trong những
yếu tố tạo nên sự bất đối của phân tử là sự xuất hiện của nguyên tử C bất đối, ký
hiệu: C*.
C*: 4 hoá trị của C liên kết với 4 nhóm thế khác nhau.
a
C*
b
d
c
Phân tử có 1C* thì sẽ có 2 cấu hình giống nhau nhưng không thể chồng khít
lên nhau được mà chỉ đối xứng nhau qua gương phẳng. Hai cấu hình như vậy gọi là
2 đồng phân quang học của nhau (1 cặp đối quang).
Khi số C* tăng thì số đồng phân quang học tăng nhanh
Số đồng phân quang học được tính:
N = 2n
Trong đó:
n: số C*
N: số đồng phân quang học
Đối với trường hợp phân tử có 1C* thì việc biểu diễn cấu hình dưới dạng tứ
diện dễ dàng nhưng phân tử có từ 2C* trở lên thì việc biểu diễn khó khăn. Do vậy
để đơn giản khi biểu diễn người ta dùng công thức chiếu Fischer.
Công thức Fischer là hình chiếu của công thức tứ diện lên mặt phẳng thoả
mãn các quy ước:
-
Đường thẳng đứng ứng với 2 liên kết hướng xa theo hướng nhìn
-
Đường nằm ngang ứng với 2 liên kết ở gần theo hướng nhìn.
Lưu ý:
Nhóm có bậc oxi hóa của C cao được đặt nằm trên, nhóm có bậc oxi hóa
thấphơn được đặt nằm dưới đường thẳng đứng.
Bậc oxi hoá của C: - COOH > - CHO (-CO-) > - CH2OH > - R
a
a
b
d
c
C
d
c
b
6
C
c
a
a
a
C
c
c
b
c
b
b
b
a
3. Các ví dụ cụ thể
Ví dụ 1:
Xét phân tử axit lactic CH3 - C*HOH - COOH
Phân tử có 1C* có 2 đồng phân quang học (1cặp đối quang)
COOH
H
COOH
OH
HO
H
CH3
CH3
Ví dụ 2:
Xét phân tử C6H5 - C*H(NH2)-C*H(NH2)-COOH
axit 2,3-diamino - 3phenyl propanoic
Phân tử có 2C* có 4 đồng phân quang học (2 cặp đối quang)
COOH
H
H
H
COOH
NH2
NH2
H2N
H2N
C6H5
COOH
H
COOH
H
H
NH2
H2N
C6H5
H
H2N
H
C6H5
NH2
C6H5
4. Danh pháp D,L
Để sắp xếp các chất hoạt quang theo dạng D hay L chọn cấu hình glyxeraldehyt
làm chuẩn.
CHO
H
CHO
OH
HO
CH2 OH
CH2OH
D (+) glyxeral
L(-) glyxeral
(+): chỉ chất đó làm quay mặt phẳng sang phải
7
H
(-): chỉ chất đó làm quay mặt phẳng sang trái
- Nếu phân tử chỉ có 1C*
Chẳng hạn:
Hợp chất R - C*HX - R' với X (halogen, - OH, - NH 2 ...)
Tuỳ vị trí X ở bên phải hay bên trái C* mà ta có cấu hình D hay L.
R
R
H
X
X
H
R'
R'
dạng D
dạng L
- Nếu phân tử có nhiều C* ta chọn cấu hình C* xa nhóm chức nhất.
CHO
H
HO
H
H
CHO
OH
H
OH
OH
CH2 OH
HO
H
HO
HO
D (+) glucose
H
OH
H
H
CH2 OH
L (-) glucose
1.4. Hiệu ứng hoá học
Các nhóm thế trong phân tử có ảnh hưởng qua lại lẫn nhau có thể trực tiếp hoặc
gián tiếp. Sự ảnh hưởng qua lại đó dẫn đến làm thay đổi sự phân cực của các liên
kết trong phân tử. Ảnh hưởng như vậy của các nhóm thế gọi là hiệu ứng hoá học.
Các loại hiệu ứng thường gặp.
1.4.1. Hiệu ứng cảm ứng (I)
1.4.1.1. Khái niệm
Xét phân tử:
3
CH3 - 2CH2 - 1CH2 Cl
Liên kết 1C Cl phân cực (do Cl có độ âm điện lớn hơn C) làm cho các liên
kết 2C 1C 3C2 C cũng phân cực theo tuy mức độ yếu dần. Ta nói Cl đã gây hiệu
ứng cảm ứng.
Hiệu ứng cảm ứng biểu diễn bằng mũi tên thẳng
Định nghĩa: Hiệu ứng cảm ứng sinh ra do sự dịch chuyển mật độ e
nên do sự chênh lệch độ âm điện.
1.4.1.2. Quy luật
- H không hút, không đẩy e (I = 0)
- Nhóm thế hút e mạnh hơn H gây hiệu ứng cảm âm (-I).
8
gây
Độ âm điện càng lớn, nhóm càng chưa no gây hiệu ứng - I càng mạnh.
- F > - Cl > - Br > - I
-I
- F > - OH > - NH2
- C CH > - CH = CH2
Một số nhóm thế khác gây hiệu ứng – I: - OR, - CN, - NO2, SO3 H ......
- Nhóm thế đẩy e mạnh hơn H gây hiệu ứng cảm dương (+I).
Các nhóm gây +I là gốc ankyl, gốc càng phức tạp gây hiệu ứng càng mạnh.
CH3)3C - > (CH3)2CH-CH2 - > (CH3)2CH - > C 2H5 - > CH3 1.4.1.3. Đặc điểm - Ý nghĩa
- Hiệu ứng ± I chỉ truyền theo mạch
kéo dài.
C - C - C Cl
và giảm nhanh cường độ khi mạch
1 (+)
>
2 (+)
>
3 (+)
- Hiệu ứng ± I giúp ta giải thích tính axit, bazơ và khả năng phản ứng của
các chất.
Các nhóm thể gây +I làm giảm tính axit, tăng tính bazơ và ngược lại các
nhóm thế gây -I làm tăng tính axit, giảm tính bazơ.
Chẳng hạn:
Tính axit:
CH2Cl - COOH > CH3 - COOH
-I
Tính bazơ:
CH3 - NH2
+I
> O2 N - CH2 - NH2
+I
-I
1.4.2. Hiệu ứng liên hợp (C)
1.4.2.1. Khái niệm
*
Hệ liên hợp
- Hệ liên hợp
: hệ chứa liên kết đôi xen kẻ liên kết đơn.
-
- Hệ liên hợp p mang nối đôi.
: hệ chứa nguyên tử còn cặp e chưa chia liên kết với C
CH2 = CH - CH = CH2
OH
Cl - CH = CH2
p-
p-
Xét phân tử có hệ liên hợp:
9
5
CH2 = 4CH - 3CH = 2 CH - 1CH = O
Liên kết C = O phân cực về phía O, 1C = O phân cực dẫn đến liên kết 3 C =
2
C cũng bị phân cực về 2 C, liên kết 5C = 4C tương tự.
CH2 = CH - CH = CH - CH = O
Ta nói nhóm - CHO gây hiệu ứng liên hợp.
Hiệu ứng liên hợp được biểu diễn bằng mũi tên cong đi từ liên kết đôi đến
liên kết đơn hoặc từ đôi điện tử chưa chia đến liên kết đơn theo hệ.
Định nghĩa: Hiệu ứng dịch chuyển e
lệch độ âm điện gọi là hiệu ứng liên hợp.
trong hệ liên hợp gây ra do sự chênh
Nhóm hút e gây hiệu ứng liên hợp âm (-C)
- NO2, - CHO, - COOH, - CN ...(các nhóm không no)
Nhóm đẩy e gây hiệu ứng cảm dương (+C)
- OH, - OR, - NH2, halogen ... (các nhóm có đôi e chưa chia)
Lưu ý: Một số nhóm có hiệu ứng C với dấu không cố định như vinyl,
phenyl ...
O
NH 2
N
O
+C
-C
-C
+C
1.4.2.2. Quy luật
- Độ âm điện nguyên tử càng lớn - C càng lớn.
- C:
- CO - > - C = N - > - C = C -
- Trong 1 phân nhóm +C giảm từ trên xuống
- Trong 1 chu kỳ +C giảm từ trái sang phải
- F > - Cl > - Br > - I
+C
- NH2 > - OH > - F
1.4.2.3. Đặc điểm
- Hiệu ứng C chỉ lan truyền theo hệ liên hợp phẳng.
- Ít thay đổi khi mạch kéo dài
Chú ý:
1. Hiệu ứng do nhóm thế gây ra còn tuỳ thuộc vào nhóm mà nó nối.
10
O2N - CH2 - CH2 - COOH
(NO2: - I)
O2N
(NO2: -I, -C)
COOH
CH2 = CH - O - CH3
(CH2 = CH - : -C)
CH2 = CH - C N
(CH2 = CH - : +C)
2. Trong phân tử thường gặp các nhóm thế có cả 2 loại hiệu ứng I, C.
+ Khi I và C cùng dấu tăng cường tác dụng
Chẳng hạn: - NO2 , - SO3H .....
Chẳng hạn:
O
-N
(-I, -C): hút e mạnh
O
+ Khi I và C ngược dấu giảm tác dụng của nhau hiệu ứng tổng quát.
- NH2, - OH, - OR có + C > - I hiệu ứng tổng quát là đẩy e.
Đặc biệt các nguyên tử halogen có – I > + C do vậy hiệu ứng tổng quát là hút e.
Tóm lại hai loại hiệu ứng trên đều được dùng để giải thích tính chất của các
chất và khả năng phản ứng của chúng.
11
CHƯƠNG II. HYDROCACBON
Hydrocacbon là hợp chất hữu cơ mà thành phần phân tử chỉ gồm 2 nguyên tố là C và H.
Tuỳ vào khả năng liên kết và tính chất của chúng người ta chia làm 3 loại:
Hydrocacbon
Hydrocacbon chưa no
Hydrocacbon no
ankan
xycloankan
ankan ankadien
Hydrocacbon thơm
ankyn
aren
2.1. Hydrocacbon no
2.1.1. Ankan
2.1.1.1. Khái niệm - Danh pháp
1. Khái niệm: Ankan là loại hydrocacbon mạch hở trong phân tử chỉ gồm các liên kết .
Công thức tổng quát: Cn H2n + 2
2. Danh pháp
Bốn chất đầu có tên gọi ngẫu nhiên tuỳ theo ý muốn của người tìm ra chúng.
CH4 : metan
C3 H8 : propan
C2 H6 : etan
C4 H10 : butan
Từ C5 H12 trở đi tên gọi có quy luật:
Tên các chữ số Hylap + an
C5 H12 : pentan
C8 H18 : octan
C6 H14 : hexan
C9 H20 : nonan
C7 H16 : heptan
C10 H22 : decan
Đó là tên gọi các chất trong trường hợp mạch C thẳng, khi mạch C phân nhánh tức xuất
hiện đồng phân tên gọi của chúng phức tạp hơn. Để thống nhất người ta đưa ra danh pháp
chung gọi là danh pháp IUPAC. Để gọi tên theo danh pháp này người ta thực hiện các bước
sau:
- Chọn mạch C dài nhất làm mạch chính
- Đánh số mạch chính: theo quy tắc tổng số nhánh bé nhất
- Gọi tên: Vị trí nhánh + số nhánh + tên nhánh + tên mạch chính
Chú ý: Khi gọi tên các nhánh gọi theo thứ tự alphabet (nếu có nhiều nhóm thế khác nhau)
Một số nhánh thường gặp:
- CH3 : metyl, - C2 H5 : etyl, - CH2 - CH2 - CH3 : n-propyl, - CH(CH3 )2 : isopropyl
11
CH3 - CH(CH3 ) - CH(CH3 ) - CH2 - CH3
2,3-dimetyl pentan
CH3 - CH(CH3 ) - CH - CH2 - CH3
3-etyl-2-metyl pentan
CH3 -CH2
2.1.1.2. Lý tính
Bốn chất đầu ở thể khí do lực nối các phân tử yếu, các chất sau ở thể lỏng và thể rắn, t0 s
và t0 nc tăng theo chỉ số C do lực liên kết phân tử mạnh.
Tất cả chúng đều là những chất không màu, không mùi, ít tan trong nước, dễ tan trong
các dung môi không phân cực hoặc kém phân cực.
2.1.1.3. Điều chế
1. Hydro hoá anken: Cho anken tác dụng với H2 có Ni xúc tác
Cn H2n +
H2
Cn H2n+2
2. Đi từ muối axit hữu cơ: Cho muối tác dụng với NaOH co mặt CaO
RCOONa + NaOH
RH
+
Na2 CO3
3. Phương pháp ghép mạch (Wurts - Fittig)
Cho dẫn xuất monohalogen tác dụng với Na trong môi trường ete khan.
2R - X
+
2 Na
R - R + 2NaX
Phương pháp này thường dùng điều chế các ankan có tính chất đối xứng.
2.1.1.4. Hoá tính
Do phân tử bền nên ở điều kiện thường ankan khá trơ về mặt hoá học. Khi có điều kiện:
(t0 cao, bức xạ, as ... ) ankan cũng tham gia phản ứng và phản ứng đặc trưng là phản ứng thế.
1. Phản ứng thế
Các H của ankan được thế dần bởi các tác nhân thế.
Tác nhân thế: halogen (X2 ), HNO3 l, H2 SO4 l ...
Tên phản ứng: halogen hoá, nitro hoá, sunfo hoá ...
a. Phản ứng halogen
R- H
+
X2
R- X
+
HX
Khả năng phản ứng:
giảm dần
F2
I2
Tác nhân halogen hoá thường gặp: Cl2 , Br2 , xúc tác: ánh sáng, nhiệt độ....
Xét phản ứng cụ thể: CH4 phản ứng với Cl2
CH3 Cl: metyl clorua
CH4
+
Cl2
as
- HCl
CH2 Cl2 : metylen clorua
CHCl3 : clorofoc
CCl4 : cacbontetraclorua
12
Cơ chế phản ứng: xảy ra theo cơ chế gốc tự do (SR) gồm 3 giai đoạn:
Giai đoạn 1: giai đoạn khởi đầu
as
Cl2
•
2Cl
Giai đoạn 2: giai đoạn phát triển mạch
•
•
CH4 + Cl
CH3 + HCl
•
•
CH3 + Cl2
CH3 Cl + Cl
CH3 Cl + Cl
CH2 Cl + HCl
•
•
•
•
CH2 Cl + Cl2
CH2 Cl2 + Cl
Phản ứng cứ tiếp tục xảy ra cho đến khi tạo thành sản phẩm cuối cùng (phản ứng dây chuyền)
Giai đoạn 3: giai đoạn tắt mạch
Xảy ra khi các gốc tự do kết hợp với nhau tạo phân tử bền
•
•
Cl + Cl
Cl2
CH3 + Cl
CH3 Cl
•
•
Quy tắt thế: Phản ứng xảy ra ưu tiên thế H ở nguyên tử C bậc cao.
as
CH3 -CH-CH2-CH3 + Br2
CH3 -CBr - CH2 - CH3 + HBr
CH3
CH3
b. Phản ứng nitro hoá:tương tự phản ứng halogen hoá về cơ chế cũng như quy tắc thế.
H2 SO4
R - H + HO - NO2
R - NO2
+ H2 O
t0
2. Phản ứng huỷ: ở t0 cao không có O2KK các ankan bị phân huỷ bẻ gãy mạch C tạo thành
những hydrocacbon có mạch ngắn hơn. Quá trình này gọi là quá trình cracking.
CnH2n+2
Cx H2x+2
+ Cy H2y
( x, y < n )
Quá trình cracking được sử dụng nhiều trong kỹ nghệ chế biến dầu mỏ.
3. Phản ứng oxi hoá
- Oxi hoá hoàn toàn: sản phẩm là CO2 , H2 O
- Oxi hoá không hoàn toàn: tuỳ điều kiện cho sản phẩm khác nhau.
+ Đối với CH4
200at, 3000 C,
H - CHO
+
H2 O
CO2
+
H2
C
+
H2 O
0
CH4 + O2KK
500 C, Ni
thiếu kkh í
13
+ Đối với các ankan khác: oxi hoá kèm theo sự bẻ gãy mạch C.
[o]
R - COOH + R’ - COOH
R-CH2 -CH2 -R'
Chất tiêu biểu: CH4
CH4 : là chất khí có nhiều trong tự nhiên: hầm mỏ, đầm ao do sự phân hủy xenlulo dưới
tác dụng của vi khuẩn yếm khí.
v.k.y.k
(C6 H10O5 )n + nH2 O
3nCH4
3nCO2
CH4 được dùng làm nguyên liệu tổng hợp các chất hữu cơ: CH3 OH, HCHO, C2 H2 và
các dẫn xuất halogen.
2.1.2. Xycloankan
2.1.2.1. Khái niệm - Danh pháp
Xycloankan là loại hydrocacbon mạch vòng, no.
Công thức tổng quát: Cn H2n (n 3)
Xycloankan được gọi tên như ankan chỉ thếm tiếp đầu ngữ là xyclo (vòng)
xyclopropan
xyclohexan
Xycloankan ngoài các loại đồng phân thông thường còn có đồng phân hình học (đồng
phân cis-trans) và đồng phân quang học, trong đó đồng phân hình học phổ biến nhất.
2.1.2.2. Độ bền và cấu tạo lập thể các vòng.
Năm 1885 Baeyer đưa ra giả thuyết sức căng vòng để giải thích độ bền vòng. Theo ông
góc liên kết ở C no bình thường là 1090 28' còn góc liên kết giữa các C trong vòng tuỳ thuộc số
cạnh vòng (3 cạnh: 600 , 4 cạnh: 900 , 6 cạnh: 1200 ...) Sự sai khác giữa các vòng này với 1090 28'
gây nên sức căng vòng, sai khác càng lớn thì sức căng càng lớn và vòng càng kém bền.
Vòng 3,4 cạnh: kém bền
Vòng 5,6 cạnh: bền hơn
Cấu tạo lập thể các vòng.
- Vòng 3 cạnh: cấu tạo phẳng
- Vòng 5 cạnh: dạng nửa ghế
- Vòng 4 cạnh: cấu tạo gãy gấp
- Vòng 6 cạnh: dạng ghế, dạng thuyền
Thường gặp nhất là vòng 6 cạnh, dạng bền của vòng 6 cạnh là dạng ghế.
dạng ghế (99,9%)
14
2.1.2.3. Hoá tính
Vòng 3, 4 cạnh kém bền nên tính chất giống anken phản ứng đặc trưng là phản ứng
cộng.
+H2
Ni, t
CH3 - CH2 - CH3
0
+Br2
CH2 Br - CH2 - CH2 Br
Vòng 6 cạnh bền nên tính chất giống ankan phản ứng đặc trưng là phản ứng thế.
xúc tác
+
Cl
Cl2
+
HCl
2.2. Hydrocacbon chưa no
2.2.1. Anken
2.2.1.1. Khái niệm - Danh pháp
- Anken là loại hydrocacbon chưa no trong phân tử có chứa 1 liên kết đôi (1 liên kết
vaì 1 liên kết )
Công thức tổng quát: Cn H2n (n 2)
- Danh pháp: đổi đuôi an thành en kèm theo vị trí nối đôi
CH2 = CH2 : eten (etylen)
CH3 - CH = CH - CH3 : 2-butten
CH3 - C(CH3 ) = CH - CH3 : 2-metyl-2-buten
Các gốc thường gặp:
CH2 = CH -
: etenyl (vinyl)
CH3 - CH = CH -: propenyl-1
CH2 = CH - CH2 - : propenyl-2 (allyl)
2.2.1.2. Điều chế
1. Đi từ dẫn xuất monohalogen
Cho dẫn xuất đi qua môi trường kiềm/rượu
K/R
R - CH2 - CHX - R'
R - CH = CH - R'
-HX
Phản ứng tuân theo quy tắc Zay Xep (tách H ở C bậc cao)
2. Đi từ dẫn xuất dihalogen
Cho dẫn xuất tác dụng với bột Zn có mặt xúc tác CH3 COOH
R - CHX - CHX - R'
+
x/t
Zn
15
R - CH = CH - R'
+ ZnX2
3. Đi từ ancol
Đun hỗn hợp ancol với H2 SO4 đ ở t0 1700C
H+, 1800 C
R - CH2 - CHOH - R'
R - CH = CH - R'
+
H2 O
2.2.1.3. Hoá tính
C
C
Liên kết kém bền nên dễ bị bẻ gãy.
Do vậy phản ứng đặc trưng của anken là phản ứng cộng.
1. Phản ứng cộng
Phản ứng
C=C
X+ - Y-
+
CX - CY
Cơ chế: cộng elctronphin (AE)
Phản ứng xảy ra qua 2 giai đoạn
C=C
chậm
X+
+
C - C+
X
C - C+
nhanh
Y-
+
C-C
X
X Y
Tác nhân: X2 (halogen), HX, H2 O ...
Minh hoạ bằng một số phản ứng:
CH2 = CH2
+
Br2
CCl4
CH2 Br - CH2 Br
nâu đỏ
không màu
CH3 - CH = CH2 + HCl
CH3 - CHCl - CH3
CH3 - CH(CH3 ) - CH = CH2 + H2 O
CH3 - CHOH - CH(CH3 ) - CH3
(Qui tắc Maccopnhicop)
+HBr
CH3 - CH = CH2
CH3 - CHBr - CH3
(1)
AE
CH3 - CH2 - CH2 Br
(2)
AR
+HBr
peroxit
(1) : phản ứng tuân theo qui tắc Maccopnhicop
(2) : phản ứng ngược với qui tắc Maccopnhicop
16
2. Phản ứng oxi hoá
Tuỳ điều kiện và tác nhân mà cho sản phẩm khác nhau
a. Tác nhân oxi hoá yếu: sản phẩm là -diol
R - CH = CH - R' + KMnO4 + H2 O
R - CH - CH - R ' + MnO2 + KOH
OH OH
-diol
Phản ứng này chứng minh anken làm mất màu thuốc tím loãng.
b. Tác nhân oxi hoá mạnh: tuỳ mức độ mà tạo thành hợp chất cacbonyl hay axit cacboxylic.
*
Với O3 (phản ứng ozon phân):
Sản phẩm là hợp chất cacbonyl
R'
H2 O
R - CH = C
+ O3
R - CHO + R' - CO - R'' + H2 O2
+
H
R''
Mục đích phản ứng này dùng để xác định vị trí liên kết đôi trong hợp chất đầu.
*
Với KMnO4 đđ: sản phẩm có thể là axit hoặc xeton tuỳ cấu tạo chất đầu.
R'
R - CH = C
+ KMnO4đđ
t0
R - COOK + R' -CO - R'' + MnO2 + H2 O + KOH
R''
3. Phản ứng trùng hợp
t0 , p, x/t
(- CHR – CHR’ -)n
nR - CH = CH - R'
Phản ứng này được dùng để điều chế chất dẻo, cao su, nhựa ...
Chất tiểu biểu: C2 H4
C2 H4 là chất khí không màu, không mùi, không vị, ít tan trong nước, có tác dụng kích
thích sự hoạt động của enzym làm quả mau chín.
C2 H4 còn được dùng để điều chế rượu etylic, đây là hợp chất rất quan trọng trong công
nghiệp và cả trong đời sống.
2.2.2. Ankadien
2.2.2.1. Khái niệm - Danh pháp
Ankadien là loại hydrocacbon chưa no có chứa 2 liên kết đôi trong phân tử.
Có 3 loại:
- Hai nối đôi liền nhau:
CH2 = C = CH2
- Hai nối đôi cách xa nhau: CH2 = CH - CH2 - CH = CH2
propadien
1,4 - pentadien
- Hai nối đôi xen kẻ nhau (ankadien liên hợp): đây là loại có ý nghĩa nhất chẳng hạn:
CH2 = CH - CH = CH2
1,3 - butadien
CH2 = C(CH3 ) – CH = CH2
2- metyl – 1,3 - butadien
17
2.2.2.2.Hoá tính
Các ankadien liên hợp có tính chất tương tự anken tuy nhiên do có đến hai nối đôi nên
hoạt tính mạnh hơn đồng thời do xuất hiện hiệu ứng liên hợp nên ảnh hưởng nhiều đến tính
chất của nó cũng như các dẫn xuất của nó.
Phản ứng đặc trưng cũng là phản ứng cộng.
1. Phản ứng cộng: cho 2 phẩm vật cộng tuỳ điều kiện, điều kiện quyết định nhất là nhiệt độ.
- Nhiệt độ thấp: cho phẩm vật cộng 1-2
- Nhiệt độ cao: cho phẩm vật cộng 1-4
t0 , thấp
+Br2
CH2 = CH - CH = CH2
CH2 Br - CHBr - CH = CH2
t0 , cao
CHBr - CH = CH - CH2 Br
2. Phản ứng trùng hợp
t0 , p, x/t
n CH2 = CH - CH = CH2
(- CH2 - CH = CH - CH2 -)n
cao su Buna
2.2.2.3. Hợp chất có nhiều nối đôi
1. Tecpen: là loại hydrocacbon tự nhiên có công thức tổng quát là: (C5 H8 )n với n 2, tecpen có
nhiều ở tinh dầu thực vật.
Chẳng hạn tinh dầu myxen ở cây nguyệt quế.
CH3 - C = CH - CH2 - CH2 - C = CH2
CH3
CH = CH2
Dẫn xuất của tecpen gọi là tecpenoit cũng có trong tinh dầu thực vật (cánh hoa hồng,
hoa bưởi, vỏ cam chanh, lá sả ...)
CH3 - C = CH - CH2 - CH2 - C = CH - CH2OH
CH3
(tinh dầu hoa hồng)
CH3
2. Caroten:
Caroten là những sắc tố tự nhiên thường có màu vàng, da cam, đỏ xuất hiện ở các loại
quả như: cà chua, cà rốt, gấc ... phân tử chứa một loạt các liên kết đôi xen kẻ liên kết đơn tức
có chứa nhóm -C = C - (nhóm mang màu)
Có 3 loại caroten: , , caroten
Cấu tạo caroten:
CH3
CH3
CH3
CH
CH3
vòng ionon
CH C
CH
CH ..... CH =C
CH3
CH3
(mạch thẳng chứa 18C)
18
CH
CH
CH3
CH3
caroten khi bị thuỷ phân cho 2 phân tử vitamin A
C H3
C H3
H2 O
CH
caroten
CH C
CH
CH
CH
C H3
carotenase
C H3
C
CH3
CH
vitamine A
CH2OH
và caroten khi bị thuỷ phân cũng cho vitamin A nhưng hàm lượng ít hơn (chỉ 1
phân tử)
Vitamin A có nhiều công dụng:
- Chữa bệnh quáng gà, khô mắt
- Tạo sắc tố thị giác giúp người và động vật nhìn được trong bóng tối.
Sơ đồ tổng hợp Rodopsin:
Rodopsin
Opsin
cis Retinal
NADH, H+
trans Retinal
NADH, H+
NAD+
NAD+
trans Retinol
enzyme
cis Retinol
Rodopsin: sắc tố thị giác
Opsin: protein
Retinol: vitamin A
Thiếu vitamin A gây bệnh lý nhưng thừa vitamin A cũng gây nguy hiểm: bệnh thần
kinh (mơ sảng, loạn tâm thần), khô da, nứt môi, giảm bạch hầu ...
2.2.3. Ankyn
2.2.3.1. Khái niệm - Danh pháp
- Ankyn là hydrocacbon chưa no trong phân tử có chứa 1 liên kết ba
Công thức tổng quát: Cn H2n-2
(n 2)
- Danh pháp: đổi đuôi an thành yn kèm theo vị trí nối ba
CH CH: etyn (axetylen)
CH3 - CH2 - C CH: 1-butyn
19
2.2.3.2. Điều chế
1. Từ dẫn xuất dihalogen
Cho dẫn xuất đi qua môi trường kiềm/rượu
R - CHX - CHX - R'
R - C C - R' + 2HX
R - CH2 - CX2 - R'
2. Từ dẫn xuất tetra halogen
Cho dẫn xuất tác dụng với bột Zn có mặt xúc tác CH3 COOH
xúc tác
R - CX2 - CX2 - R'
R - C C - R' + 2ZnX2
+ 2Zn
3. Thuỷ phân CaC2 (điều chế C2 H2 )
CaC2
+
2H2O
Ca(OH)2
+ C2 H2
2.2.3.3. Hoá tính
Cũng như anken là một hydrocacbon chưa no nên phản ứng đặc trưng là phản ứng cộng.
1 liên kết : bền
- C C -
2 liên kết : kém bền
1. Phản ứng cộng
Xảy ra qua 2 giai đoạn:
- Chuyển nối ba thành đôi
- Chuyển nối đôi thành đơn
Tuỳ điều kiện mà sản phẩm cộng có thể no hay chưa no (tức cộng tỷ lệ 1: 1 hay 1: 2)
CH CH
+ H2
Pd
CH2 = CH2
Ni
CH CH + 2H2
CH3 - CH3
CH2 = CHCl
(1:1)
CH3 - CHCl2
(1:2)
CH CH + HCl
Đặc biệt khi cho ankyn tác dụng với H2O thì chỉ riêng C2 H2 cho sản phẩm là andehyt
còn các ankyn khác cho sản phẩm là xeton.
ch. vị
Hg 2+
CH CH + H2 O
[CH2 = CH]
CH3 - CHO
OH
R - C C - R' + H2 O
Hg
ch. vị
2+
[R - C = CH - R']
OH
20
R - CO - CH2 - R'
2. Phản ứng oxi hoá
Do có đến 2 liên kết kém bền nên quá trình oxi hoá xảy ra mạnh hơn bẻ gãy cả nối ba,
sản phẩm thu được đa phần là axit cacboxylic.
[O]
R - C C - R'
R - COOH
[O]
CH3 - C C - CH3
+
R' - COOH
2CH3 - COOH
Đặc biệt các ankyn có nối ba đầu mạch (còn H linh động) có thể tham gia phản ứng thế.
3. Phản ứng thế
Các ankyn có nối ba đầu mạch gọi là ankyn -1.
C2 H2 và các ankyn -1 có thể thế H của nối ba bởi kim loại hay ion kim loại.
Chẳng hạn:
t0
R - C CH
+ Na
R - C C Na + 1/2H2
R - C CH
+
NaNH2
R - C CNa
R - C CH
+
Ag(NH3 )2 OH
R - C CAg vàng nhạt + NH3 + H2 O
R - C CH
+
Cu (NH3 )2 Cl
R - C CCu đỏ gạch + NH3 + H2 O
+
NH3
Phản ứng này được dùng để nhận biết ankyn -1.
4. Phản ứng trùng hợp
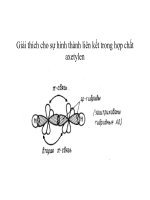
Xét trường hợp điển hình là C2 H2
Tuỳ điều kiện mà xảy ra các kiểu trùng hợp khác nhau: trùng hợp vòng, trùng hợp
thẳng hay tạo polime.
Khả năng trùng hợp vòng thường xảy ra nhất và đây là phương pháp để điều chế
benzen.
600 – 8000 C, C
3C2 H2
C6 H6
Chất tiêu biểu: C2 H2
C2 H2 là chất khí không màu khi cháy toả ngọn lửa màu xanh rất sáng tạo nhiệt lớn vì
vậy được dùng để hàn và cắt kim loại (các loại đèn xì).
C2 H2 được dùng để điều chế các hoá chất cần thiết khác: andehyt, axit, một số nhựa
quan trọng: P.V.C, P.V.A ...
Có tác dụng kích thích sự sinh trưởng của cây trồng nhất là kích thích sự ra hoa, kết quả,
làm quả mau chín.
2.3. Hydrocacbon thơm
2.3.1. Khái niệm - Phân loại
Hydrocacbon thơm là loại hydrocacbon có chứa vòng benzen trong phân tử.
Công thức tổng quát: Cn H2n-6
Dựa vào cấu tạo người ta chia làm 2 loại chính:
21
(n 6)
- Hydrocacbon thơm một nhân (đơn vòng)
- Hydrocacbon thơm nhiều nhân (đa vòng)
Trong phần này chúng ta chủ yếu khảo sát loại một nhân, loại này khả năng phản ứng
mạnh cũng như ứng dụng thực tế nhiều hơn.
Tất cả hydrocacbon thơm đều có vòng benzen, do vậy trước hết chúng ta xét cấu tạo
của vòng benzen.
2.3.2. Cấu tạo benzen
Công thức phân tử benzen: C6 H6
*
Cấu tạo của KeKuLe (cổ điển):
Ưu điểm: đảm bảo hoá trị các nguyên tố
Nhược điểm:
- d C - C > d C = C, như vậy khoảng cách C - C trong benzen phải khác nhau nhưng
thực tế chúng lại bằng nhau.
- Phân tử có đến 3 liên kết đôi đáng lẽ phản ứng đặc trưng là phản ứng cộng nhưng thực
tế phản ứng đặc trưng lại là phản ứng thế.
*
Cấu tạo theo quan điểm hiện đại
Theo quan điểm hiện đại C trong benzen có lai hoá sp2 mỗi C còn 1 orbital p thuần tuý
chưa lai hoá, 6 orbital này xen phủ lẫn nhau tạo hệ thống liên kết bền vững gọi là hệ liên hợp
thơm bền vững.
Do hệ thơm bền nên phản ứng đặc trưng của benzen là phản ứng thế. Trong hệ thơm
mật độ e dàn đều trên tất cả các liên kết do vậy khoảng cách C - C đều như nhau.
Cấu tạo benzen có thể được biểu diễn:
hay
2.3.3. Danh pháp - Vị trí các nhóm thế
Các đồng đẳng của benzen được xem là dẫn xuất của benzen do vậy tên gọi chúng được
gọi theo benzen.
22
CH(CH3)2
CH3
metyl benzen
(toluen)
isopropyl
benzen
(cumen)
Trường hợp phân tử có nhiều nhóm thế người ta tiến hành đánh số thứ tự ở 6 đỉnh của
vòng bắt đầu từ đỉnh nào gắn với nhóm thế đơn giản nhất.
CH3
CH3
1
1
2
5
2
CH3
6
6
3
5
4
3
C2 H5
4
1,2 - dimetyl benzen
(o. xylen)
1,3 -dimetylbenzen
(m. xylen)
Vị trí (2) (6):vị trí octo (o), vị trí (3) (5: vị trí meta (m),vị trí (4): vị trí para (p)
2.3.4. Điều chế:
Nhựa than đá là nguồn nguyên liệu chủ yếu và quan trọng cung cấp hydrocacbon thơm.
Ngoài ra có thể điều chế hydrocacbon thơm bằng phương pháp hóa học.
Cho ben zen tác dụng với ankylhalogenua có mặt xúc tác AlCl3
AlCl3
C6 H6
+ R- X
C6 H5 - R + HX
2.3.5. Hoá tính
Do hệ thơm bền vững nên phản ứng đặc trưng của aren là phản ứng thế, phản ứng cộng
và oxi hoá xảy ra khó khăn hơn
2.3.5.1. Phản ứng thế
Phản ứng tổng quát:
Ar - H
xúc tác
+ X- Y
Ar - X + H - Y
Cơ chế: xảy ra theo cơ chế thế electronphin (SE) phần tử tấn công đầu tiên vào aren là
tác nhân electronphin. Gồm 2 giai đoạn:
R
R
+
X
X
X
H
+
phức
(kém bền)
H
Y-
X
phức
giai đoạn 1
giai đoạn 2
23
+ HY