Brom
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.77 MB, 25 trang )
1
XIN THÂN CHÀO CÁC EM ĐẾN
XIN THÂN CHÀO CÁC EM ĐẾN
VỚI BUỔI HỌC HÔM NAY
VỚI BUỔI HỌC HÔM NAY
2
KIỂM TRA ĐẦU GIỜ
1. Dung dòch nào trong các dung dòch sau
đây không được chứa trong bình bằng
thủy tinh? Vì sao?
a. HCl b. HF
c. H
2
SO
4
d. HNO
3
3
4
BROM
Kí hiệu hóa học
Công thức phân tử
Số thứ tự
Khối lượng nguyên
tử
Cấu hình electron
lớp ngoài cùng
Br
Br
2
35
80
4s
2
4p
5
5
NỘI DUNG CHÍNH
I- Trạng thái tự nhiên. Điều chế
1. Trạng thái tự nhiên
2. Điều chế
II- Tính chất. Ứng dụng
1. Tính chất
2. Ứng dụng
III- Một số hợp chất của Brom
1. Hidro bromua và axit bromhidric
2. Hợp chất chứa oxi của Brom
6
TRẠNG THÁI TỰ NHIÊN
TRẠNG THÁI TỰ NHIÊN
Natri Bromua - NaBr Kali Bromua - KBr
Brom trong tự nhiên thường ở dạng hợp chất, chủ
yếu là các muối natri và kali (có nhiều trong nước
biển)
Hàm lượng brom trong tự nhiên ít hơn clo và flo
7
ÑIEÀU CHEÁ
0
0
-1 -1
2NaBr + Cl
2
2NaCl + Br
2
8
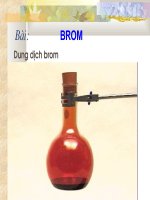
- Chất lỏng
- Chất lỏng
- Màu nâu đỏ
- Màu nâu đỏ
- Dễ bay hơi
- Dễ bay hơi
- Độc, làm bỏng
- Độc, làm bỏng
nặng khi rơi vào
nặng khi rơi vào
da.
da.
- Tan trong nước và nhất là trong dung
- Tan trong nước và nhất là trong dung
môi hữu cơ.
môi hữu cơ.
TÍNH CHẤT VẬT LÝ
TÍNH CHẤT VẬT LÝ
9
Cấu hình e của brom (Z = 35):
1s
1s
2
2
2s
2s
2
2
2p
2p
6
6
3s
3s
2
2
3p
3p
6
6
3d
3d
10
10
4s
4s
2
2
4p
4p
5
5
Brom là phi kim điển hình, có 7e ở lớp
ngoài cùng.
Khuynh hướng: dễ dàng nhận thêm 1e để
đạt cấu hình bền của khí trơ gần nó nhất
thể hiện tính oxi hóa.
Brom là chất oxi hóa mạnh nhưng yếu
Brom là chất oxi hóa mạnh nhưng yếu
hơn clo.
hơn clo.
TÍNH CHẤT HÓA HỌC
TÍNH CHẤT HÓA HỌC
10
@ Tác dụng với kim loại:
Brom tác dụng trực tiếp với nhiều kim loại, các
phản ứng đều tỏa nhiều nhiệt.
Nhôm phản ứng với brom. Phản ứng xảy ra ở nhiệt độ
thường và kèm theo tỏa nhiệt mạnh.
2Al + 3Br
2
2AlBr
3
0
+3
0
-1