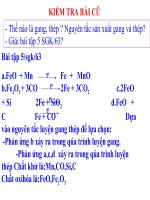Sự ăn mòn kim loại trong hóa học
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (871.5 KB, 26 trang )
TRƯỜNG ĐẠI HỌC THỦ DẦU MỘT
KHOA KHOA HỌC TỰ NHIÊN
KỸ THUẬT PHẢN ỨNG HÓA HỌC
Ths. Ngô Thanh Liêm
LỚP D13HPT01
NHÓM 10
1
CHỦ ĐỀ:
SỰ ĂN MÒN KIM LOẠI
NHÓM 10
1.
2.
LỚP D13HPT01
LÂM THỊ MỸ HỒNG
PHẠM THỊ HÒA
NHÓM 10
2
SỰ ĂN MÒN KIM LOẠI
Hãy quan sát những đồ dùng, thiết bị sau và nhận xét
trạng thái của chúng !
LỚP D13HPT01
NHÓM 10
3
SỰ ĂN MÒN KIM LOẠI
LỚP D13HPT01
NHÓM 10
4
SỰ ĂN MÒN KIM LOẠI
• TẠI SAO KIM LOẠI BỊ ĂN MÒN ???
LỚP D13HPT01
NHÓM 10
5
NỘI DUNG
LỚP D13HPT01
NHÓM 10
6
SỰ ĂN MÒN KIM LOẠI
1.
•.
Sự ăn mòn kim loại là gì ???
Ăn mòn kim loại là sự phá huỷ kim loại hoặc
hợp kim do tác dụng của các chất trong môi
trường xung quanh.
•.
Cơ chế của sự ăn mòn kim loại:
Kim loại bị oxi hoá thành ion dương bởi các
quá trình hoá học hoặc điện hoá.
M Mn+ + ne
LỚP D13HPT01
NHÓM 10
7
SỰ ĂN MÒN KIM LOẠI
Việc phân loại thông thường của sự ăn mòn là theo môi trường mà kim loại
được tiếp xúc hoặc các phản ứng thực tế xảy ra
LỚP D13HPT01
NHÓM 10
8
SỰ ĂN MÒN KIM LOẠI
2. Phân loại sự ăn mòn kim loại:
•
Ăn mòn hóa học: là sự phá hủy kim loại do kim loại pư hóa học với chất khí hoặc
hơi nước ở nhiệt độ cao.
•
Ví dụ:
(1)
2Fe
+ 3Cl2
2FeCl3
(2)
3Fe
+ 4H2O
Fe3O4 + 4H2
(3)
3Fe
+
Fe3O4
2O2
(chất khử) (chất oxi hóa)
LỚP D13HPT01
NHÓM 10
9
SỰ ĂN MÒN KIM LOẠI
Bản chất của ăn mòn hoá học: là quá trình oxi khử, trong đó các e của kim loại
được chuyển trực tiếp đến các chất trong môi trường.
LỚP D13HPT01
NHÓM 10
10
SỰ ĂN MÒN KIM LOẠI
2. Phân loại sự ăn mòn kim loại:
•
•
Ăn mòn điện hóa: là sự phá hủy kim loại do hợp kim tiếp xúc với dung dịch chất
điện ly tạo nên dòng điện
Ví dụ:
Phần vỏ tàu biển chìm trong nước
LỚP D13HPT01
NHÓM 10
11
SỰ ĂN MÒN KIM LOẠI
Ăn mòn điện hóa là loại ăn mòn kim loại phổ biến và nghiêm trọng nhất
• Các điều kiện ăn mòn điện hóa:
Các điện cực phải khác chất nhau. Trong đó kim loại có tính khử mạnh hơn sẽ
là cực âm.
Các điện cực phải tiếp xúc với nhau
Các điện cực cùng tiếp xúc với một dung dịch chất điện ly.
LỚP D13HPT01
NHÓM 10
12
SỰ ĂN MÒN KIM LOẠI
•
Cơ chế ăn mòn điện hóa: gồm 3 quá trình cơ bản :
Quá trình Anot: là quá trình oxi hóa điện hóa, trong đó kim loại chuyển vào dung
dịch dưới dạng cation Mez+ và giải phóng điện từ: kim loại bị ăn mòn
Me Men+ + n.e
LỚP D13HPT01
NHÓM 10
13
SỰ ĂN MÒN KIM LOẠI
Quá trình Catot: là quá trình khử điện hóa, trong đó chất oxi hóa nhận điện tử do
kim loại bị ăn mòn nhường cho điện tử.
Ox + z.e -> Red
Red: dạng khử liên hợp của Ox ( tức Ox.ze)
Quá trình dẫn điện: các điện tử do các kim loại bị ăn mòn giải phóng sẽ từ anot
đến catot, còn các ion di chuyển trong dung dịch.
LỚP D13HPT01
NHÓM 10
14
SỰ ĂN MÒN KIM LOẠI
Như vậy, quá trình ăn mòn kim loại xảy ra đồng thời với sự xuất hiện dòng điện
giữa hai cực khác nhau của kim loại.
LỚP D13HPT01
Vùng kim loại bị hòa tan đóng vai trò cực dương (+) anot
Vùng kia đóng vai trò cực âm (-) catot.
Ví dụ: Sự ăn mòn của Zn trong dung dịch H2SO4
NHÓM 10
15
SỰ ĂN MÒN KIM LOẠI
Zn
Cu
dd H2SO 4
Khi chưa nối dây dẫn, lá Zn bị hoà
tan chậm và bọt khí H2 thoát ra
trên bề mặt lá Zn.
LỚP D13HPT01
Khi nối dây dẫn:
+ lá Zn bị ăn mòn nhanh
+ kim điện kế bị lệch.
+ bọt khí thoát ra ở cả lá Cu.
NHÓM 10
16
SỰ ĂN MÒN KIM LOẠI
Zn
Cu
2+
Zn dd H2SO4
+
H
Zn bị ăn mòn hoá học:
+
2+
Zn + 2H Zn + H2
Hình thành pin điện hoá
•Cực âm: lá Zn: Zn Zn2+ + 2e
•Cực dương: lá Cu: 2H+ + 2e H2
Phản ứng chung:
Zn + 2H
+
Zn
2+
+ H2
Kết quả: Lá Zn bị ăn mòn nhanh đồng thời với sự tạo thành dòng điện.
LỚP D13HPT01
NHÓM 10
17
SỰ ĂN MÒN KIM LOẠI
LỚP D13HPT01
NHÓM 10
18
SỰ ĂN MÒN KIM LOẠI
•
Bản chất kim loại:
Tính chống gỉ của kim loại còn liên quan đến hàm lượng tạp chất và độ bóng của
nó. Tạp chất của kim loại càng nhiều tính chống gỉ càng kém. Độ bóng kim loại
càng cao, tính chống gỉ càng tốt.
LỚP D13HPT01
NHÓM 10
19
SỰ ĂN MÒN KIM LOẠI
•
Nhiệt độ:
Nhiệt độ ảnh hưởng rất lớn tới sự ăn mòn. Nhiệt độ càng cao, hoạt độ hóa học của
kim loại và dung dịch tăng, do đó làm tăng sự ăn mòn.
LỚP D13HPT01
NHÓM 10
20
SỰ ĂN MÒN KIM LOẠI
•
Môi trường xung quanh
Tính chống gỉ của nguyên liệu có quan hệ trực tiếp tới môi trường ăn mòn. Trong
những môi trường khác nhau, tính ổn định của kim loại cũng khác nhau.
LỚP D13HPT01
NHÓM 10
21
SỰ ĂN MÒN KIM LOẠI
4. Tốc độ ăn mòn kim loại: có thể đo bằng các đại lượng sau:
•
•
Tổn thất trọng lượng là trọng lượng kim loại bị ăn mòn trên đơn vị bề mặt trong 1
đơn vị thời gian:
P = (m1 - m2)/S.t
Trong đó,
m1, m2 là trọng lượng mẫu kim loại trước và sau khi bị ăn mòn (mg)
S: diện tích bề mặt kim loại (dm2)
t : thời gian (s)
LỚP D13HPT01
NHÓM 10
22
SỰ ĂN MÒN KIM LOẠI
•
Độ thâm nhập P : tính bằng chiều sâu trung bình kim loại bị ăn mòn trong một
năm.
P = 8.67G/p
•
Trong đó,
2
G: lượng vật liệu bị ăn mòn ( g/m .h)
3
p khối lượng riêng của kim loại (kg/m )
LỚP D13HPT01
NHÓM 10
23
SỰ ĂN MÒN KIM LOẠI
LỚP D13HPT01
NHÓM 10
24
TÀI LIỆU THAM KHẢO
•
•
Apply chemistry- chapter 10 />
LỚP D13HPT01
NHÓM 10
25