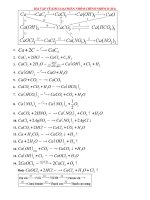phoung phap giai bai tap ve kim loai
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (148.88 KB, 5 trang )
Chuyªn ®Ò: vÒ kim lo¹i Al, Zn hîp chÊt lìng tÝnh
A. KIM LOẠI TÁC DỤNG VỚI BAZƠ VÀ BÀI TOÁN LƯỠNG
TÍNH:
Cần chú ý đến 2 kim loại sau: Al, Zn. Phương trình phản ứng khi tác dụng với bazơ:
Al + NaOH + H
2
O → NaAlO
2
+
2
3
H
2
Zn + 2NaOH → Na
2
ZnO
2
+ H
2
- Oxit của 2 kim loại này đóng vai trò là oxit acid và tác dụng với bazơ như sau:
Al
2
O
3
+ 2NaOH → 2NaAlO
2
+ H
2
O
ZnO + 2NaOH → Na
2
ZnO
2
+ H
2
O
- Hidroxit(bazơ) của 2 kim loại này đóng vai trò là acid và tác dụng với bazơ như sau:
Al(OH)
3
+ NaOH → NaAlO
2
+ 2H
2
O
Zn(OH)
2
+ 2NaOH → Na
2
ZnO
2
+ 2H
2
O
- Kết tủa Al(OH)
3
tan trong dung dịch kiềm mạnh và acid nhưng không tan
trong dung dịch kiềm yếu như dung dịch NH
3
. Kết tủa Zn(OH)
2
tan lại trong dung
dịch NH
3
do tạo phức chất tan. Ví dụ: Al
2
(SO
4
)
3
+ 6NH
3
+ 6H
2
O →
2Al(OH)
3
+ 3(NH
4
)
2
SO
4
- Do đó khi cho muối của một kim loại có hidroxit lưỡng tính tác dụng với dung dịch
kiềm, lượng kết tủa sẽ được tạo thành theo 2 hướng:
+ Lượng kiềm dùng thiếu hoặc vừa đủ nên chỉ có một phần muối đã phản ứng.
Nghĩa là có sự tạo kết tủa Al(OH)
3
, HOẶC Zn(OH)
2
nhưng kết tủa không bị tan lại.
+ Lượng kiềm dùng dư nên muối đã phản ứng hết để tạo kết tủa tối đa sau đó
kiềm hòa tan một phần hoặc hòan toàn kết tủa.
Thường sẽ có 2 đáp số về lượng kiềm cần dùng.
a. Khi có anion MO
2
(4-n)-
với n là hóa trị của M: Ví dụ: AlO
2
-
, ZnO
2
2-
…
Các phản ứng sẽ xảy ra theo đúng thứ tự xác định:
Thứ nhất: OH
-
+ H
+
→ H
2
O
- Nếu OH
-
dư, hoặc khi chưa xác định được OH
-
có dư hay không sau phản ứng tạo
MO
2
(4-n)-
thì ta gỉa sử có dư
Thứ hai: MO
2
(4-n)-
+ (4-n)H
+
+ (n-2)H
2
O → M(OH)
n
- Nếu H
+
dư sau phản ứng thứ hai thì có phản ứng tiếp theo, khi chưa xác định được
H
+
có dư hay không sau phản ứng tạo M(OH)
n
thì ta giả sử có dư
Thứ ba: M(OH)
n
+ nH
+
→ M
n+
+ nH
2
O
b. Khi có cation M
n+
: Ví dụ: Al
3+
, Zn
2+
…
- Nếu đơn giản thì đề cho sẵn ion M
n+
; phức tạp hơn thì cho thực hiện phản ứng tạo
M
n+
trước bằng cách cho hợp chất chứa kim loại M hoặc đơn chất M tác dụng với H
+
,
rồi lấy dung dịch thu được cho tác dụng với OH
-
. Phản ứng có thể xảy ra theo thứ tự
xác định :
Thứ nhất: H
+
+ OH
-
→ H
2
O (nếu có H
+
- Khi chưa xác định được H
+
có dư hay không sau phản ứng thì ta gỉa sử có dư.
Thứ hai: M
n+
+ nOH
-
→ M(OH)
n
- Nếu OH
-
dư sau phản ứng thứ hai, hoặc khi chưa xác định chính xác lượng OH
-
sau
phản ứng thứ hai thì ta giả sử có dư.
Thứ ba: M(OH)
n
+ (4-n)OH
-
→ MO
2
(4-n)-
+ 2H
2
O
Gi¸o viªn : trÇn h÷u tuyÕn - trêng thpt – vò quang 1
Chuyªn ®Ò: vÒ kim lo¹i Al, Zn hîp chÊt lìng tÝnh
- Nếu đề cho H
+
(hoặc OH
-
dư thì không bao giờ thu được kết tủa M(OH)
n
vì lượng
M(OH)
n
ở phản ứng thứ hai luôn bị hòa tan hết ở phản ứng thứ ba, khi đó kết tủa cực
tiểu; còn khi H
+
hoặc (OH
-
) hết sau phản ứng thứ hai thì phản ứng thứ ba sẽ không xảy
ra kết tủa không bị hòa tan và kết tủa đạt gía trị cực đại.
Câu 1: Cho 3,42gam Al
2
(SO
4
)
3
tác dụng với 25 ml dung dịch NaOH tạo ra được 0,78
gam kết tủa. Nồng độ mol của NaOH đã dùng là?(Na=23;Al=27;S=32;O=16)
A. 1,2M B. 2,8M C. 1,2 M và 4M D. 1,2M hoặc
2,8M
Câu 2: Cho 150 ml dung dịch NaOH 7M tác dụng với 100 ml dung dịch Al
2
(SO
4
)
3
1M
. Xác định nồng độ mol/l NaOH trong dung dịch sau phản ứng.
(Na=23;Al=27;S=32;O=16)
A. 1M B. 2M C. 3M D. 4M
Câu 3: Trong một cốc đựng 200ml dung dịch AlCl
3
2M. Rót vào cốc Vml dung dịch
NaOH có nồng độ a mol/lít, ta được một kết tủa; đem sấy khô và nung đến khối lượng
không đổi được 5,1g chất rắn. Nếu V= 200ml thì a có giá trị nào?
(Na=23;Al=27;Cl=35,5;O=16;H=1)
A. 2M B. 1,5M hay 3M C. 1M hay 1,5M D. 1,5M hay
7,5M
Câu 4: Hoà tan a(g) hỗn hợp bột Mg- Al bằng dung dịch HCl thu được 17,92 lit khí
H
2
(đktc). Cùng lượng hỗn hợp trên hoà tan trong dung dịch NaOH dư thu được 13,44
lít khí H
2
( đkc). a có giá trị là: (Mg=24;Al=27;H=1;Cl=35,5;Na=23)
A. 3,9 B. 7,8 C. 11,7 D. 15,6
Câu 5: Cho a mol AlCl
3
vào 200g dung dịch NaOH 4% thu được 3,9g kết tủa. Giá trị
của a là: (Al=27;Na=23;Cl=35,5;O=16;H=1)
A. 0,05 B. 0,0125 C. 0,0625 D 0,125
Câu 6: Cho 200ml dung dịch H
2
SO
4
0,5M vào một dung dịch có chứa a mol NaAlO
2
được 7,8g kết tủa. Giá trị của a là: (Na=23;Al=27;S=32;O=16)
A. 0,025 B. 0,05 C. 0,1 D. 0,125
Câu 7: Cho 18,6 gam hỗn hợp gồm Zn và Fe tác dụng vừa đủ với 7,84 lít Cl
2
(đktc).
Lấy sản phẩm thu được hòa tan vào nước rồi cho tác dụng với dung dịch NaOH 1M.
Thể tích NaOH cần dùng để lượng kết tủa thu được là lớn nhất và nhỏ nhất lần lượt
là?(Zn=65;Fe=56;Na=23;O=16;H=1)
A. 0,7 lít và 1,1 lít B. 0,1 lít và 0,5 lít C. 0,2 lít và 0,5 D. 0,1 lít
và 1,1
Câu 8: Có một dung dịch chứa 16,8g NaOH tác dụng với dung dịch có hòa tan 8 gam
Fe
2
(SO
4
)
3
. Sau đó lại thêm vào 13,68gam Al
2
(SO
4
)
3
. Từ các phản ứng ta thu được
dung dịch A có thể tích 500ml và kết tủa. Nồng độ mol các chất trong dung dịch A là?
(Al=27;Fe=56;Na=23;O=16;H=1)
A. [Na
2
SO
4
=0,12M], [NaAlO
2
=0,12M] B. [NaOH=0,12M],
[NaAlO
2
=0,36M]
C. [NaOH=0,6M], [NaAlO
2
=0,12M] D. [Na
2
SO
4
=0,36M],
[NaAlO
2
=0,12M]
Gi¸o viªn : trÇn h÷u tuyÕn - trêng thpt – vò quang 2
Chuyªn ®Ò: vÒ kim lo¹i Al, Zn hîp chÊt lìng tÝnh
Câu 9: Hòa tan 21 gam hỗn hợp gồm Al và Al
2
O
3
bằng HCl được dung dịch A và
13,44 lít H
2
(đktc). Thể tích dung dịch (lít) NaOH 0,5M cần cho vào dung dịch A để
thu được 31,2 gam kết tủa là? (Al=27;Na=23;Cl=35,5;O=16;H=1)
A. 2,4 B. 2,4 hoặc 4 C. 4 D. 1,2 hoặc 2
Câu 10: Hòa tan 3,9 gam Al(OH)
3
bằng 50ml NaOH 3M được dung dịch A. Thể tích
dung dịch(lít) HCl 2M cần cho vào dung dịch A để xuất hiện trở lại 1,56 gam kết tủa
là? (Al=27;Na=23;Cl=35,5;O=16;H=1)
A. 0,02 B. 0,24 C. 0,06 hoặc 0,12 D. 0,02 hoặc
0,24
Câu 11: 200 ml gồm MgCl
2
0,3M; AlCl
3
0,45 M; HCl 0,55M tác dụng hoàn toàn với
V(lít) gồm NaOH 0,02M và Ba(OH)
2
0,01M. Gía trị của V(lít) để được kết tủa lớn
nhất và lượng kết tủa nhỏ nhất là?
(Al=27;Na=23;Cl=35,5;O=16;H=1;Mg=24;Ba=137)
A. 1,25lít và 1,475lít B. 1,25lít và 14,75lít
C. 12,5lít và 14,75lít D. 12,5lít và 1,475lít
Câu 12: Cho m gam hỗn hợp X gồm Na
2
O và Al
2
O
3
tác dụng với H
2
O cho phản ứng
hoàn toàn thu được 200 ml dung dịch A chỉ chứa một chất tan duy nhất có nồng độ
0,5M. Thổi khí CO
2
dư vào dung dịch A được a gam kết tủa. Gía trị của m và a là?
(Al=27;Na=23;O=16;H=1)
A. 8,2g và 78g B. 8,2g và 7,8g C. 82g và 7,8g D. 82g và 78g
Câu 13: Rót 150 ml dung dịch NaOH 7M vào 50 ml dung dịch Al
2
(SO
4
)
3
. Tìm khối
lượng chất dư sau thí nghiệm: (Al=27;Na=23;O=16;H=1;S=32)
A. 16g B. 14g C. 12g D. 10g
Câu 14: Cho 8 gam Fe
2
(SO
4
)
3
vào bình chứa 1 lít dung dịch NaOH a M, khuấy kĩ để
phản ứng xảy ra hoàn toàn; tiếp tục thêm vào bình 13,68g Al
2
(SO
4
)
3
. Cuối cùng thu
được 1,56 gam kết tủa keo trắng. Tính giá trị nồng độ a?
(Al=27;Fe=56;Na=23;O=16;H=1;S=32)
A. 0,2M B. 0,4M C. 0,38M D. 0,42M
Câu 15: Hòa tan 5,34gam nhôm clorua vào nước cho đủ 200ml dung dịch. Thêm tiếp
dung dịch NaOH 0,4M vào dung dịch trên, phản ứng xong thu được 1,56 gam kết tủa.
Nồng độ mol dung dịch HNO
3
là? (Al=27;Na=23;Cl=35,5;O=16;H=1)
A. 0,6M và 1,6M B. 1,6M hoặc 2,4M
C. 0,6M hoặc 2,2M D. 0,6M hoặc 2,6M
Câu 16: Cho 200Ml dung dịch AlCl
3
1,5M tác dụng với V lít dung dịch NaOH 0,5M,
lượng kết tủa thu được là 15,6 gam. Gía trị lớn nhất của V là?(H=1;O=16;Al=27)
A. 1,2 B. 1,8 C. 2,4 D. 2
(Câu 7 ĐTTS Đại học khối B năm 2007)
Câu 17: Thêm m gam Kali vào 300ml dung dịch chứa Ba(OH)
2
0,1M và NaOH 0,1M
thu được dung dịch X. Cho từ từ dung dịch X vào 200ml dung dịch Al
2
(SO
4
)
3
0,1M
thu được kết tủa Y. Để thu được lượng kết tủa Y lớn nhất thì gía trị của m là?
(H=1;O=16;Na=23;Al=27;S=32;K=39;Ba=137)
A. 1,59 B. 1,17 C. 1,71 D. 1,95
(Câu 21 ĐTTS Cao đẳng khối A năm 2007)
Câu 18: Hỗn hợp X gồm Na và Al. Cho m gam X vào một lượng dư nước thì thóat ra
V lít khí. Nếu cũng cho m gam X vào dung dịch NaOH(dư) thì được 1,75V lít khí.
Gi¸o viªn : trÇn h÷u tuyÕn - trêng thpt – vò quang 3
Chuyªn ®Ò: vÒ kim lo¹i Al, Zn hîp chÊt lìng tÝnh
Thành phần % theo khối lượng của Na trong X là (biết các thể tích khí đo trong cùng
điều kiện; Na=23;Al=27)
A. 39,87% B. 77,31% C. 49,87% D. 29,87%
(Câu 21 ĐTTS Đại học khối B năm 2007)
Câu 19: Cho dung dịch NaOH 0,3M vào 200 ml dung dịch Al
2
(SO
4
)
3
0,2M thu được
một kết tủa trắng keo. Nung kết tủa này đến khối lượng lượng không đổi thì được
1,02g rắn. Thể tích dung dịch NaOH là bao nhiêu? (Al=27;Na=23;S=32;O=16;H=1)
A. 0,2lít và 1 lít B. 0,2lít và 2 lít
C. 0,3 lít và 4 lít D. 0,4 lít và 1 lít
Câu 20: Khi cho 130 ml AlCl
3
0,1M tác dụng với 20 ml dung dịch NaOH, thì thu
được 0,936gam kết tủa. Nồng độ mol/l của NaOH là?
(Al=27;Na=23;Cl=35,5;O=16;H=1)
A. 1,8M B. 2M C. 1,8M và 2M D. 2,1M
B. BÀI TOÁN NHIỆT NHÔM:
Thường gặp là phản ứng nhiệt nhôm: Gọi a là số mol của Al; b là số mol của oxit sắt.
(Fe
2
O
3
)
2Al + Fe
2
O
3
→ Al
2
O
3
+ 2Fe
I. Nếu phản ứng xảy ra hoàn toàn: Thường do không biết số mol Al và Fe
2
O
3
là bao
nhiêu nên phải xét đủ 3 trường hợp rồi tìm nghiệm hợp lí:
1. Trường hợp 1: Al và Fe
2
O
3
dùng vừa đủ: 2Al + Fe
2
O
3
→ Al
2
O
3
+ 2Fe
a →
2
a
→
2
a
→ a
Hỗn hợp sau phản ứng: Fe: a mol; Al
2
O
3
:
2
a
mol
2. Trường hợp 2: Al dùng dư: 2Al + Fe
2
O
3
→ Al
2
O
3
+ 2Fe
2b → b → b → 2b
Hỗn hợp sau phản ứng: Fe: 2b mol; Al
2
O
3
: b mol; Al
dư
: (a-2b) mol. Điều kiện: (a-
2b>0)
3. Trường hợp 3: Fe
2
O
3
dùng dư: 2Al + Fe
2
O
3
→ Al
2
O
3
+ 2Fe
a →
2
a
→
2
a
→ a
Hỗn hợp sau phản ứng: Fe: a mol; Al
2
O
3
:
2
a
; Fe
2
O
3
: (b-
2
a
)mol. Điều kiện: (b-(
2
a
>0)
II. Nếu phản ứng xảy ra không hoàn toàn:
Gọi x là số mol Fe
2
O
3
tham gia phản ứng
2Al + Fe
2
O
3
→ Al
2
O
3
+ 2Fe
2x → x → x → 2x
Hỗn hợp sau phản ứng: Fe: 2x mol; Al
2
O
3
: x mol; Fe
2
O
3
dư: (b-x)mol; Al dư: (a-
2x)mol
Chú ý: Nếu đề yêu cầu tính hiệu suất phản ứng ta giải trường hợp phản ứng xảy
ra không hoàn toàn.
Gi¸o viªn : trÇn h÷u tuyÕn - trêng thpt – vò quang 4
Chuyên đề: về kim loại Al, Zn hợp chất lỡng tính
Cõu 21: Trn 10,8 gam bt nhụm vi 34,8g bt Fe
3
O
4
ri tin hnh phn ng nhit
nhụm thu c hn hp A. hũa tan ht A bng HCl thu c 10,752 lớt H
2
(ktc). Hiu
sut phn ng nhit nhụm v th tớch dung dch HCl 2M cn dựng l?
A. 80% v 1,08lớt B. 20% v 10,8lớt
C. 60% v 10,8lớt D. 40% v 1,08lớt
Cõu 22: nung hn hp A gm Al, Fe
2
O
3
c hn hp B (hiu sut 100%). Hũa tan
ht B bng HCl d c 2,24 lớt khớ (ktc), cng lng B ny nu cho phn ng vi
dung dch NaOH d thy cũn 8,8g rn C. Khi lng cỏc cht trong A l?
A. m
Al
=2,7g, mFe
2
O
3
=1,12g B. m
Al
=5,4g, mFe
2
O
3
=1,12g
C. m
Al
=2,7g, mFe
2
O
3
=11,2g D. m
Al
=5,4g, mFe
2
O
3
=11,2g
Cõu 23: Hn hp A gm 0,56g Fe v 16g Fe
2
O
3
m (mol) Al ri nung nhit cao
khụng cú khụng khớ c hn hp D. Nu cho D tan trong H
2
SO
4
loóng c v(lớt)
khớ nhng nu cho D tỏc dng vi NaOH d thỡ thu c 0,25V lớt khớ. Gớa tr ca m
l?
A. 0,1233 B. 0,2466 C. 0,12 D. 0,3699
Cõu 24: Cú 26,8g hn hp bt nhụm v Fe
2
O
3
. Tin hnh nhit nhụm cho ti hon
ton ri hũa tan ht hn hp sau phn ng bng dung dch HCl c 11,2 lớt H
2
(ktc).
Khi lng cỏc cht trong hn hp ban u l?
A. m
Al
=10,8g;m
32
OFe
=1,6g B. m
Al
=1,08g;m
32
OFe
=16g
C. m
Al
=1,08g;m
32
OFe
=16g D. m
Al
=10,8g;m
32
OFe
=16g
Cõu 25: Hn hp X gm Al v Fe
2
O
3
. Ly 85,6gam X em nung núng thc hin
phn ng nhit nhụm, sau mt thi gian thu c m gam cht rn Y. Chia Y lm 2
phn bng nhau:
- Phn 1: Hũa tan trong dung dch NaOH d thy thoỏt ra 3,36lớt khớ (ktc) v
cũn li m
1
gam cht khụng tan.
- Phn 2: Hũa tan ht trong dung dch HCl thy thoat ra 10,08 lớt khớ (ktc). Phn
trm khi lng Fe trong Y l?
A. 18% B. 39,25% C. 19,6% D. 40%
Cõu 26: Hn hp X gm Al v Fe
2
O
3
. Ly 85,6gam X em nung núng thc hin
phn ng nhit nhụm, sau mt thi gian thu c m gam cht rn Y. Chia Y lm 2
phn bng nhau:
- Phn 1: Hũa tan trong dung dch NaOH d thy thoỏt ra 3,36lớt khớ (ktc) v
cũn li m
1
gam cht khụng tan.
- Phn 2: Hũa tan ht trong dung dch HCl thy thoat ra 10,08 lớt khớ (ktc). Thnh
phn cht rn Y gm cỏc cht l?
A. Al, Fe
2
O
3
, Fe, Al
2
O
3
B. Al, Fe, Al
2
O
3
C. Fe, Al
2
O
3
D. C A, C
ỳng.
Giáo viên : trần hữu tuyến - trờng thpt vũ quang 5