Cấu hình electron của nguyên tử
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (43.56 KB, 2 trang )
Tiết 9 cấu hình electron của nguyên tử
Ngày soạn:
Ngày giảng:
I. Mục tiêu:
1) Kiến thức:
- Học sinh biết đợc thứ tự các mức năng lợng trong nguyên tử.
- Sự phân bố electron trên các lớp, phân lớp.
- Cấu hình electron nguyên tử của 20 nguyên tố đầu tiên trong bảng tuần hoàn.
- Đặc điểm của lớp electron ngoài cùng: Lớp ngoài cùng nhiều nhất có 8
electron, các nguyên tử Kim loại có 1,2,3 e ở lớp ngoài cùng, các nguyên tử phi kim có
5, 6, 7 e ở lớp ngoài cùng.
2) Kĩ năng:
- Viết cấu hình electron nguyên tử của một số nguyên tố hoá học.
- Dựa vào cấu hình electron lớp ngoài cùng để suy ra tính chất hoá học cơ bản.
3) Thái độ:
- Phát triển t duy logic.
II. Chuẩn bị.
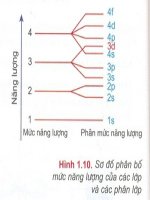
Gv: - Sơ đồ phân bố mức năng lợng của các lớp và phân lớp electron.
III. Tổ chức các bớc lên lớp:
1) ổn định lớp.
2) Kiểm tra bài cũ:
- Natri có kí hiệu:
23
11
Na. Hãy xác định số lớp của Na? Số electron trên mỗi lớp?
3) Bài mới:
Hoạt động của GV và HS Nội dung Tg
I. Thứ tự các mức năng lợng trong
nguyên tử:
Nx: -ở trạng thái cơ bản, các electron
chiếm các mức năng lợng từ thấp đến
cao.
Mức NL của lớp Mức NL của phân lớp
Tăng từ 1 đến 7 Tăng theo thứ tự: s, p, d, f.
- Thứ tự các mức năng lợng:
1s2s2p3s3p4s3d4p5s4f5p....
II.Cấu hình electron của nguyên tử:
1)Cấu hình electron:
*KN: Sgk
Ví dụ:
H(z = 1): 1s
1
He(z = 2): 1s
2
Li(z = 3): 1s
2
2s
1
.
N(z = 7): 1s
2
2s
2
2p
3
.
Na(z = 11): 1s
2
2s
2
2p
6
3s
1
.
2)Nguyªn tè s, p, d, f:
H(z = 1): 1s
1
Nguyªn tè s
Li(z = 3): 1s
2
2s
1
. Nguyªn tè s
N(z = 7): 1s
2
2s
2
2p
3
.
Nguyªn tè p
3)§Æc ®iÓm cña electron líp ngoµi cïng.
Sè e líp
ngoµi cïng
1, 2, 3 4 5, 6, 7 8
§Æc ®iÓm Kim lo¹i
KL HoÆc
PK
Phi kim KhÝ hiÕm
VÝ dô:
N(z = 7): 1s
2
2s
2
2p
3
.
Phi kim
Na(z = 11): 1s
2
2s
2
2p
6
3s
1
. Kim lo¹i
Ne(z = 10): 1s
2
2s
2
2p
6
. KhÝ hiÕm.
4) Cñng cè – dÆn dß:
- NhÊn m¹nh c¸ch viÕt cÊu h×nh electron, ®Æc ®iÓm cña electron líp ngoµi cïng.
- BTVN: 3, 4, 5, 6(28-Sgk)
---------------------------------------------- -