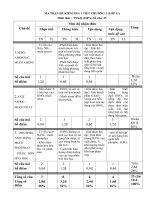
BẢNG MÔ TẢ CHƯƠNG IV HÓA HỌC LỚP 8
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (87.56 KB, 10 trang )
BẢNG MÔ CHƯƠNG IV: OXI – KHÔNG KHÍ
HOÁ HỌC LỚP: 8
I. MỤC TIÊU
Kiến thức:
Biết được
* Tính chất của oxi
- Tính chất vật lý của oxi: Trạng thái, màu sắc, mùi, tính tan trong nước, tỉ khối so với không khí.
- Tính chất hoá học của oxi: Oxi là phi kim hoạt động hoá học mạnh đặt biệt ở nhiệt độ cao; tác dụng hầu hết kim loại (Fe,
Cu … ), nhiều phi kim (S, P … ) và hợp chất (CH4 … ). Hoá trị của oxi trong các hợp chất thường bằng II.
* Sự oxi hoá- phản ứng hoá hợp
- Sự oxi hoá là sự tác dụng của oxi với một chất khác.
- Khái niệm phản ứng hoá hợp
- Ứng dụng của oxi trong đời sống và sản xuất
* Oxit
- Định nghĩa về oxit.
- Cách lập được CTHH của oxit và cách gọi tên.
- Khái niệm về oxit axit, oxit bazơ.
* Điều chế oxi – Phản ứng phân huỷ
- Phương pháp điều chế oxi trong phòng thí nghiệm ( cách thu khí oxi) và trong công nghiệp.
- Khái niệm phản ứng phân huỷ
* Không khí và sự cháy
- Thành phần của không khí theo thể tích và khối lượng.
- Khái niệm về sự oxi chậm và sự cháy.
- Điều kiện phát sinh sự cháy và dập tắt sự cháy.
- Sự ô nhiễm không khí và cách bảo vệ không khí khỏi bị ô nhiễm.
Kĩ năng
- Quan sát thí nghiệm, giải thích hiện tượng về tính chất của oxi.
- Viết được PTHH và phân loại phản ứng hoá học
- Tính được thể tích chất khí ở đktc hoặc khối lượng chất tham gia và sản phẩm.
- Phân loại, lập CTHH và gọi tên các oxit hoặc ngược lại
Thái độ
- Tự tin thực hiện các thí nghiệm trong môn học.
- Ham thích nghiên cứu khám phá bộ môn.
II. Năng lực chuyên biệt.
- Năng lực sử dụng ngôn ngữ hoá học
- Năng lực thực hành thí nghiệm hoá học
- Năng lực tính toán hoá học
- Năng lực giải quyết vấn đề
- Năng lực vận dụng kiến thức hoá học vào thực tiễn cuộc sống
III. Bảng mô tả các mức yêu cầu cần đạt.
Loại câu
Nhận biết
hỏi/bài tập
- Tính chất Câu hỏi/bài - Nhận diện ôxy bằng
KHHH, CTHH.
của oxi
tập định tính
- Biết được ôxy có ở
đâu?
- Biết được các tính chất
vật lý cơ bản của ôxy.
NỘI DUNG
Thông hiểu
- Hiểu được ôxy là đơn
chất phi kim rất hoạt động
đặc biệt ở nhiệt độ cao.
- Viết được các PTHH
biểu diễn phản ứng của
ôxy với một số chất khác
- Biết được các tính chất (Kim loại, phi kim và hợp
hoá học của ôxy.
chất).
- Viết được các phản ứng
- Viết được các PTHH hoá hợp.
biểu diễn các thí nghiệm.
- Biết được sự oxi hoá và
Vận dụng thấp
Vận dụng cao
- Sự oxi hoá
– phản úng
hoá hợp ứng
dụng của oxi
- Oxit
phản ứng hoá hợp
- Biết được những ứng
dụng của oxi trong cuộc
sống
- Biết được oxit là hợp
chất và biết oxit axit, oxit
bazơ
- Viết CTHH gọi tên
- Biết được những hoá
chất điều chế oxi trong
phòng thí nghiệm và
trong công nghiệp
- Biết được cách thu khí
oxi trong phòng thí
nghiệm
- Phân biệt được phản ứng
phân huỷ và phản ứng hoá
hợp
- Biết được thành phần
của không khí theo thể
tích và khối lượng
- Biết được phát sinh và
biện pháp dập tắc sự
cháy
- Điều chế
oxi phản ứng
phân huỷ
- Phân biệt được sự cháy
và sự oxi hoá chậm
- Không khí
và sự cháy
Câu hỏi/bài
- Tính thể tích khí
oxi (đktc) tham gia
hoặc tạo thành trong
phản ứng.
tập định
lượng
- Phân loại và gọi tên
được các oxit
- Tính khối lượng
của các chất phản
ứng, sản phẩm tạo
thành và chất còn dư
trong bài toán có
lượng dư, thiếu
- Tính khối lượng
của các chất phản
ứng, sản phẩm tạo
thành và chất còn
dư trong bài toán có
lượng dư, thiếu
(hoặc có tạp chất).
- Lập được CTHH và - Tính khối lượng
phân loại gọi tên các của các chất phản
oxit
ứng, sản phẩm tạo
- Phân loại và viết
thành (liên quan đến
CTHH tương ứng với hiệu suất)
axit, bazơ của các
oxit
- Tính được thể tích
khí oxi ở đktc được
điều chế từ phòng thí
nhiệm và công
nghiệp
Câu hỏi/bài - Mô tả và nhận biết - Giải thích được các hiện
được các hiện tượng xảy tượng xảy ra trong thí
tập gắn với
ra trong thí nghiệm.
nghiệm.
THTN
- Giải thích đựợc các hiện
tượng xảy ra trong tự
nhiên liên quan đến thưc
tiễn.
Dự đoán và
- Giải thích việc sục
giải thích được không khí vào bể
hiện tượng
nuôi cá cảnh.
- Giải thích được sự
hư hỏng của kim
loại ở to thường là
do kim loại phản
ứng với ôxy.
- Giải thích đựợc sự
cháy một chất trong
bình oxi và ngoài
không khí
- Giải thích đựợc
những hiện tượng
trong cuộc sống
- Giải thích được tỉ
lệ thể tích khí oxi
trong không khí
- Những hiện tượng làm
Ô nhiễm không khí, cách
bảo vệ không khí trong
lành.
Xây dựng câu hỏi/ bài tập minh họa đánh giá theo các mức
- Giải thích được
phương pháp sản
xuất oxi từ không khí
đã mô tả
1) Mức độ nhận biết
Tính chất của oxi
Câu 1: Hãy cho biết: KHHH, CTHH, nguyên tử khối và phân tử khối của ôxy.
Câu 2: Ôxy trong không khí là đơn chất hay hợp chất?
Câu 3: Hãy nêu tính chất vật lý của khí ôxy.
Câu 4: Hãy nêu kết luận về tính chất hoá học của khí ôxy.
Câu 5: Hãy mô tả lại hiện tượng xảy ra khi đốt cháy lưu huỳnh, photpho và sắt trong ôxy. Viết PTHH của phản ứng.
Sự oxi hoá:
Câu 1: Sự oxi hoá là gì?
Câu 2: Phản ứng hoá hợp là gì?
Câu 3: Hãy nêu những ứng dụng của oxi mà em biết.
Oxit
Câu 1: Oxit là gì ?
Câu 2: Oxit axit và oxit bazơ là gì?
Câu 3: Hãy viết công thức hoá học của hai oxit axit và hai oxit bazơ gọi tên các oxit đó?
Điều chế oxi – Phản ứng phân huỷ
Câu 1: Những hoá chất nào thường dùng để điều chế oxi trong phòng thí nghiệm, vì sao ?
Câu 2: Có mấy cách để thu khí oxi trong phòng thí nghiệm ?
Câu 3: Những nguyên liệu nào để sản xuất khí oxi trong công nghiệp?
Câu 4: Phản ứng phân huỷ là gì ?
Không khí và sự cháy
Câu 1: Không khí là gì ?
Câu 2: Thành phần theo thể tích của không khí như thế nào ?
Câu 3: Điểm giống nhau và khác nhau giữa sự cháy và sự oxi hoá chậm là gì?
Câu 4: Hãy cho biết những điều kiện để phát sinh sự cháy và những biện pháp để dập tắc sự cháy ?
2) Mức độ hiểu
Tính chất của oxi
Câu 1: Cho các chất sau: CaO, CuO, H2O, SiO2.
a) Hãy chọn các chất thích hợp để điền vào chỗ trống:
Cu + O2 - - - - > . . . .
H2 + O2 - - - - > . . . .
b) Hoàn thành các PTHH trên.
Câu 2: Viết PTHH biểu diễn phản ứng cháy của khí ôxy với Al, Mg, C4H10 ở nhiệt độ cao? Biết các sản phẩm tạo thành là Al2O3,
MgO, CO2 và H2O.
Câu 3: Hãy so sánh hiện tượng xảy ra khi lưu huỳnh cháy trong không khí và trong ôxy?
Sự oxi hoá
Câu 1: Lập PTHH biễu diễn phản ứng của lưu huỳnh với Zn, Cu, Fe. Biết rằng công thức các hợp chất tạo thành là CuS, FeS,
ZnS.
Câu 2: Vì sao khi càng lên cao tỉ lệ thể tích khí oxi trong không khí càng giảm.
Oxit
Câu 1: Phân loại và gọi tên các oxit sau: P2O5, SO3, Fe2O3, Al2O3, CuO, Na2O
Câu 2: Hãy viết CTHH của hai oxit axit và hai oxit bazơ. Nhận xét về thành phần trong công thức của các oxit đó.
Điều chế oxi – Phản ứng phân huỷ
Câu 1: Sự khác nhau về việc điều chế khí oxi trong phòng thí nghiệm và trong công nghiệp về nguyên liệu, sản lượng và giá
thành ?
Câu 2: Sự khác nhau giữa phản ứng phân huỷ và phản ứng hoá hợp ? Lấy hai ví dụ để minh hoạ.
Câu 3: Người ta thu khí oxi trong phòng thí nghiệm bằng cách đẩy không khí và đẩy nước là dựa vào đặc điểm nào của khí oxi ?
Không khí và sự cháy
Câu 1: Không khí bị ô nhiễm gây ra tác hại gì ? Phải làm gì để bảo vệ không khí trong lành ?
Câu 2: Giải thích vì sao ? Muốn dập tắt ngọn lửa do xăng dầu cháy, người ta thường trùm vải dày hoặc phủ cát lên ngọn lửa, mà
không dùng nước.
Câu 3: Hãy giải thích vì sao sự cháy trong không khí xảy ra chậm hơn và toả nhiệt ít hơn so với sự cháy trong oxi.
Câu 4: Không khí là hỗn hợp gồm nhiều chất. Hiện tượng nào chứng tỏ trong không khí có:
a) Khí oxi
b) Khí cacbonic
3) Mức độ vận dụng thấp
Tính chất của oxi
Câu 1: Tính thể tích khí ôxy vừa đủ để đốt cháy hết:
a) 64 gam lưu huỳnh?
b) 9,3 gam photpho?
c) 4,48 lít khí metan (CH4)?
Cho biết các chất khí được đo ở đktc.
Câu 2: Dùng 24 gam khí ôxy (O2) để đốt cháy 6 gam cacbon (C), sản phẩm của phản ứng là khí cacbon điôxýt (CO2). Hãy tính
khối lượng của các chất sau phản ứng?
Sự oxi hoá
Câu 1: Hãy dự đoán hiện tượng và giải thích khi cho cây nến đang cháy vào một lọ thuỷ tinh rồi đậy nút kín.
Câu 2: Đốt cháy 3,24 gam bột nhôm trong bình chứa khí oxi thì thu được nhôm oxit Al2O3.
a) Viết PTHH và cho biết thuộc loại phản ứng hoá học gì
b) Tính khối lượng Al2O3 thu được?
c) Tính thể tích khí oxi phản ứng ở đktc?
Oxit
Câu 1: Một số CTHH viết như sau: NaO, CaO, Al2O , ZnO2
Hãy chỉ ra những CTHH viết sai sửa lại cho đúng.
Câu 2: Lập CTHH của hợp chất với oxi của các nguyên tố sau đây: Fe (III); Pb (IV); C (II); N (V) và gọi tên các oxit đó.
Câu 3: Phân loại các oxit sau: CO2, CuO, MgO, SO2 và viết CTHH tưng ứng với axit, bazơ của các oxit đó.
Điều chế oxi – Phản ứng phân huỷ
Câu 1: Muốn điều chế 24 gam khí oxi thì phải nung bao nhiêu gam KMnO4
Câu 2: Muốn điều chế 3,36 lít khí oxi ở (đktc) thì phải nung bao nhiêu gam KCLO3
Câu 3: Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách oxi hoá sắt ở nhiệt độ cao. Tính số gam KMnO4
cần dùng để có lượng oxi đủ điều chế được 2,32 gam Fe3O4.
Không khí và sự cháy
Câu 1: Trong một giờ người lớn hít vào trung bình 0,8 m3 không khí, cở thể giữ lại phần khí oxi chiếm 1/5 thể tích không khí.
Như vậy thực tế mỗi người trong một ngày đêm cần trung bình;
a) Một thể tích không khí là bao nhiêu ?
b) Một thể tích khí oxi là bao nhiêu ?
Biết các thể tích khí đo ở đktc.
Câu 2: Tính thể tích không khí (đktc) cần dùng để oxi hoá hết:
a) 0,15 mol C2H4
b) 0,06 mol C3H8
Biết rằng oxi chiếm 1/5 thể tích không khí.
4) Mức độ vận dụng cao
Tính chất của oxi
Câu 1: Đốt cháy thanh sắt nặng 20 gam có lẫn 20% tạp chất không cháy.
a) Tính thể tích khí ôxy cần phải dùng ở đktc?
b) Tính khối lượng Fe3O4 thu được sau phản ứng?
Câu 2: Người ta sục khí ôxy vào bể nuôi cá cảnh nhằm mục đích gì? Hãy cho biết những cơ sở sản xuất, chăn nuôi nào có vận
dụng hình thức này?
Câu 3: Vì sao một số đồ dùng bằng sắt thường bị gỉ sét khi không được sơn?
Câu 4: Vì sao các vật dụng bằng sắt ở những nơi có nhiệt độ cao (bếp đun) thường bị hư hỏng nhanh hơn?
Câu 5: Khi hàn điện có các hạt nóng chảy đỏ rực bắn ra mọi phía. Các hạt nóng chảy đó là gì? Hãy giải thích sự hình thành của
các hạt này?
Sự oxi hoá
Câu 1: Tính thể tích khí oxi cần thiết để đốt cháy hoàn khí etilen C2H4 có trong 200 cm3 khí chứa 2% tạp chất không cháy. Các
thể tích đo ở đktc.
Câu 2: Đốt cháy hỗn hợp 70 gam C và S, trong đó lưu huỳnh chiếm 91,4% ta thu được một hỗn hợp khí.
a) Viết phương trình phản ứng xảy ra
b) Tính hỗn hợp thể tích khí ở đktc.
Câu 3: Hãy giải thích vì sao khi càng lên cao thì tỉ lệ thể tích khí oxi trong không khí càng giảm ?
Oxit
Câu 1: Tỉ lệ khối lượng của nitơ và oxi trong một oxit của nitơ là 7 : 20. Tìm công thức của oxit và cho biết chúng thuộc loại
oxit gì.
Câu 2: Hãy điều chế 4 oxit. Viết phương trình phản ứng
Điều chế oxi – Phản ứng phân huỷ
Câu 1: Tính khối lượng KNO3 cần dùng để điều chế được 2,4 gam khí oxi biết hiệu suất đạt 85%
Câu 2: a) Tính hàm lượng (phần trăm theo khối lượng) oxi trong các chất sau: KMnO4, KClO3, KNO3.
c) Khi phân huỷ cùng số mol của các chất trên, có phải chất có hàm lượng oxi cao hơn sẽ cho nhiều oxi hơn không.
Không khí và sự cháy
Câu 1: Đốt cháy 2,24 lít khí metan trong 28 lít không khí (oxi chiếm 20% thể tích không khí) tao ra khí cacbonic và hơi nước.
Các chất khí đo đktc
a) Chất nào còn dư sau phản ứng thể tích là bao nhiêu.
b) Tính thể tích khí cacbonic thu được
Câu 2: Sự tăng nồng độ khí CO2 trong không khí sẽ tăng nhiệt độ của trái đất (gây hiệu ứng nhà kính). Theo em biện pháp nào
làm giảm CO2 ?