Bài 17. Phản ứng oxi hoá - khử
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (598.33 KB, 25 trang )
KÍNH CHÀO QUÝ THẦY CÔ ĐẾN
DỰ GIỜ LỚP 10A4
Người thực hiện: Huỳnh Thị Ngọc Yến
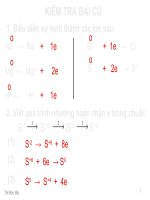
KIỂM TRA BÀI CU
Viết sơ đồ hình thành liên kết ion
trong phân tử MgO
Nhắc lại kiến thức đã học ở lớp 8
nào
- ChấtThế
nhường
oxilà
là chất
chất oxioxi
hóa
hoá, oxi
chất
khử,
- Chất chiếm
là chất
khửsự
- Sư táckhử,
dung csự
ua moxi
ôt chhoá?
ất vơi oxi là sư oxi hóa
- Sư tách oxi khoi môt chất là sư khử
sự oxi hóa
2Mg + O2 → 2MgO
Chất khử chất oxi hóa
sự khử
(1)
Bài 17:
PHẢN ỨNG OXI HOÁ - KHƯ
I. ĐỊNH NGHĨA
II. LẬP PHƯƠNG TRÌNH HOÁ HỌC CỦA PHẢN
ỨNG OXI HOÁ – KHƯ
III. Ý NGHĨA CỦA PHẢN ỨNG OXI HOÁ – KHƯ
TRONG THỰC TIỄN
I. Định nghĩa:
1. Xét các phản ứng có oxi tham gia:
2.2e
0
0
+2 –2
Thế
nào
là
chất
oxi
2Mg + O2 → 2MgO
Chất khử hoá,
chất oxi
hóa khử, quá
chất
0
+2
Mg → Mg
+ 2e khử,
: Quá trình
hoá
trình
quá oxi
trình
2e
oxi hoá?
(1)
H2 + CuO → Cu + H2O
(2)
0
+2
0
+1
Chất khử chất oxi hóa
+2
0
Cu + 2e → Cu : Quá trình khử
- Chất khử (chất bị oxi hoá) là chất nhường
electron → Số oxi hoá tăng
- Chất oxi hoá (chất bị khử) là chất thu
electron → Số oxi hoá giảm
- Quá trình oxi hoá (sự oxi hoá) là quá trình
nhường electron
- Quá trình khử (sự khử) là quá trình thu
electron
“Khử cho, O nhận
Khử tăng, O giảm”
2. Xét các phản ứng không có oxi tham gia:
Thí nghiệm: Phản ứng giữa Natri với Clo
Nguyên tử Cl
(1s22s22p63s23p5)
Nguyên tử Na
(1s22s22p63s1)
-
+
17+
11+
2 x1e
0
0
+1 -1
PTPƯ: 2Na + Cl2 → 2Na+ + 2Cl- → 2NaCl
PHIẾU HỌC TẬP
Cân bằng các phản ứng sau. Cho biết trong
phản ứng có sự cho và nhận e không? Có sự
thay đổi số oxi hoá không?
1. H2 + Cl2 → HCl
2. Fe + CuSO4 → FeSO4 + Cu
3. HgO → Hg + O2
4. FeCl2 + Cl2 → FeCl3
5. H2SO4 + NaOH → Na2SO4 + H2O
Phản ứng 1, 2, 3, 4 là phản ứng oxi hoá - khử
Sự chuyển electron trong phản
ứng oxi hoá – khử
Nguyên tử
(2)
(1)
Nguyên tử
(4)
Thế nào là phản ứng
(3)
ion
ion
oxi hoá – khử?
Vậy: Phản ứng oxi hóa - khử là phản
ứng hóa học, trong đó có sư chuyển
electron giữa các chất phản ứng, Hay
phản ứng oxi hóa - khử là phản ứng
có sư thay đổi số oxi hóa cua môt số
nguyên tố.
Ghi nhơ : Chất phản ứng
Khử cho, O nhận
Khử tăng, O giảm
Vì vậy: Trong phản ứng oxy hóa - khử
luôn diễn ra đồng thời 2 quá trình: là
sự oxy hóa và sự khử. Đó chính là vật
chất luôn luôn được bảo toàn
Câu 1. Trong phản ứng :
3NO2 + H2O → 2HNO3 + NO
NO2 đóng vai tro
A. là chất oxi hóa .
B. là chất khử.
C. là chất oxi hóa, nhưng đồng thời cũng
là chất khử.
D. không là chất oxi hóa và cũng không
là chất khử.
Câu 2:Viết các quá trình (sự) khử và
quá trình (sự) oxi hóa. Theo sơ đồ sau:
0
a) Fe
0
+3
→ Fe + 3e : Quá trình oxi hoá
-2
b) S + 2e → S
0
-2
c)O2 + 4e→ 2O
-3
•N
: Quá trình khử
: Quá trình khử
+2
→ N + 5e : Quá trình oxi hoá
13
Câu 3: Trong các phản ứng sau đây
phản ứng nào là phản ứng oxi hóa –
khử? Xác định chất khử, chất oxi hóa?
a) H2S + O2 → S + H2O
b) Na2O + H2O → NaOH
t0
c) MnO2+ HCl→ MnCl2+ Cl2+ H2O
t0
d) Cu + HNO3đ→Cu(NO3)2 + NO2 + H2O
Các pư oxi hóa – khử là: (a), (c) và (d)
–2
0
0
–2
a) H2S +
O2 → S + H2O
Chất khử chất oxi hóa
b) Na2O + H2O → NaOH
Các ngtố không có sự thay đổi số oxi hóa
+4
–1
+2
0
c)
MnO
+
HCl
→
MnCl
+Cl
+H
O
2
2
2
2
Chất oxi hóa Chất khử
0
+5
+2
+4
d)
Cu
+
HNO
đ→Cu(NO
)
+
NO
+
H
O
3
3
2
2
2
Chất khử chất oxi hóa
Hãy cân bằng các PTHH sau:
a) 2H2S + O2 → 2S + 2 H2O
2
b) Na2O + H2O → NaOH
t
4
2
c) MnO2+ HCl → MnCl2+ Cl2+ H2O
t
4
2
2
d) Cu + HNO3đ→Cu(NO3)2 + NO2 + H2O
0
0
II. Lập phương trình hoá học của
phản ứng oxi hoá – khử
Cân bằng theo phương pháp thăng
bằng electron
Nguyên tắc: Tổng số electron nhường
bằng tổng số electron nhận
Phương pháp: (gồm 4 bước)
Bước 1: Xác định số oxi hóa của những nguyên
tố trong phản ứng Chất khử? Chất oxi hoá?
(Khử tăng, O giảm)
Bước 2: Viết quá trình oxi hóa và quá trình khử,
cân bằng mỗi quá trình.
Số e nhường hoặc nhận = số oxi hoá – số oxi hoá
trước
sau
Bước 3: Tìm hệ số thích hợp sao cho:
Tổng số e nhường = tổng số e nhận.
Bước 4: Đặt hệ số vào PTHH, cân bằng theo thứ
tự: Kim loại, phi kim, hirđo, oxi
Lập phương trình hoá học của các phản
ứng oxi hoá – khử:
1. MnO2+ HCl → MnCl2+ Cl2+ H2O
2. Cu + HNO3đ→ Cu(NO3)2 + NO2 + H2O
3. Cl2 + KOH → KCl + KClO3 + H2O
4. Al + HNO3 → Al(NO3)3 + NO + N2O + H2O
5. KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Lập phương trình hoá học của các phản
ứng oxi hoá – khử:
6. Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
7. H2S + HNO3 → H2SO4 + NO + H2O
8. KMnO4 + FeSO4 + H2SO4 →
Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
9. Cu + HNO3→ Cu(NO3)2 + NO + H2O
10. Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
III. Ý Nghĩa của phản ứng oxi hoá –
khử trong thực tiển:
Một trong những quá trình quan trọng
nhất của thiên nhiên
Ví dụ: quá trình hô hấp của cây xanh,
quá trình trao đổi chất…
Các quá trình trong công nghiệp: mạ điện,
đốt cháy nhiên liệu, chế tạo hóa chất…….
Tại sao dung dịch H2S để lâu trong không khí
dần trở nên có vẩn đục màu vàng?
Protein phân hủy
H
HCl
Cl