Đề cương bài giảng hóa học hữu cơ
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (5.37 MB, 231 trang )
TRƯỜNG ĐẠI HỌC SƯ PHẠM KỸ THUẬT HƯNG YÊN
KHOA CÔNG NGHỆ HÓA HỌC & MÔI TRƯỜNG
BỘ MÔN CÔNG NGHỆ HÓA HỌC
ĐỀ CƯƠNG BÀI GIẢNG
HÓA HỌC HỮU CƠ
Người soạn: Phạm Thị Kim Thanh
Hưng Yên, tháng 12 năm 2010
1
CHƯƠNG 1: ĐẠI CƯƠNG HÓA HỌC HỮU CƠ
1.1. HÓA HỌC HỮU CƠ – CHẤT HỮU CƠ
Hóa hữu cơ là môn khoa học nghiên cứu
+ thành phần
+ tính chất các hợp chất của cacbon.
Trong thành phần các hợp chất hữu cơ ngoài cacbon còn chứa nhiều nguyên tố khác
như H, O, S, halogen…Nhưng cacbon được coi là nguyên tố cơ bản cấu tạo nên các hợp
chất hữu cơ.
1.1.1. Đặc điểm và sự phát triển của hóa học hữu cơ.
Từ thời xa xưa, người ta đã biết điều chế và sử dụng một số chất hữu cơ trong đời
sống, như dấm (dung dịch loãng của axit axetic), một số chất màu hữu cơ, biết nấu rượu
(C2H5OH)…Thời kì giả kim thuật, các nhà hóa học đã biết điều chế một số chất hữu cơ như
ete, etylic, urê…
Vào cuối thế kỷ XVIII và đầu thế kỷ XIX, các nhà hóa học đã chiết tách được từ
động, thực vật nhiều axit hữu cơ như axit oxalic, axit xitric, axit lactic…và một số bazơ hữu
cơ (ancaloid). Năm 1806 lần đầu tiên Beczelius (*) đã dùng danh từ hóa học hữu cơ để chỉ
ngành hóa học nghiên cứu các hợp chất có nguồn gốc động, thực vật. Thời gian này có thể
xem như một cái mốc đánh dấu sự ra đời của môn khoa học này.
Năm 1815, Beczelius đã đưa ra thuyết “lực sống” một luận thuyết duy tâm, cho rằng
các hợp chất hữu cơ chỉ có thể tạo ra trong cơ thể động thực vật nhờ một lực sống đặc biệt
mà bàn tay con người không thể điều chế được chúng trong các bình lọ, ống nghiệm như đối
với các chất vô cơ. Ví dụ: CH4 từ C và H2
Thuyết “lực sống” đã thống trị hóa học trong nhiều năm. Sau đó thuyết “lực sống”
dần dần bị đánh đổ nhờ các công trình tổng hợp các chất hữu cơ từ các chất vô cơ.
Năm 1824 Wholer(*) đã tổng hợp được axit oxalic, một axit hữu cơ điển hình, bằng
cách thủy phân dixian là một chất vô cơ. Năm 1828 cũng chính Wholer đã tổng hợp được
ure( vốn có trong nước tiểu của động vật) từ xyanat amoni, một chất vô cơ:
NH4CNO
H 2N - CO - NH 2
Chính phát minh này đã làm sụp đổ bức tường ngăn cách giữa hóa học vô cơ và hóa
học hữu cơ, và làm cho các nhà khoa học tin rằng có thể tự tổng hợp các hợp chất hữu cơ
trong phòng thí nghiệm mà không cần có sự tham gia của một “lực sống” nào cả.
Tiếp theo đó Bectôlê(**) đã tổng hợp được các chất béo(1854); và rồi Butlerôp(***) đã
tổng hợp đường glucozơ từ fomalin(1861).
Cho đến nay hàng triệu chất hữu cơ đã được tổng hợp ra trong phòng thí nghiệm,
trong công nghiệp. Không những con người bắt được thiên nhiên trong nhiều lĩnh vực mà
con người còn sáng tạo nên nhiều vật liệu hữu cơ cực kỳ quan trọng quý giá không có trong
thiên nhiên.
Đặc điểm của các hợp chất hữu cơ:
- Các hợp chất hữu cơ rất phong phú về số lượng, chủng loại;
2
+ mặc dù hóa học hữu cơ là một sinh sau đẻ muộn hơn hóa vô cơ hàng ngàn năm,
nhưng số chất hữu cơ đến nay đã được biết nhiều gấp vài chục lần các chất vô cơ đã biết.
+ Nguyên nhân cơ bản là do, khác với các nguyên tố khác trong bảng tuần hoàn,
cacbon có khả năng tạo thành mạch dài vô tận lại theo kiểu cách khác nhau. Nói khác đi,
hiện tượng đồng phân (tức các chất có cùng thành phần phân tử nhưng khác nhau về cấu
tạo) là cực kì phổ biến và đặc trưng trong hóa hữu cơ. Ví dụ: có thể có tới 366.319 chất có
cấu tạo khác nhau nhưng có cùng công thức phân tử là C20H42.
- Cấu trúc phân tử các hợp chất hữu cơ có thể đơn giản nhưng có thể rất phức tạp và
nói chung các hợp chất hữu cơ là vật chất có tổ chức cao hơn các chất vô cơ, việc xác định
cấu trúc của chúng là nhiệm vụ nhiều khi rất phức tạp, khó khăn phải dùng đến nhiều
phương pháp hóa học và vật lý hiện đại.
- Nếu như trong các chất vô cơ, liên kết ion khá phổ biến thì trong các hợp chất hữu
cơ, liên kết chủ yếu giữa các nguyên tử trong phân tử là liên kết cộng hóa trị.
+ Đặc điểm này ảnh hưởng nhiều đến lý, hóa tính của chúng và đặc biệt là khả năng
phản ứng của chúng.
- Các phản ứng hữu cơ:
+ tốc độ chậm
+ không triệt để
+ theo nhiều hướng khác nhau.
Vì vậy vai trò của môn nhiệt động học, động học và xúc tác trong hóa hữu cơ là rất
quan trọng.
- Các chất hữu cơ đóng vai trò cực kỳ quan trọng trong đời sống chúng ta.
+ hầu hết các thức ăn (gluxit, protit, lipit),
+ vật dụng hàng ngày ( xenlulozơ, sợi tổng hợp, cao su ,chất dẻo…)
+ cơ sở cho sự sống (protit).
+ Nhiên liệu cho động cơ đốt trong, cho nhiều nhà máy như xăng, dầu cũng là những
hydrocacbon mạch dài ngắn khác nhau.
+ Các vật liệu hữu cơ nhẹ hơn, không bị gỉ, tiện sử dụng, màu sắc đa dạng ngày càng
thay thế cho các kim loại, hợp kim trong nhiều lĩnh vực, kể cả những lĩnh vực tưởng như
không thể thiếu kim loại như bán dẫn, siêu dẫn…
Do những đặc điểm trên mà hóa học hữu cơ được tách ra như một ngành khoa học
riêng, đòi hỏi những phương pháp nghiên cứu và thiết bị ngày càng hiện đại hơn, đòi hỏi
những nỗ lực ngày càng lớn lao của các nhà hóa học trên toàn thế giới, để không những dần
dần bắt trước được thiên nhiên tổng hợp nên những hợp chất phức tạp và quan trọng trong
đời sống, mà trong nhiều lĩnh vực còn vượt cả thiên nhiên nữa.
1.1.2. Cấu tạo của các hợp chất hữu cơ.
Trong phân tử hữu cơ các nguyên tử cacbon không hoàn toàn giống nhau. Ví dụ
trong hợp chất sau:
3
1
CH3
2
3
4
5
CH3 - C - CH - CH2 - CH3
H3C
CH3
Ta nhận thấy rằng:
+ nguyên tử cacbon C2 liên kết trực tiếp với bốn nguyên tử cacbon bên cạnh
+ nguyên tử C3 liên kết với 3 nguyên tử cacbon
+ nguyên tử C4 liên kết với 2 nguyên tử cacbon
+ còn C1 và C5 với 1 nguyên tử cacbon. Như vậy các nguyên tử các bon trong hợp
chất trên không hoàn toàn giống nhau.
*Người ta phân biệt các bậc của nguyên tử cacbon sau đây:
- Nguyên tử cacbon bậc 1 là nguyên tử cacbon trong phân tử chỉ liên kết trực tiếp với
một nguyên tử cacbon khác, ví dụ nguyên tử C1 , C5 .
- Nguyên tử cacbon bậc 2 là nguyên tử cacbon, trong phân tử gắn trực tiếp với 2 nguyên
tử cacbon khác, ví dụ C3.
- Nguyên tử cacbon bậc 3 là nguyên tử cacbon đính trực tiếp với 3 nguyên tử cacbon
khác, ví dụ C2
- Nguyên tử cacbon bậc 4 là nguyên tử cacbon đính trực tiếp với 4 nguyên tử cacbon
khác, ví dụ C2
* Gốc hydrocacbon và bậc của nó
Nếu bỏ đi một hay nhiều nguyên tử hydro trong phân tử hydrocacbon thì phần còn lại
được gọi là gốc hydrocacbon. Tùy thuộc vào số nguyên tử hidro bỏ đi, người ta phân biệt
gốc hydrocacbon bậc 1, 2, 3, 4
Ví dụ, nếu bỏ đi một nguyên tử hydro ở phân tử metan CH4 , thì phần còn lại là gốc
metyl CH3 – hóa trị một, nếu bỏ đi hai nguyên tử thì phần còn lại là gốc metylen CH 2 = hóa
trị hai, khi bỏ đi 3 nguyên tử hydro thì được gốc metyliden
–CH= hóa trị 3
- Gốc phenyl
-C6 H5
- Gốc vinyl
CH2=CH-
- Gốc anlyl
CH2=CH- CH2-
* Nhóm định chức:
Đại đa số các hợp chất hữu cơ được cấu tạo bởi hai phần: gốc hydrocacbon và nhóm
định chức.
- Gốc hydrocacbon là phần mà tính chất hóa học của chúng trong đại đa số các hợp chất
hữu cơ đều tương tự nhau.
- Nhóm định chức:
+ là nguyên tử hay nhóm nguyên tử kết hợp với gốc hydrocacbon
+ nhóm định chức xác định đặc tính chất hóa học cơ bản của phân tử. Nói một cách
khác, nhóm định chức quyết định tính chất cơ bản một loại hợp chất hữu cơ.
Ví dụ, trong các hợp chất sau đây:
4
CH3Cl,
C2H5Cl,
C2H5OH,
C2H5NH2, C2H5COOH
Các nhóm CH3-, C2H5- là các gốc hydrocacbon. Những gốc này tuy nằm trong các
phần tử khác nhau, nhưng có tính chất tương tự nhau. Còn nguyên tử Cl và các nhóm
nguyên tử OH, NH2, COOH là nhóm định chức. Tính chất của các hợp chất trên phần lớn là
do tính chất của nhóm định chức này quyết định.
- Nhóm OH đặc trưng cho ancol và phenol.
- Nhóm NH2 đặc trưng cho các hợp chất amin. Nó quyết định tính chất bazơ và các
tính chất khác của hợp chất amin.
- Nhóm COOH đặc trưng cho các axit hữu cơ.
- Nhóm CHO đặc trưng cho andehit
- Nhóm CO đặc trưng cho axeton.
Khi xét bản chất hóa học cơ bản của một chất nào đó, ta phải xét đặc tính của nhóm
định chức chứa trong loại hợp chất hữu cơ đó.
1.1.2.1. Khái niệm về đồng đẳng
Những hợp chất hữu cơ được gọi là đồng đẳng với nhau là những hợp chất:
+ có cùng nhóm định chức
+ có cấu tạo hóa học tương tự nhau
+ nhưng khác nhau một hay nhiều nhóm metylen(-CH 2-) Ví dụ:
CH3-CH2-OH đồng đẳng với CH3-CH2-CH2-OH
Các hợp chất đồng đẳng với nhau tạo thành một dãy các hợp chất đồng đẳng gọi là
dãy đồng đẳng
1.1.2.2. Khái niệm về đồng phân
Đồng phân là hiện tượng tồn tại của các hợp chất có cùng công thức phân tử nhưng
có công thức cấu tạo khác nhau.
Những chất có đặc điểm trên được gọi là những hợp chất đồng phân với nhau.
Phân loại:
-
Đồng phân cấu tạo
-
Đồng phân không gian (còn gọi là đồng phân lập thể)
a. Đồng phân cấu tạo gồm các lọai sau:
- Đồng phân tạo thành do thay đổi mạch cacbon. Ví dụ, hợp chất C4H8 có ba đồng
phân:
- Đồng phân tạo thành do thay đổi vị trí của nhóm định chức hay liên kết bội, ví dụ:
5
Cl
Cl
Cl
Cl
Cl
Cl
ba hợp chất này là đồng phân với nhau.
Ví dụ:
CH2=CH-CH2-CH3 đồng phân với CH3-CH=CH-CH3 do thay đổi vị trí nối đôi.
-
Đồng phân được tạo thành khi hợp chất có cùng thành phần, nhưng có nhóm định
chức khác nhau.
O
CH3 CH2 C
CH3 CH2 OH
H
CH3 C CH3
CH3 O CH3
O
Các hợp chất trong những cặp hợp chất này là đồng phân với nhau. Chúng có thành phần
hóa học như nhau nhưng chứa những nhóm định chức khác nhau.
b. Đồng phân lập thể
* Khái niệm:
- Đồng phân lập thể là những hợp chất có cùng thành phần cấu tạo
- nhưng khác nhau về sự phân bố không gian của các nguyên tử hoặc nhóm nguyên tử
trong phân tử.
* Phân loại: 3 loại:
- đồng phân hình học
- đồng phân quang học
- đồng phân cấu dạng
(1) Đồng phân hình học
- là đồng phân lập thể gây nên bởi sự phân bố không gian khác nhau của nguyên tử hay
nhóm nguyên tử xung quanh phần cứng nhắc của phân tử.
- Phần cứng nhắc có thể là một nối đôi, 1vòng hoặc 1 phần vòng trong xycloankan…
- phân loại thành đồng phân cis và trans.
+ Đồng phân cis: có hai nhóm thế cồng kềnh nhất nằm cùng phía đối với mặt phẳng π
(hoặc mặt phẳng vòng)
+ còn trans là đồng phân có hai nhóm thế cồng kềnh nhất nằm ở hai phía khác nhau đối
với mặt phẳng π.
Ví dụ :
+ Đồng phân cis:
+ Đồng phân trans
COOH
COOH
H H COOH
H H H
H
H
H
COOH
6
(2) Đồng phân quang học:
a. Ánh sáng phân cực và tính chất của nó
Ánh sáng thường là những sóng điện từ, dao động theo những hướng khác nhau,
vuông góc với phương truyền sóng. Nếu cho ánh sáng này qua lăng kính Nicol, thì sau khi
qua lăng kính đó, ánh sáng thường sẽ trở thành ánh sáng phân cực, là ánh sáng dao động
theo một phương nhất định. Mặt phẳng vuông góc với phương dao động của ánh sáng phân
cực gọi là mặt phẳng phân cực.
Tiếp tục đặt một lăng kính Nicol thứ hai trên đường đi của ánh sáng phân cực, thì
sáng phân cực đi xuyên qua được lăng kính này khi lăng kính được đặt song song với lăng
kính thứ nhất. Việc quay lăng kính thứ hai đi một góc sẽ làm cho ánh sáng phân cực bị giữ
lại.
b. Các chất hoạt động quang học
Hình 1-1: Sơ đồ truyền ánh sáng phân cực qua lăng kính Nicol khi có hợp chất không hoạt
động quang học và hoạt động quang học
-
Các hợp chất hoạt động quang học:
+ (còn gọi là các hợp chất quang hoạt) là những chất có khả năng làm quay mặt phẳng
phân cực của ánh sáng theo một góc α nào đó.
+ Để đo góc quay của ánh sáng phân cực, khi nó đi qua chất quang hoạt, ta dùng phân
cực kế.
Có hai loại chất quang hoạt:
7
- Chất quay mặt phẳng phân cực của ánh sáng sang trái gọi là chất tả tuyền, khi viết
thường đặt dấu (-) trước tên của chất đó. Ví dụ, axit (-) lactic.
- Chất quay mặt phẳng phân cực của ánh sáng sang phải, được gọi là chất hữu tuyền,
khi viết thường đặt dấu (+) trước tên của chất đó. Ví dụ, axít (+) lactic.
Muốn có khả năng hoạt động quang học, các hợp chất hóa học phải có những đặc
điểm sau đây:
+ Có cấu tạo tinh thể bất đối xứng như tinh thể thạch anh, thủy ngân sunfua, clorat
natri, sunfat kẽm. Khả năng quay mặt phẳng phân cực của những chất này sẽ mất đi khi đem
hòa tan tinh thể.
+ Có cấu tạo phân tử bất đối xứng. Những hợp chất hữu cơ có cấu tạo phân tử bất đối
xứng là những hợp chất trong phân tử có chứa nguyên tử cacbon bất đối. Đó là những
nguyên tử cacbon có bốn hóa trị liên kết với bốn nguyên tử hay nhóm nguyên tử hoàn toàn
khác nhau, kí hiệu là C*. Ví dụ:
H
b
C*
a
H3 C
c
C*
COOH
OH
d
axit lactic
Những chất chứa nguyên tử cacbon bất đối theo kiến trúc tứ diện có thể có hai cách
sắp xếp trong không gian khác nhau:
a
a
b
c
d
d
b
c
Hai hợp chất này là đồng phân quang học của nhau. Người ta gọi chúng là những
chất đối quang.
Kết luận: Hai chất đối quang là hai chất có cùng thành phần phân tử, có cùng cấu
tạo, nhưng sắp xếp trong không gian như vật và ảnh của nhau qua gương và có khả năng
làm quay mặt phẳng ánh sáng phân cực theo hai góc có trị số tuyệt đối bằng nhau và ngược
chiều nhau.
Ví dụ, axít lactic tồn tại dưới hai dạng đồng phân quang học khác nhau:
8
Hai đồng phân này không cùng một chất, vì chúng không thể chồng khít lên nhau,
giống như hai bàn tay phải và bàn tay trái không thể chồng khít lên nhau.
Như vậy, khi có nguyên tử cacbon bất đối thì phân tử mất tính cân đối và trở thành
bất đối toàn bộ. Hợp chất có cấu tạo bất đối (có nguyên tử bất đối) thì sẽ hoạt động quang
học và tồn tại dưới những dạng đồng phân đối quang. Hai hợp chất đối quang nhau có giá
trị góc quay mặt phẳng phân cực α bằng nhau về trị số tuyệt đối, nhưng ngược chiều nhau
về dấu.
Hai đồng phân đối quang không khác nhau nhiều về tính chất hóa học và lý học.
Chúng chỉ khác nhau về bốn điểm sau đây:
- Những tinh thể đồng phân (+) và (-) kết tinh ở những dạng bất đối khác nhau.
- Chúng làm quay mặt phẳng phân cực của ánh sáng một góc bằng nhau nhưng
ngược chiều nhau.
- Chúng khác nhau về một số tính chất lý học như vị ngọt, độc tính, các vi sinh vật có
thể phân hủy chất này, mà hoàn toàn không động đến chất kia.
- Có tính chất hóa học giống nhau, nhưng khác nhau về khả năng tham gia phản ứng
với các tác nhân là những chất hoạt động quang học.
(3) Đồng phân cấu dạng
- Khái niệm: các cấu dạng hay còn gọi là các hình thể của một phân tử dùng để chỉ các
dạng cấu trúc không gian hình thành do quay một nhóm nguyên tử đối với một nhóm
nguyên tử khác xung quanh một liên kết đơn. và không thể đưa về trùng khít lên nhau.
Chẳng hạn, ở phân tử etan, hai nhóm metyl có thể quay quanh trục liên kết cacboncacbon và do đó phân tử có thể có vô số cấu dạng khác nhau, trong đó hai cấu dạng điển
hình là cấu dạng che khuất và cấu dạng xen kẽ. Để biểu diễn các cấu dạng người ta dùng
công thức phối cảnh hoặc thuận tiện hơn là công thức Niumen.
Cấu dạng che khuất:
công thức phối cảnh
công thức Niumen
Cấu dạng xen kẽ:
công thức phối cảnh
công thức Niumen
Ở cấu dạng che khuất, các nguyên tử hiđro của hai nhóm metyl che khuất nhau. ở cấu
dạng xen kẽ, các nguyên tử hiđro của hai nhóm metyl ở vào chỗ trống của nhau. Cấu dạng
xen kẽ bền hơn cấu dạng che khuất, hiệu số năng lượng giữa hai dạng này là 2,8 kcal/mol.
Ở các dẫn xuất thế 1,2 của etan ta cũng xét tương tự. Tuy nhiên, số cấu dạng điển
hình ở đây không phải là hai, mà là sáu, trong đó có ba là dạng xen kẽ và ba là dạng che
khuất. Thí dụ, ở n-butan ta có ba cấu dạng xen kẽ và ba cấu dạng che khuất như sau:
9
dạng đối (anti)
các dạng lệch
dạng khuất
các dạng nửa khuất
Các dạng lệch và nửa khuất ở mức năng lượng như nhau. Cấu dạng ưu tiên là cấu
dạng đối.
Cấu dạng này bền hơn cấu dạng lệch 0,8 kcal/mol, bền hơn cấu dạng nửa khuất 3,4
kcal/mol và cấu dạng khuất khoảng 4,4 - 6,1 kcal/mol.
Ta gọi các cấu dạng có thể tồn tại bền vững là các đồng phân cấu dạng.
Các đồng phân cấu dạng thực tế có tồn tại và có thể nhận biết được thông qua việc
khảo sát các tính chất vật lí và hoá học, song không thể phân lập được chúng riêng biệt bởi
vì chúng rất dễ dàng chuyển hoá lẫn nhau qua việc quay quanh trục liên kết đơn.
1.2. CÁC PHƯƠNG PHÁP TÁCH VÀ PHÂN TÍCH CÁC HỢP CHẤT HỮU
CƠ.
Các hợp chất hữu cơ khi mới điều chế được hoặc tách từ động thực vật, thường ở
dạng hỗn hợp không tinh khiết. Vì vậy muốn nghiên cứu chúng, muốn phân tích định tính
hay định lượng chúng thì nhiệm vụ trước tiên là phải tách chúng thành từng chất riêng biệt,
ở dạng tương đối nguyên chất.
1.2.1. Các phương pháp tách và tinh chế các chất hữu cơ.
1.2.1.1. Phương pháp kết tinh
- Phương pháp này được dùng để tách và tinh chế các chất hữu cơ rắn.
- Dựa trên nguyên tắc:
+ các chất khác nhau có độ hòa tan khác nhau trong cùng một dung môi.
+ Dung môi thích hợp được lựa chọn thường là dung môi trong đó độ hòa tan của
chất rắn cần tinh chế tăng khá nhanh theo nhiệt độ.
+ Bằng cách tạo dung dịch bão hòa ở nhiệt độ cao (thường là nhiệt độ sôi của dung
môi) sau đó để nguội dung dịch thu được, chất rắn tinh chế sẽ kết tinh xuống đáy bình (hay
đáy cốc) các chất tạp sẽ ở lại trong dung dịch. Bằng cách kết tinh lại một số lần trong cùng
một dung môi, hoặc trong các dung môi khác nhau, người ta có thể thu được tinh thể chất
cần tinh chế ở dạng khá tinh khiết.
+ Cũng có khi người ta dùng một dung môi có độ hòa tan với tạp chất nhiều hơn để
loại tạp chất khỏi chất rắn cần tinh chế.
- Dung môi thường là nước, ancol etylic, ancol metylic hay một ancol thích hợp
khác, axeton, axít axetic băng, ete. Benzen, cloroform, etyl axetat…hoặc đôi khi hỗn hợp
giữa chúng.
- Khi cần tách hai hay nhiều chất có chứa trong hỗn hợp với những lượng tương
đương nhau, người ta dùng phương pháp kết tinh phân đoạn.
- Khi đã có chất rắn kết tinh, ta cần xác định nhiệt độ nóng chảy của nó bằng ống
mao quản gắn với nhiệt kế nhúng trong một dung môi sôi cao, hoặc cách không khí, hoặc
10
nhờ một máy chuyên dùng rồi đối chiếu với hằng số vật lý của chất đã cho, để biết được
chất đó tinh khiết hoàn toàn chưa.
1.2.1.2. Phương pháp chưng cất.
1. Chưng cất đơn giản
- Trong trường hợp cần tinh chế một chất lỏng, tách nó ra khỏi tạp chất rắn không
bay hơi
- Nghĩa là chuyển nó sang pha hơi trong một bình cất có nhánh rồi ngưng tụ hơi của
nó bằng ống sinh hàn vào một bình hứng khác.
2. Chưng cất phân đoạn
- Phương pháp này để tách hai hay nhiều chất lỏng có nhiệt độ sôi khác nhau tan lẫn
hoàn toàn trong nhau, dựa trên nguyên tắc là có sự phân bố khác nhau về thành phần các cấu
tử giữa hai pha lỏng và pha hơi ở trạng thái cân bằng (ở cùng nhiệt độ)
Khi tiến hành bằng phương pháp này trong cột chưng cất ở phía dưới có nhiệt độ cao
hơn ở phía trên nên hơi có nhiệt độ cao đi từ dưới lên truyền nhiệt cho chất lỏng ngưng tụ từ
trên xuống, làm cho một phần cấu tử dễ bay hơi trong chất lỏng bị ngưng tụ lại, tiếp tục bay
hơi lần 2, lần 3…còn một phần cấu tử khó bay hơi trong pha hơi bị ngưng tụ thành lỏng và
tiếp tục đi xuống gần dưới cột cất. Kết quả của quá trình lặp lại nhiều lần như vậy cho ta thu
được chất lỏng cất ra tinh khiết hơn và chất lỏng còn lại trong bình cất cũng tinh khiết hơn.
3. Chưng cất chân không (hay giảm áp)
- Khi cần chưng cất một chất lỏng dễ bị phân hủy ở nhiệt độ cao, người ta phải dùng
phương pháp cất chân không tức là dùng bơm hút để giảm áp suất khí quyển trên bề mặt
chất lỏng. Vì chất lỏng sẽ sôi khi áp suất hơi riêng phần đạt đến áp suất khí quyển, nên bằng
phương pháp này, người ta có thể giảm nhiệt độ sôi của nó một cách đáng kể, tránh hiện
tượng phân hủy hay cháy nổ.
- Nhờ phương trình Clapayron- Claoziut, người ta có thể tính được sự phụ thuộc của
áp suất hơi một chất vào nhiệt độ. Tuy nhiên có thể áp dụng quy luật thực nghiệm gần đúng
như sau: Khi áp suất hơi khí quyển trên bề mặt một chất lỏng giảm đi một nửa, nhiệt độ sôi
của nó bị hạ thấp đi khoảng 15oC.
4. Cất lôi cuốn theo nước
- Ta cũng có thể tinh chế một chất lỏng không hòa tan trong nước, bằng phương pháp
lôi cuốn theo hơi nước, để hạ điểm sôi của nó.
- Phương pháp này dựa trên nguyên tắc là:
+ khi hai hay nhiều chất lỏng không trộn lẫn với nhau nằm trong một hỗn hợp thì áp
suất chung của chúng bằng tổng áp suất riêng phần p1 + p2 , nghĩa là nó luôn luôn lớn hơn
áp suất riêng phần của từng cấu tử bất kì nào. Do đó nhiệt độ sôi của hỗn hợp sẽ thấp hơn
nhiệt độ sôi của cấu tử sôi thấp nhất.
+ Tỷ lệ hơi cất sang bình ngưng (về số mol) sẽ bằng tỉ lệ áp suất hơi riêng phần của
chúng ở nhiệt độ sôi của hỗn hợp. Nhờ vậy ta có thể tính toán được lượng nước cần thiết để
lôi cuốn hết chất cần tinh chế.
11
Ví dụ, khi cất lôi cuốn theo hơi nước nitrobenzen (to =211 oC) thì ở 760 tor hỗn hợp
nitrrobenzen- nước sôi ở 99,25 oC, ở nhiệt độ này pH2O =740 tor, pC6H5NO2 =20 tor. Vậy tỉ
lệ hơi cất sang:
n H 2O
nC6 H 5 NO2
740
37
20
Nghĩa là, muốn cất lôi cuốn được 123 g C6H5NO2 (1 mol) cần 37 x 18 = 666 gam
nước.
Sau khi đã dùng phương pháp lôi cuốn theo hơi nước, thường ta phải chiết tách các
chất cần tinh chế ra khỏi hỗn hợp nước bằng một dung môi thích hợp, rồi lại tiến hành cất
phân đoạn để tách dung môi. Cuối cùng chưng cất lấy chất tinh khiết bằng bình cất có gắn
nhiệt kế dưới áp suất thường hay giảm áp, với sự kiểm tra nhiệt độ của chất cần tinh chế.
1.2.1.3. Phương pháp thăng hoa.
Một số chất như iôt, long não …có khả năng thăng hoa (chuyển trực tiếp từ thể rắn
sang thể hơi), vì vậy người ta có thể dùng phương pháp thăng hoa ở áp suất thường hoặc áp
suất thấp để tinh chế chúng. Phương pháp này thường cho phép tinh chế một lượng nhỏ chất
và thu được sản phẩm khá tinh khiết.
1.2.1.4. Phương pháp chiết
- Chiết là dùng một dung môi thích hợp có khả năng hòa tan chất đang cần tách và
tinh chế để tách lấy chất đó ra khỏi môi trường rắn hoặc lỏng khác.
- Thường người ta dùng một dung môi sôi thấp và ít tan trong nước như ete,
cloroform để chiết tách chất hữu cơ từ môi trường nước (các chất hữu cơ cần tinh chế này
thường tan ít trong nước hoặc ở dạng nhũ tương lẫn với nước). Sau khi lắc dung môi này
với hỗn hợp chất cần tinh chế và nước, chất đó sẽ chuyển phần lớn lên dung môi và ta có thể
dùng phễu chiết để tách riêng dung dịch thu được khỏi nước.
Bằng cách lặp lại việc chiết một số lần, ta có thể tách được hoàn toàn chất cần tinh
chế vào dung môi đã chọn, sau đó cất loại dung môi và cất lấy chất tinh khiết ở nhiệt độ và
áp suất thích hợp.
- Người ta cũng thường chiết một chất từ hỗn hợp rắn bằng một dung môi hoặc hỗn
hợp dung môi với một dụng cụ chuyên dùng đặc biệt gọi là bình chiết Soxhlet
+ Dung môi được đun nóng, cho bay hơi, rồi ngưng tụ chảy vào bình chứa hỗn hợp
cần chiết tách (thường được gói bằng giấy lọc) nó sẽ hòa tan chất rắn cần tinh chế và nhờ
một ống xiphông, dung dịch chảy xuống bình cầu bên dưới, dung môi nguyên chất lại tiếp
tục được cất lên. Quá trình được tiếp tục cho đến khi sự chiết tách hoàn toàn. Phương pháp
này tiết kiệm được dung môi mà đạt hiệu quả tương đối cao.
1.2.1.5. Phương pháp sắc kí.
Phương pháp sắc ký được Xvét phát minh ra để tách các chất bằng hấp phụ từ đầu
thế kỷ 20 (1903) đến nay đã trở nên một phương pháp tinh chế, định tính, định lượng rất
quan trọng trong hóa hữu cơ, được phát triển rất mạnh mẽ và được sử dụng rộng rãi trong
phòng thí nghiệm hiện đại.
12
Nguyên tắc chung của phương pháp là: hỗn hợp chất nghiên cứu ở pha lỏng (dung
dịch) hay pha khí được cho đi qua bề mặt chất hấp phụ ở pha rắn hay pha lỏng khó bay hơi.
Do khả năng tương tác với pha tĩnh khác nhau nên các chất khác nhau trong hỗn hợp nghiên
cứu chuyển động với vận tốc khác nhau và dần được phân tách ra từng cấu tử riêng biệt.
Người ta phân chia ra thành các loại sắc ký khác nhau.
1. Sắc ký cột ( sắc ký hấp phụ)
-Trong phương pháp sắc ký cột, người ta dùng:
+ các cột thủy tinh hay đôi khi bằng kim loại có kích thước thông thường là: 15 x1 ;
25 x 2; 40 x 3 hoặc 60 x 4 cm;
+ dùng các chất hấp phụ ở dạng bột, thường là oxit nhôm, silicagel, tinh bột,
barisunfat…hoặc một chất bất kỳ khác không tương tác với chất nghiên cứu và dung môi.
+ Còn hỗn hợp chất nghiên cứu được hòa tan trong một dung môi trơ thích hợp và
cho chảy qua cột.
Các chất trong hỗn hợp nghiên cứu dần dần tách khỏi nhau và chúng chiếm các vị trí
khác nhau trên cột hấp phụ. Vì lúc đầu người ta tiến hành trên cột thí nghiệm với các chất
màu, khi chúng tách ra tạo thành các khoanh màu khác nhau trên ống hấp phụ nên phương
pháp này được gọi là phương pháp sắc ký. Sau đó người ta tách riêng từng chất hoặc bằng
cách cắt cột hấp phụ thành từng đoạn ứng với từng chất, hoặc liên tục đổ thêm dung môi,
các chất sẽ lần lượt được rửa trôi và thoát ra bình hứng ở các thời điểm khác nhau.
Có thể dùng phương pháp này để tách các chất không màu, nhưng phải dùng các chất
chỉ thị hay thuốc thử thích hợp để nhận biết khi nào chúng bắt đầu thoát ra bình hứng.
Bình đựng dung dịch
Cột chứa chất hấp phụ
Bình hứng
Hình 1-3: Sơ đồ sắc ký cột
2. Sắc ký giấy
- Sắc ký giấy là một dạng đặc biệt của sắc ký phân bố do Conzden, Gordon và Martin
phát minh năm 1944. Pha tĩnh ở đây là nước thấm trên giấy lọc đặc biệt (xenluloza tinh
khiết).
- Dung dịch chất nghiên cứu được chấm trên một đầu của dải giấy (cách mép giấy
chừng 2,5 cm) và mỗi giọt cách nhau chừng 2 cm. Người ta thường nhỏ đồng thời cả dung
dịch mẫu đã biết để so sánh.
- Sau đó đầu giấy lọc được nhúng trong một dung môi hay hỗn hợp dung môi thích
hợp đã bão hòa nước. Do lực mao dẫn, dung môi sẽ thấm dần lên giấy sắc ký, kéo theo chất
13
nghiên cứu chuyển động lên phía trên và tạo vết trên giấy mà người ta có thể nhận biết được
bằng mắt thường hoặc bằng chất chỉ thị.
- Tỷ số Rf giữa độ dịch chuyển của chất nghiên cứu và dung môi được gọi là hằng số
sắc ký, hằng số này là đại lượng quan trọng đặc trưng cho từng chất.
Để thu được kết quả tách tốt hơn người ta có thể lặp lại thao tác trên với một dung
môi khác và theo chiều thẳng góc với chiều chạy lần trước (sắc ký phân bố hai chiều).
Sắc ký giấy thường dùng để định tính các chất, nhưng cũng có thể dùng để định
lượng sơ bộ dựa vào độ đậm và tiết diện của chất nghiên cứu.
3. Sắc ký lớp mỏng
Phương pháp này được Izomailop và Schraiber đề nghị từ 1938, được Stan phát triển
và hoàn thiện (1955) khiến nó có ứng dụng rất rộng rãi.
Người ta tráng một lớp mỏng chất hấp phụ (Al2O3, silicagel) lên một tấm kính kích
thước khoảng 10 x 12 cm hoặc 20 x 20 cm, chấm một giọt chất nghiên cứu hay hỗn hợp
nghiên cứu lên một đầu bản (cách mép khoảng 2 cm) rồi cho dung môi chạy như sắc ký
giấy.
Phương pháp sắc ký lớp mỏng thường cho hiệu quả tách cao, thời gian ngắn, lượng
chất ít, thường dùng để định tính và tách các hợp chất thiên nhiên. Nó cũng được các nhà
hóa học tổng hợp sử dụng thường xuyên để nhanh chóng phân tách các chất thu được trong
phản ứng.
4. Sắc ký khí lỏng
- Những năm gần đây sắc ký khí lỏng (đôi khi gọi đơn giản là sắc ký khí) được phát
triển mạnh mẽ, mở ra khả năng lớn phân tích và tách các hợp chất dễ bay hơi.
- Nguyên
lí làm việc:
tướng tĩnh (parafin, các điankyl phtalat, các polyglycol…) được tẩm trên một vật
liệu mang ở thể rắn (ôxít silic, đất sét…) được đặt trong cột tách (đường kính cột khác nhau
khoảng từ 6mm đến 0,25m). Dưới một thế hiệu áp suất không đổi, pha động gồm khí mang
(thường là heli hoặc nitơ) cùng với mẫu (hỗn hợp khí hoặc lỏng đã hoá hơi cần phân tích)
được đưa vào cột phân tích đặt trong thùng điều nhiệt. Tại đây, cùng với việc di chuyển
trong dòng khí mang từ đầu cột đến cuối cột phân tách luân phiên xảy ra các quá trình hấp
phụ và giải hấp của các cấu tử được phân tích trên pha tĩnh. Tùy thuộc vào sự khác biệt của
hằng số cân bằng hấp phụ các cấu tử được phân tích có thời gian lưu lại trong cột phân tách
khác nhau, và do đó, được dòng khí mang đưa ra khỏi cột ở những thời điểm khác nhau. Khi
ra khỏi cột, mỗi khí được đetecto tiếp nhận, chuyển qua bộ phận khuếch đại rồi truyền sang
bút ghi vẽ thành sắc kí đồ.
14
Hình 1.5: Sơ đồ một máy sắc ký khí
1.2.2. Xác định thành phần phân tử các hợp chất hữu cơ
Để xác định được công thức phân tử các hợp chất hữu cơ người ta tiến hành xác định
các thành phần nguyên tố và phân tử lượng của chúng.
1.2.2.1. Phân tích nguyên tố
Các hợp chất hữu cơ thường chứa ngoài cacbon còn có hydro, oxy, nitơ, halogen, lưu
huỳnh,…Để xác định sự có mặt và hàm lượng của chúng người ta sử dụng các phương pháp
định tính và định lượng riêng.
1. Xác định cacbon và hydro
Định tính:
Sự có mặt của cacbon và hydro trong một hợp chất thường được xác định bằng cách
đốt cháy hợp chất đó trong oxy, có mặt đồng oxit.
CxHyOz + ( x
y z
) O2
4 2
x CO2 +
y
H2O
2
CO2 thoát ra được nhận biết bằng phản ứng làm đục nước vôi trong:
Ca(OH)2 + CO2
CaCO3 + H2O
H2O được nhận biết bằng giọt ngưng tụ trên phần lạnh của ống đốt hay bằng CuSO 4
khan không màu, nó chuyển thành CuSO 4 . 5H2O màu xanh.
Hình 1. .. Sơ đồ phân tích định tính C, H
15
Định tính:
Để định lượng cacbon và hydro, người ta đốt cháy một lượng cân chính xác chất
nghiên cứu bằng dòng oxy có mặt CuO trong ống thạch cao, rồi hấp thụ hơi nước thoát ra
bằng mage peclorat (MgClO4) hoặc H2SO4 đặc; CO2 hấp thụ bằng amiăng tẩm xút (NaOH)
hoặc dung dich NaOH đặc.
Biến thiên khối lượng bình (1) = mH2O bị hấp thụ.
Biến thiên khối lượng bình (2) = mCO2 bị hấp thụ.
Hàm lượng % H tính từ khối lượng của H2O :
%H
mH 2O .2.100%
18.mA
Hàm lượng % C tính từ khối lượng của CO2 :
%C =
m CO2 .12.100%
44.mA
Hình 1. Sơ đồ phân tích định lượng C, H
-
A : Chất hữu cơ.
-
CuO : Cung cấp chất oxi hóa.
-
Bình 1 : Hấp thụ H2O.
-
Bình 2 : Hấp thụ CO2.
-
Dùng dòng khí O2 đuổi hết dòng khí trong thiết bị.
2. Xác định nitơ.
Định tính:
Để xác định sự có mặt của nitơ trong hợp chất nghiên cứu, ta có thể đốt nóng mẫu
thử với natri kim loại, nitơ cùng cacbon trong mẫu thử sẽ chuyển thành NaCN, hòa tan sản
phẩm tạo thành trong nước cất, lọc lấy dung dịch thêm lần lượt các ion Fe 2+, Fe3+, axit hóa
sẽ tạo thành kết tủa màu xanh.
6CN- + Fe2+
4 Fe3+
+
3 [ Fe(CN)6 ]4-
[ Fe(CN)6 ]4Fe4 [[Fe(CN)6 ]
Màu xanh
Định lượng:
Để định lượng nitơ ta thường dùng phương pháp Dumas hoặc Kjeldahl.
- Nguyên lý của phương pháp Dumas này là:
16
+ oxy hóa hợp chất hữu cơ bằng CuO rồi lôi cuốn sản phẩm bằng một dòng CO 2
tinh khiết. Nitơ trong chất hữu cơ sẽ chuyển thành N2 tự do.
+ Ta đo thể tích N2 thoát ra bằng một buret úp ngược trong chậu dung dịch KOH
đậm đặc. H2O sẽ ngưng tụ trong dung dịch; CO2 hoàn toàn bị hấp thụ bởi KOH; N2 thoát lên
được và ta đo thể tích của nó dễ dàng.
- Phương pháp Kjeldahl:
+ tuy không phổ biến bằng phương pháp Dumas, song trong nhiều trường hợp cũng
rất tiện lợi, nó cho phép xác định nhanh hàm lượng nitơ trong mẫu thử.
+ Bằng cách vô cơ hóa hợp chất nghiên cứu khi đun nóng trong H 2SO4 đặc có sêlen
xúc tác (khi cần có thể thêm chất oxy hóa), ta chuyển nitơ thành muối amoni sunfat sau đó
kiềm hóa dung dịch thu được rồi lôi cuốn NH3 theo hơi nước sang một bình khác và chuẩn
độ lượng NH3 tạo thành.
3. Xác định halogen
Định tính:
Sự có mặt của halogen trong hợp chất hữu cơ được xác định bằng cách tẩm mẫu chất
vào một sợi dây đồng rồi đốt, nếu hợp chất có chứa halogen sẽ tạo ngọn lửa màu xanh lục.
Định lượng:
Người ta định lượng halogen bằng cách oxy hóa mẫu chất trong bình chứa oxy
nguyên chất, có xúc tác Pt, khi đó sẽ tạo ra axit halogenhydric, nó được hấp thụ bằng dung
dịch HNO3 và sau đó xác định bằng phản ứng với bạc nitrat.
AgNO3 +
HX
AgX + HNO3
Bằng cách đo độ đục hoặc chuẩn độ lượng Ag+ dư người ta tính được hàm lượng
halogen trong mẫu chất nghiên cứu.
4. Xác định lưu huỳnh.
Định tính:
Khi nung chảy hợp chất hữu cơ với Na kim loại, lưu huỳnh sẽ chuyển thành Na2S,
sau đó ta có thể dễ dàng nhận biết được bằng cách phản ứng tạo kết tủa PbS hay Ag2S.
Pb(NO3)2
+
Na2S
PbS
+ 2NaNO3
Định lượng:
Để định lượng lưu huỳnh, người ta oxy hóa mẫu chất hữu cơ bằng HNO3 bốc khói
trong ống hàn kín ở 200 – 300oC, sau vài giờ thì lưu huỳnh trong mẫu chất sẽ chuyển hóa
thành H2SO4, ta có thể định lượng bằng phản ứng với BaCl2, rồi xác định lựơng BaSO4
(phương pháp trọng lượng)
H2SO4 + BaCl2
BaSO4 + 2HCl.
5. Xác định các nguyên tố khác.
Ngoài các nguyên tố kể trên, trong một số trường hợp chất hữu cơ có thể còn chứa P,
Si, một số kim loại khác….
Ta cũng oxy hóa hợp chất hữu cơ bằng HNO3 bốc khói trong ống hàn kín hoặc nung
nóng chảy với hỗn hợp NaNO3 và Na2CO3. Các nguyên tố nói trên sẽ chuyển hóa thành các
17
hợp chất vô cơ tương ứng (thường với hóa trị cao nhất) sau đó ta định lượng chúng bằng các
phương pháp vô cơ thông thường.
6. Xác định oxy.
Hàm lượng oxy trong các hợp chất hữu cơ thường được xác định một cách gián tiếp,
tức là ta lấy khối lượng mẫu đem đốt trừ đi tổng khối lượng các nguyên tố khác vừa xác
định theo các phương pháp trên, hoặc lấy 100% trừ đi hợp phần của các nguyên tố khác.
Ta cũng có thể xác định trực tiếp bằng cách chuyển oxy trong hợp chất hữu cơ thành
CO rồi oxy hóa bằng I2O5.
5CO + I2O5
5CO2
+ I2
Chuẩn độ lượng I2, CO2 được giải phóng ra hoặc chuẩn độ lượng I2O5 dư ta tính
được lượng CO hình thành.
Tóm lại, nhờ những cân phân tích chế tạo cực kỳ chích xác, nhờ những thiết bị phân
tích ngày càng hoàn thiện, người ta có thể tiến hàn phân tích vi lượng với những mẫu chất
rất nhỏ (vài mg) cũng đủ cho ta kết quả đáng tin cậy. Từ những năm sáu mươi của thế kỷ
XX người ta đã phát hiện và sử dụng các phương pháp siêu vi lượng, chỉ cần cân mẫu chất,
còn các sản phẩm đốt cháy được xác định bằng các thiết bị tinh vi trên cơ sở đo độ dẫn nhiệt
của các chất khác nhờ bộ phát hiện detetơ. Với phương pháp này, người ta có thể xác định
đồng thời C, H, N hoàn toàn tự động trong 10 phút, lượng mẫu chỉ cần khoảng 1 mg.
1.2.2.2. Thiết lập công thức tổng quát của hợp chất.
Sau khi xác định thành phần khối lượng (hoặc thành phần % khối lượng) của từng
nguyên tố trong chất nghiên cứu, bằng cách chia cho khối lượng nguyên tử của các nguyên
tố tương ứng, ta sẽ tìm được tỷ lệ giữa số nguyên tử từng nguyên tố trong phân tử, từ đó
thiết lập được công htức tổng quát của chất đã cho dưới dạng ( C xHyOzNt)n.
Ví dụ: Đốt cháy 1,5 mg một chất A tạo thành 0,9 mg H2O, 1,76 mg CO2 và 0,224 ml
N2 ( quy về điều kiện tiêu chuẩn). Ta tính khối lượng từng nguyên tó trong mẫu chất như
sau:
0,9 mg H2O =
1,76 mg CO2 =
0,224 ml N2 =
0,0009
0,0009
mol =
x 2 = 0,0001 g H = 0,1 mg
18
18
0,00176
0,00176
mol =
x 12 = 0,00048 g C = 0,48 mg C
44
44
0,224
0,224
mol =
x 28 = 0,28 mg N
22,4
22,4
Lượng oxy: mO = 1,5 – ( 0,48 + 0,1+ 0,28 ) = 0,64 mg
Ta có:
CxHyOzNt + ( x +
Và x: y: z: t =
y z
- ) O2
4 2
xCO2 +
y
t
H2O + N2
2
2
0,48 0,1 0,64 0,28
: :
:
=2:5:2:1
12 1 16 14
Vậy công thức tổng quát chất nghiên cứu là: (C2H5O2Nt)n
18
Để xác định n ta phải xác định phân tử lượng chất đã cho hoặc đôi khi không thực
hiện trong điều kiện đó thì phải biện luận.
1.2.2.3. Xác định khối lượng phân tử của một hợp chất.
Để tìm được công thức nguyên (công thức phân tử) của một hợp chất, ta phải xác
định khối lượng phân tử, hay nói chích xác hơn là xác định khối lượng mol phân tử của chất
nghiên cứu. Có nhiều phương pháp xác định khối lượng phân tử.
a. Nếu mẫu chất nghiên cứu là chất lỏng dễ bay hơi, ta cho bay hơi ở nhiệt độ thích
hợp, đo thể tích hơi ở điều kiện đó rồi tính khối lượng phân tử của nó theo phương trình:
p.V = nRT =
M=
m
RT
M
mRT
pV
Trong đó:
p- áp suất
V- thể tích chất nghiên cứu
m- khối lượng chất cho bay hơi
T- nhiệt độ tuyệt đối
R- hằng số khí
b. Nếu đo được tỷ khối hơi của chất đã cho đối với một chất khí nào đó, ta tính được
khối lượng phân tử của nó dễ dàng.
Ví dụ, hơi chất A nặng gấp 25 lần H2 thì khối lượng phân tử của nó phải là:
M = 25 x 2 = 50
c. Dựa vào định luật Raoult.
Dung dịch một chất khó bay hơi trong một dung môi nào đó luôn có nhiệt độ sôi cao
hơn, nhiệt độ đông đặc thấp hơn so với dung môi nguyên chất và độ tăng điểm sôi hay độ hạ
điểm kết tinh luôn tỷ lệ với nồng độ chất tan.
Δt = KC
K- hệ số tỷ lệ, được gọi là hằng số nghiệm sôi hay nghiệm lạnh, đặc trưng cho từng
loại dung môi
C- nồng độ mol/l hay số mol chất tan /1000 g dung môi.
Bằng cách đo mức tăng nhiệt độ sôi (phương pháp nghiệm sôi) hoặc mức hạ điểm kết
tinh (phương pháp nghiệm lạnh) của dung dịch chất nghiên cứu trong dung môi thích hợp,
ta dễ dàng xác định được nồng độ chất tan và do đó xác định được khối lượng phân tử của
chúng.
Người ta hay dùng campho làm dung môi, vì hằng số nghiệm lạnh của nó khá cao
(khi hòa tan một mol chất tan trong 1000g campho, điểm đông đặc hạ đi Δt = 37,7 oC).
d. Các phương pháp khác.
Bằng cách tương tự, người ta cũng có thể đo áp suất thẩm thấu của dung dịch chất
tan, đo độ nhớt của dung dịch hoặc phương pháp khối phổ, từ đó xác định được phân tử
19
lượng chất đã cho. Nếu biết rõ số nhóm chức trong một phân tử chất nghiên cứu, bằng cách
xác định nhóm chức cũng cho phép xác định khối lượng phân tử của chúng.
Ví dụ, 0,92 g một ancol đơn chức tác dụng với một lượng dư Na cho 0,224 lít H 2
(dktc) thì khối lượng phân tử của ancol phải là:
0,92
= 46
0,224 x 2
22,4
1.2.2.4. Thiết lập công thức nguyên một hợp chất
Sau khi xác định được công thức tổng quát của chất nghiên cứu và phân tử lượng của
nó, dễ dàng ta tìm được trị số của n và do đó thiết lập được công thức nguyên.
Ví dụ, đã lập được công thức tổng quát của chất A dưới dạng (C2H5O2N)t như ở ví dụ trên,
đồng thời bằng một trong các phương pháp vừa nêu ta xác định được khối lượng phân tử
của chất A là 75, ta tính được:
( 2 x 12 + 5 x 1+ 2 x 16 + 1 x 14 ) n = 75
75n = 75 n = 1
Vậy công thức nguyên của A phải là C2H5O2N
Tuy nhiên, nhiều khi trong điều kiện thực nghiệm không cho phếp ta thực hiện tất cả
các bước trên, có nghĩa là phải giải bài toán tìm công thức nguyên khi số phương trình toán
học lập được ít hơn ẩn số, trong trường hợp này ta phải biện luận. Phương pháp này phải
dựa vào đặc điểm của hợp chất đã cho để xác định trị số n trong công thức tổng quát, hoặc
đưa vào các bất phương trình phản ánh môi tương quan giữa số nguyên tử của các nguyên
tố cơ bản.
Ví dụ, một hydrocacbon có tỷ khối đối với hydro là 21. Hãy xác định công thức của
nó.
Ta có phân tử lượng của nó là 21 x 2 = 42. Nếu gọi công thức scuar hydrocacbon đó
là CxHy, ta có:
12x + y = 42
Suy ra
Hay
12x < 42
x < 3,5
Mặt khác vì CxHy là hydrocacbon, nên số nguyên tử H trong phân tử không vượt quá
2x + 2, nghĩa là :
y 2x +2
42 -12x 2x + 2
40 14x
2,8 x
Kết hợp với bất phương trình tên, ta có 2,8 x < 3,5 mà x chỉ tiếp nhận giá trị
nguyên, vậy x = 3, suy ra y = 6
Chất đã cho có công thức C3H6
1.2.3. Các phương pháp vật lý xác định cấu trúc phân tử hợp chất hữu cơ
20
Các hợp chất hữu cơ thông thường có nhiều đồng phân khác nhau. Tính chất của
chúng cũng phụ thuộc không những vào thành phần phân tử mà cả vào cấu tạo phân tử của
chúng (thứ tự liên kết, vị trí và kiểu nhóm chức). Vì vậy, sau khi đã xác định công thức
phân tử như trên, cần xác định công thức cấu tạo của nó. Thậm chí trong nhiều trường hợp,
sau khi tách được chất tinh khiết, người ta tiến hành phân tích quang phổ để dự đoán bản
chất và cấu tạo hợp chất đã có ngay trước khi làm các phân tích hóa học khác.
Để xác định cấu trúc phân tử, người ta có thể dùng cả phương pháp vật lý và hóa học.
Các phương pháp vật lý ngày càng sử dụng rộng rãi hơn và đóng vai trò quan trọng hơn.
Trong các phương pháp vật lý, trước tiên phải nói đến phương pháp quang phổ hấp
thụ phân tử. Đó là phương pháp vật lý hữu hiệu nhất vì chỉ cần một lượng nhỏ nhất, trong
một thời gian ngắn, nhưng lại cho một lượng thông tin lớn về cấu trúc phân tử.
Nguyên tắc chung của quang phổ hấp thụ là bị kích thích bởi một bức xạ điện từ,
phân tử các chất sẽ hấp thụ lượng tử năng lượng với bước sóng thích hợp để chuyển sang
trạng thái kích thích có năng lượng cao hơn. Sự hấp thụ đó có tính chất chọn lọc, phụ thuộc
vào đặc điểm cấu trúc các phân tử cùng từng loại liên kết, từng loại nhóm chức… Năng
lượng được hấp thụ có thể kích thích sự chuyển năng lượng electron từ mức thấp lên mức
cao (phổ electron), hoặc có thể gây nên sự dao động (phổ dao động) và sự quay (phổ quay)
của các nguyên tử và nhóm nguyên tử. Vì vậy, phân tích ảnh quang phổ chụp được cho ta
những thông tin nhất định về cấu trúc phân tử, về sự có mặt của các loại liên kết hay nhóm
chức nhất định.
Ánh sáng từ nguồn sáng (hay sóng điện từ thích hợp) được đi qua lăng kính để tách
phổ. Bức xạ đơn sắc đi qua cả cuvet chứa chất nghiên cứu và cuvet bổ chính (không chứa
chất nghiên cứu hoặc chỉ chứa dung môi tinh khiết) rồi vào bộ phận tiếp nhận để so sánh
cường độ bức xạ sau khi qua hai cuvet. Kết quả đo đạc sau khi qua bộ phận khuếch đại,
được ghi lại tự động trên bộ phận ghi thành đường cong hấp thụ (phổ hấp thụ) đặc trưng cho
từng loại chất.
Sơ đồ chung của máy quang phổ hấp thụ được trình bày ở hình sau:
Hình 1-6: Sơ đồ chung cả máy quang phổ hấp thụ
Các dải phổ điện từ và các kiểu kích thích phân tử xem ở hình 1.7 và bảng 3- 2.
21
Hình 1.7: Dải phổ điện từ
Bảng 1- 2. Các dải phổ điện tử và các kiểu kích thích phân tử
Bước sóng Số sóng
o
λ (A )
Tên vùng phổ
Kiểu kích thích
Tia Rơnghen
Kích thích eletron lớp trong
Tử ngoại xa
Kích thích eletron σ
Tử ngoại gần
Kích thích eletron π
2,5.10
Vùng nhìn thấy
Kích thích eletron π hệ liên hợp
1,25.104
-1
(cm )
50
2.103
2.100
4.10
3
4
8.10
3
2,5.104
5.10
5
5.10
6
3.1010
5.10
4
Hồng ngoại gần
Dao động phân tử
3
Hồng ngoại trung
Dao động phân tử
2
Hồng ngoại xa
Dao động phân tử
Vi sóng
Chuyển động quay
4.10
2.10
20
0,33.10
-2
Sóng ngắn Radio
1.2.3.1. Phương pháp phổ hồng ngoại
Vùng hồng ngoại được khảo sát bằng các máy thông thường có số sóng từ 500 cm-1
đến 5000 cm-1.
Sự hấp thụ bức xạ hồng ngoại gần và trung có liên quan đến dao động của các
nguyên tử hay nhóm nguyên tử trong phân tử. Phổ hồng ngoại của một hợp chất được ghi
một cách tự động dưới dạng một giản đồ, tại đó các cực đại hấp thụ ứng với dao động đặc
trưng của một nhóm nguyên tử hay một liên kết nhất định.
Hình 1.8: Phổ hồng ngoại của axeton CH3COCH3
22
Trong phép gần đúng bậc nhất, tần số dao động cơ bản của một phân tử phụ thuộc
vào khối lượng m1, m2 của các nguyên tử hay nhóm nguyên tử và lực liên kết giữa chúng.
ν=
kM
M
1
2
Trong đó:
k: hằng số lực
M: khối lượng rút gọn:
1
1
1
=
+
M
m2
m1
Một phân tử có N nguyên tử nói chung có 3N bậc tự do trong đó có ba bậc là chuyển
động tịnh tiến, còn lại là các bậc tự do đặc trưng cho dao động và quay của phân tử. Các
phân tử có cấu trúc thẳng có 3N – 5 bậc tự do, còn không thẳng thì có 3N – 6 bậc tự do dành
cho dao động. Các dao động đó có thể là:
-
Dao động hóa trị: Làm thay đổi khoảng cách giữa các nguyên tử và theo hướng trục
liên kết.
-
Dao động biến dạng: Làm thay đổi góc hóa trị, còn khoảng cách nguyên tử không
đổi.
Thường dao động hóa trị hấp thụ năng lượng lớn hơn ( ở bước sóng ngắn hơn) dao
động biến dạng. Tuy nhiên phổ hồng ngoại chỉ xuất hiện với những dao động làm thay đổi
momen lưỡng cực của phân tử. Những dao động hóa trị đối xứng ở các phân tử đối xứng
không có phổ hồng ngoại.
Bảng 1- 3: Một số tần số hấp thụ hồng ngoại đặc trưng
Liên kết
Loại hợp chất
Số sóng ( cm-1)
Cường độ hấp thụ
C- H
Ankan
2850- 2960
Mạnh
=C–H
Anken và aren
3010 - 3100
Trung bình
Ankin
3300
Mạnh
-C- C-
Ankan
600 - 1500
yếu
- C = C-
Anken
1620- 1680
Thay đổi
-C C-
Ankin
2100- 2260
Thay đổi
-C N-
Nitrin
2200-2300
Thay đổi
-C–O-
rượu, ete, axit, este 1000 - 1300
Mạnh
-C=O
- Andehit – CHO
1720- 1740
Mạnh
- xeton
1705- 1725
Mạnh
Axit, este
1700- 1750
Mạnh
- O- H
Ancol, phenol
3590 – 3650
Thay đổi
- O- H
Liên
C- H
trong
kết
hydro 3200 – 3400
Mạnh
ancol,
phenol
– O – H …O 23
-O–H
Liên
kết
hydro 2500 - 3000
Thay đổi
trong axit
- NH2
Amin bậc nhất
3300 – 3500 píc kép
Trung bình
-N–H
Amin bậc hai
3300 – 3500 píc đơn
Trung bình
Căn cứ vào những tần số hấp thụ đặc trưng ta có thể nhận biết sự có mặt của các
nhóm nguyên tử hay liên kết đặc trưng trong phân tử. Đồng thời các hiệu ứng các nhóm
khác cũng ảnh hưởng làm dịch chuyển tần số đặc trưng đó trong một phạm vi nhất định.
Căn cứ vào độ dịch chuyển ta cũng rút ra được những kết luận nhất định về đặc điểm cấu
trúc phân tử. Căn cứ vào phổ hồng ngoại ta cũng nhận biết được độ tinh khiết của một hợp
chất ( không có lẫn giải hấp thụ lạ).
Ta cũng có thể phân tích định lượng nhờ phổ hồng ngoại bằng cách áp dụng định luật
Lamber – Beer. Tuy nhiên khi đó cần ánh sáng đơn sắc (ví dụ, tia laze) hoặc so sánh với
đường cong chuẩn
1.2.3.2. Phương pháp phổ Raman
- Phổ Raman (còn gọi là phổ khuếch tán tổ hợp) cũng cho phép xác định tần số dao
động và quay của phân tử, đồng thời nó là phương pháp nghiên cứu bổ sung tốt cho phổ
hồng ngoại.
+ Những dao động hóa trị đối xứng không cho vạch hấp thụ hồng ngoại thì lại hiện
rõ trong phổ Raman
+ ngược lại có tần số dao động không có trong phổ Raman thì lại có trong phổ hồng
ngoại.
Ví dụ, dao động hoá trị của liên kết C=C trong
CCl2 = CCl2 hay C2H4 không có vạch hấp thụ rõ nét
trong phổ hồng ngoại, nhưng lại có cực đại hấp thụ rất
mạnh trong phổ Raman.
- Thiết bị chụp phổ Raman khá đơn giản
+ Cho bức xạ đơn sắc (đèn thuỷ ngân hoặc tia
lazer) đi qua mẫu, rồi thu và phân tích phổ của ánh sáng
khuếch tán theo phương thẳng góc phương truyền của
tia ban đầu.
- Nguyên tắc:
+ Phổ Raman phát sinh ra do có sự chiếm đoạt chớp
nhoáng (tương tác) các photon nhẹ của tia tới bởi phân
Hình 1-7
tử chất mẫu và sau đó nhường cho phân tử một phần năng lượng của mình để các chuyển
động dao động trong phân tử, photon đó lại được bức xạ lại thành ánh sáng khuếch tán có
năng lượng và tần số thấp hơn tia tới.
24
+ Ngược lại có những photon khác khi tương tác với các phân tử đang ở trạng thái kích
thích lại nhận được phần năng lượng đó khi phân tử trở lại trạng thái cơ bản và được bức xạ
với tần số cao hơn ban đầu.
+ Chính vì vậy phổ Raman luôn có các vạch hấp thụ bổ sung sắp xếp đối xứng nhau ở
phía trên và phía dưới vạch chính thức với tần số tia tới. Chênh lệch tần số Δν giữa các vạch
chính và vạch phụ ấy ứng với mức năng lượng dao động và quay trong phổ hồng ngoại.
- Bằng cách so sánh phổ hồng ngoại và phổ Raman cũng giúp cho chúng ta biết được
tính đối xứng của phân tử. Phân tử không đối xứng thì mọi vạch hấp thụ trong phổ hồng
ngoại phải tương ứng với phổ Raman. Ngược lại phổ dao động của những liên kết đối xứng
trong các phân tử đối xứng chỉ có vạch hấp thụ ở phổ Raman.
1.2.3.3. Phổ electron
- Quá trình hấp thụ ánh sáng ở vùng tử ngoại và vùng ánh sáng thấy dẫn đến sự thay
đổi mức năng lượng electron trong phân tử. Các electron chuyển từ trạng thái liên kết lên
trạng thái phản liên kết hay trạng thái kích thích.
Trong phân tử, các electron có thể chiếm các obitan khác nhau: obitan liên kết ký
hiệu là σ, π, obitan phản liên kết kí hiệu σ*, π*; và mức không liên kết là n. Các obitan σ có
ở mọi liên kết đơn và liên kết bội, trong khi obitan π chỉ có ở liên kết bội, obitan không liên
kết n do các cặp electron không chia của dị tố (như O, N) trong phân tử chiếm giữ. Khi bị
kích thích bởi ánh sáng có năng lượng cao, có thể xảy ra sự hấp thụ photon để thực hiện các
bước nhảy electron n
π* ,π
π*, n
σ*, σ
σ*, như sơ đồ ở hình sau:
σ* phản liên kết
E
π* phản liên kết
n - σ*
n - π*
σ - π*
π - π*
σ - σ*
n không liên kết
π liên kết
σ liên kết
Hình 1-8: Sơ đồ biểu diễn trạng thái electron trong phân tử và
các bước chuyển electron trong phân tử
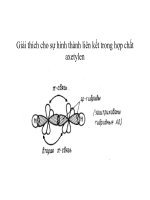
Các bước chuyển σ σ* cần năng lượng kích thích cao nhất vì nó hấp thụ trông
vùng tử ngoại chân không ở ν > 50000 cm-1. Sự hấp thụ ánh sáng trong vùng tử ngoại gần
và vùng khả kiến chứng tỏ trong phân tử có các trạng thái electron π và n (có liên kết bội và
cặp electron không chia). Khi có hiệu ứng liên hợp, vùng hấp thụ luôn dịch về phía bước
sóng dài hơn, đồng thời cường độ hấp thụ tăng lên.
Ví dụ:
H2C = CH2
: λmax = 162 nm; max = 10.000 (1620 Ao)
CH2 = CH – CH = CH2
: λmax = 217 nm; max = 21000
25