Axit nitric và bài toán quy đổi
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (299.17 KB, 46 trang )
BÁO CÁO KẾT QUẢ
NGHIÊN CỨU, ỨNG DỤNG SÁNG KIẾN
1. LỜI GIỚI THIỆU
Nhiệm vụ trọng tâm của dạy học nói chung và dạy môn Hóa học nói riêng là
thực hiện mục tiêu đổi mới dạy học và kiểm tra đánh giá theo định hướng phát triển
năng lực học sinh: năng lực tư duy, năng lực sáng tạo, năng lực giải quyết vấn đề…
Để hình thành các năng lực đó cho học sinh, giáo viên cần trang bị cho học sinh các
kĩ năng cần thiết: kĩ năng tìm tòi, kĩ năng giải bài tập, kĩ năng hệ thống hóa kiến
thức, kĩ năng liên hệ các kiến thức...
Do vậy vai trò của người giáo viên trong nhà trường là rất quan trọng. Họ như
những huấn luyện viên còn học sinh như các vận động. Trong quá trình dạy học ở
trường phổ thông, bồi dưỡng và phát huy năng lực tư duy sáng tạo cho học sinh là
một nhiệm vụ quan trọng
Hoá học là bộ môn khoa học thực nghiệm và lí thuyết, cung cấp cho học sinh
những tri thức hóa học phổ thông tương đối hoàn chỉnh về các chất, sự biến đổi các
chất, mối liên hệ giữa công nghệ hóa học, môi trường và con người. Trong bộ môn
Hóa học thì chuyên đề về axit NITRIC (H+, NO3-) là một mảng kiến thức rất quan
trọng, đề thi trung học phổ thông quốc gia liên tục xuất hiện các câu hỏi về axit
nitric rất hay, đặc biệt mấy năm trở lại đây, bài tập axit nitric (H+, NO3-) thuộc mức
điểm cao trong đề thi THPT Quốc gia, thậm chí ở mức điểm 10. Các dạng bài tập
về axit nitric (H+, NO3-) rất đa dạng và phong phú. Kiến thức về axit nitric (H+,
NO3-) trong sách giáo khoa lớp 11 còn ít, đọc xong ta rất khó tổng hợp được kiến
thức và vận dụng để giải bài tập. Sách tham khảo đã tương đối nhiều, tuy nhiên một
bài toán cũng được khai thác dưới rất nhiều cách giải khác nhau, nếu không hiểu
bản chất thì các em rất khó để giải quyết được.
Khi gặp các bài toán về axit nitric (H+, NO3-), tôi nhận thấy học sinh gặp lúng
túng trong việc tìm ra phương pháp giải phù hợp. Với mong muốn khắc phục khó
1
khăn của học sinh và bản thân tôi muốn giảng dạy bài tập về axit nitric (H+, NO3-),
tôi làm đề tài “Axit nitric và bài toán quy đổi”. Sáng kiến này sẽ là tài liệu tham
khảo dễ hiểu, giúp các em có cái nhìn đơn giản hơn đối với những bài toán dạng
trên đồng thời giải quyết chúng một cách nhanh hơn và hiệu quả hơn.
2. TÊN SÁNG KIẾN: “Axit nitric và bài toán quy đổi”
3. LĨNH VỰC ÁP DỤNG SÁNG KIẾN: Khi giảng dạy chương “Nitơ - Photpho”
lớp 11, học sinh được học về axit nitric và khi học sinh ôn thi học sinh giỏi lớp 11,
học sinh giỏi lớp 12 và ôn thi THPT Quốc gia. Thời lượng học lý thuyết về axit
nitric (H+, NO3-) rất ít, nhưng bài tập quy đổi có axit nitric (H +, NO3-) lại rất đa
dạng và khó. Việc xây dựng chuyên đề từ cách triển khai dạy học bài axit nitric đến
dạng bài tập quy đổi có H+, NO3- là rất quan trọng, để có thể củng cố và bổ sung
kiến thức của học sinh, là tài liệu giúp học sinh ôn tập vì bài tập quy đổi có H +,
NO3- đang được khai thác ngày càng nhiều và là những câu lấy điểm cao trong các
kỳ thi.
4. NGÀY SÁNG KIẾN ĐƯỢC ÁP DỤNG LẦN ĐẦU: 5/9/2018
5. MÔ TẢ BẢN CHẤT CỦA SÁNG KIẾN:
2
PHẦN MỘT: TỔNG QUAN
I. MỤC ĐÍCH NGHIÊN CỨU
Muốn thay đổi cách dạy học truyền thống sang hướng dạy nghiên cứu bài học,
lấy học sinh làm trung tâm của mọi nhiệm vụ, giáo viên chỉ là người hướng dẫn và
chuyển giao nhiệm vụ. Hệ thống hóa các phương pháp quy đổi có H +, NO3- từ dễ
đến khó giúp học sinh biết cách giải và giải nhanh được các bài tập.
II. NHIỆM VỤ NGHIÊN CỨU
- Xây dựng bài dạy axit nitric theo hướng nghiên cứu bài học.
- Lựa chọn và sử dụng các bài tập quy đổi từ dễ đến khó khi dạy về axit nitric
(H+, NO3-) thuộc chương Nitơ – Photpho, Hóa học 11.
- Phân dạng và giới thiệu phương pháp tối ưu liên quan để giải các dạng bài tập
quy đổi về axit nitric (H+, NO3-), từ đó học sinh vận dụng linh hoạt trong các bài
toán cụ thể.
- Thực nghiệm sư phạm với các lớp học sinh khác nhau, để đánh giá hiệu quả
của đề tài, từ đó kết luận về khả năng áp dụng đề tài.
III. ĐỐI TƯỢNG NGHIÊN CỨU
“Axit nitric và bài toán quy đổi” trong chương trình Hóa học 11, chương
“Nitơ - Photpho”, trong dạy học ôn thi học sinh giỏi và THPT quốc gia cho học
sinh lớp 11, 12 trường THPT Nguyễn Thái Học, để phát triển năng lực tư duy sáng
tạo của học sinh.
IV. PHẠM VI NGHIÊN CỨU
- Phạm vi về nội dung: nội dung kiến thức lý thuyết về axit nitric (H+, NO3-)
và các dạng bài tập quy đổi liên quan
- Phạm vi kiến thức
Trong khuôn khổ các bài tập axit nitric (H+, NO3-) đã được khai thác trong các
đề thi đại học, THPT quốc gia, học sinh giỏi 11, 12 tại tỉnh Vĩnh Phúc nên trong
sáng kiến kinh nghiệm của mình:
3
+ Việc tiếp nhận kiến thức về axit nitric, tôi xây dựng theo hướng nghiên cứu
bài học.
+ Mỗi bài toán quy đổi có axit nitric (H+, NO3-) có thể có nhiều cách giải, tôi chỉ
đưa ra một cách giải mà ở thời điểm hiện tại tôi cho là tối ưu để giải quyết bài toán.
Một số dạng quy đổi cơ bản tôi đưa ra nhiều cách giải để so sánh, đối chiếu.
+ Tôi sắp xếp cấu trúc bài tập từ dễ đến khó, từ lý thuyết đến bài toán để học
sinh dễ tiếp cận.
- Phạm vi về thời gian: tiến hành nghiên cứu đề tài từ tháng 9/2018, thực
nghiệm sư phạm từ tháng 10/2018 và sẽ còn tiếp tục phát triển.
V. PHƯƠNG PHÁP NGHIÊN CỨU
- Phương pháp thu thập thông tin: kiến thức lý thuyết và bài tập của liên
quan đến đề tài; hệ thống bài tập từ lý thuyết đến bài tập, từ cơ bản đến nâng cao;
lấy ý kiến của các giáo viên.
- Phương pháp nghiên cứu tài liệu: Học sinh đọc tài liệu trước khi học
chuyên đề; làm hệ thống câu hỏi, bài tập giáo viên giao; làm bài kiểm tra
- Phương pháp thực nghiệm sư phạm: tiến hành thực nghiệm với nhiều đối
tượng học sinh (nhiều lớp, nhiều học sinh), trao đổi kinh nghiệm với các giáo viên
trên địa bàn cụm Vĩnh Yên.
- Phương pháp thống kê toán học: xử lí và phân tích số liệu thực nghiệm sư
phạm.
VI. CƠ SỞ THỰC HIỆN GIẢI PHÁP
1. Nhân lực
+ Tác giả sáng kiến chịu trách nhiệm chính thiết kế bài giảng, làm hệ thống các
dạng bài tập quy đổi về axit nitric (H+, NO3-)
+ Học sinh lớp 12A6 – THPT Nguyễn Thái Học (đầu vào thấp của trường)
+ Học sinh lớp 11A3 – THPT Nguyễn Thái Học (đầu vào cao của trường)
2. Cơ sở vật chất:
Dùng phần mềm McMic trộn các câu hỏi trắc nghiệm
4
Dùng phần mềm powerpoint để soạn giảng bài axit nitric
Dùng phòng học bộ môn hóa học để dạy bài axit nitic
Giáo viên photo tài liệu phát cho học sinh làm bài, thống kê, đánh giá
5
PHẦN HAI: GIẢI QUYẾT VẤN ĐỀ
A. TÊN CHUYÊN ĐỀ
- Tên: Axit nitric và bài toán quy đổi
(Bài 9: Axit nitric và muối nitrat – Hóa học 11 – Ban cơ bản)
- Đối tượng học sinh: Học sinh lớp 11
- Số tiết dự kiến: 6 tiết
B. XÂY DỰNG KẾ HOẠCH DẠY HỌC
CHỦ ĐỀ: AXIT NITRIC VÀ BÀI TOÁN QUY ĐỔI
BÀI 9: AXIT NITRIC VÀ MUỐI NITRAT
Giới thiệu chung
- Bài Axit nitric và muối nitrat gồm các nội dung: Cấu tạo phân tử, tính chất vật lý,
tính chất hóa học, ứng dụng, điều chế axit nitric. Tính chất vật lý, tính chất hóa học,
ứng dụng của muối nitrat.
- Chủ đề Axit nitric và bài toán quy đổi bao gồm các nội dung: Cấu tạo phân tử,
tính chất vật lý, tính chất hóa học, ứng dụng, điều chế axit nitric. Bài toán quy đổi
có axit nitric.
- Bài giảng được thiết kế theo hướng: Giáo viên là người tổ chức, định hướng các
hoạt động học tập còn học sinh thực hiện các nhiệm vụ do giáo viên chuyển giao
một cách chủ động, tích cực. Giáo viên theo dõi quá trình thực hiện nhiệm vụ của
học sinh hỗ trợ kịp thời những khó khăn, vướng mắc nhằm giúp học sinh giải quyết
vấn đề học tập một cách hiệu quả, phù hợp với mục tiêu phát triển năng lực cho học
sinh.
- Bài giảng thực hiện trong 3 tiết: 1 tiết nghiên cứu về cấu tạo phân tử, tính chất vật
lý, tính chất hóa học, ứng dụng. 2 tiết còn lại nghiên cứu về điều chế axit nitric và
các dạng bài toán quy đổi có HNO3
I. Mục tiêu
1. Kiến thức, kỹ năng, thái độ
a. Kiến thức
6
- HS nêu được: Cấu tạo phân tử và số oxi hóa của nito trong HNO 3, tính chất vật lí
(trạng thái, màu sắc, tính tan), ứng dụng của axit nitric. Một số dạng toán quy đổi
oxit kim loại đã được học ở chương trình hóa 10 chương oxi – lưu huỳnh.
HS giải thích được: Axit nitric vừa có tính axit mạnh (5 tính chất chung của axit:
làm quỳ tím hóa đỏ, tác dụng với bazo, tác dụng với oxit bazo, tác dụng với kim
loại, tác dụng với muối), vừa có tính oxi hóa rất mạnh (oxi hóa hầu hết các kim
loại, một số phi kim, nhiều hợp chất vô cơ và hữu cơ), tuy nhiên trọng tâm là tính
oxi hóa mạnh (N+5 bị khử về các số oxi hóa thấp hơn như N+4, N+2, N-3, N0)
b. Kĩ năng
- Dựa vào sự điện li của HNO 3 dự đoán được tính axit mạnh của HNO 3, kiểm tra dự
đoán bằng thí nghiệm và rút ra kết luận.
- Dựa vào số oxi hóa của nito trong HNO 3 dự đoán được tính oxi hóa của HNO 3,
quan sát thí nghiệm, hình ảnh..., rút ra nhận xét về tính oxi hóa rất mạnh của HNO3.
- Viết các PTHH dạng phân tử, ion rút gọn minh họa tính chất hóa học của axit
nitric đặc và loãng
c. Thái độ
- Say mê, hứng thú trong học tập bộ môn.
- Có ý thức bảo vệ môi trường, sử dụng hóa chất đủ liều lượng và hiệu quả
- Thực hiện thí nghiệm cẩn thận
2. Định hướng các năng lực cần hình thành và phát triển
- Năng lực tự học, năng lực hợp tác
- Năng lực thực hành hóa học.
- Năng lực giải quyết vấn đề thống qua môn hóa học
- Năng lực vận dụng kiến thức môn hóa học vào cuộc sống
II. Chuẩn bị
1. Giáo viên
- Video, máy tính, máy chiếu
7
- Dụng cụ, hóa chất: quỳ tím, CuO, dung dịch NaOH, CaCO 3, Cu, Zn, HNO3 đặc,
HNO3 loãng, dung dịch HCl, ống nghiệm, đèn cồn, giá thí nghiệm, giá đỡ ống
nghiệm, bông, nút cao su, cốc thủy tinh.
2. Học sinh
- Ôn lại kiến thức cũ: Cách viết công thức cấu tạo của axit có oxi, phản ứng oxi hóa
khử, phương trình ion rút gọn, bài toán quy đổi đã học ở bài axit sunfuric đặc
- Chuẩn bị bài mới theo sách giáo khoa.
III. Thiết kế, tổ chức hoạt động học
1. Giới thiệu chung
- Tình huống xuất phát: Khai thác kiến thức đã học ở lớp 10 bài axit sunfuric và
kiến thức thực tế về phương pháp quy đổi có axit nitric, tạo hứng thú học tập cho
học sinh, sử dụng kĩ thuật KWLH.
- Hoạt động hình thành kiến thức: Phương pháp dạy học chủ yếu: Phương pháp sử
dụng thí nghiệm (TN đối chứng, TN nghiên cứu) và phương pháp dạy học hợp tác
theo nhóm. Thông qua thí nghiệm và hoạt động nhóm, HS rút ra được tính chất hóa
học cơ bản của axit nitric: Tính axit và tính oxi hóa mạnh. Nhận dạng được bài toán
quy đổi có axit nitric
- Hoạt động luyện tập gồm các câu hỏi nhằm củng cố, khắc sâu kiến thức trọng tâm
bài.
- Hoạt động vận dụng, tìm tòi được thiết kế cho các nhóm HS tìm hiểu tại nhà giúp
cho HS phát triển năng lực vận dụng kiến thức hóa học vào giải quyết các vấn đề
thực tiễn và tạo kết nối với bài học tiếp theo.
2. Tổ chức các hoạt động cho HS
hoạt động 1: Tình huống xuất phát
a) Mục đích hoạt động
Huy động các kiến thức đã được học, kiến thức thực tế của HS về axit nitric và
tạo nhu cầu tiếp tục tìm hiểu kiến thức mới của HS.
8
b) Nội dung hoạt động
HS xem hình ảnh, nêu những điều mình đã biết và những điều mình muốn biết
tìm hiểu thêm về axit HNO3
c) Phương thức tổ chức hoạt động
GV cho HS hoạt động nhóm: xem hình ảnh và trả lời câu hỏi (trước khi HS xem
hình ảnh, GV yêu cầu HS sẽ phải trả lời các câu hỏi sau):
1. Hình ảnh trên nói đến hiện tượng gì trong cuộc sống?
2. Hãy cho biết những điều em đã được biết, những điều em muốn biết thêm về
axit được nói đến.
K
W
L
H
(điều đã biết)
(điều muốn biết)
(điều học được)
(học bằng cách nào)
d) Dự kiến sản phẩm của HS
- HS sẽ trả lời hiện tượng được nói đến là hiện tượng mưa axit. Axit được nhắc
đến trong hình ảnh là axit nitric.
- HS có thể nói được một số điều đã biết về axit nitric như: Axit nitric có công
thức phân tử là HNO3, số oxi hóa của N là +5, tan nhiều trong nước, là một axit
mạnh làm quỳ tím hóa đỏ, tác dụng với bazo, tác dụng với oxit bazo, tác dụng với
muối, tác dụng với kim loại. Khi làm bài toán quy đổi có HNO 3. HS có thể nêu
được dạng quy đổi oxit như: Khi quy đổi hỗn hợp nhiều chất (Ví dụ: hỗn hợp X
gồm: Fe, FeO, Fe2O3 và Fe3O4 ...) (từ 3 chất trở lên) thành hỗn hợp hai chất ( như:
Fe, O hoặc FeO, Fe2O3 hoặc Fe, FeO hoặc Fe, Fe 2O3 hoặc Fe, Fe3O4 hoặc ...) một
chất ( như: FexOy hoặc…)
- HS có thể nêu một số vấn đề muốn tìm hiểu thêm về axit HNO 3 như: Công thức
cấu tạo của HNO3, ngoài tính tan thì HNO3 còn có thêm những tính chất vật lí nào?
Ngoài tính axit thì HNO3 còn có tính chất hóa học gì? Tại sao? HNO3 là chất oxi
9
hóa mạnh hay yếu? Thể hiện khi tác dụng với những chất nào? Với dạng toán quy
đổi có HNO3 ngoài dạng quy đổi oxit sắt thì còn có các dạng quy đổi nào như: quy
đổi hỗn hợp FeS, FeS2, Cu2S … về các nguyên tố Fe, Cu, S; quy đổi tác nhân oxi
hóa, quy đổi hỗn hợp sản phẩm khử chứa nito…
Dự kiến một số khó khăn vướng mắc của HS và giải pháp hỗ trợ:
HS có thể không nêu hết được những điều muốn tìm hiểu về HNO 3, khi đó GV
có thể có một số gợi ý khéo léo HS như: Các em có muốn tìm hiểu xem ngoài
những HNO3 được xếp vào axit loại mấy? Vì sao? Tính chất hóa học đặc trưng của
HNO3 là gì? HNO3 tác dụng được với các chất nào? Điều kiện phản ứng của HNO 3
vói các chất đó như thế nào? Ngoài dạng quy đổi ở trên thì trong bài toán có HNO 3
còn có dạng quy đổi nào khác? Cách xử lí số liệu của các dạng mới này? Hiện nay
liên quan đến HNO3, những bài toán nào chinh phục điểm giỏi? Có sử dụng
phương pháp quy đổi để giải quyết bài toán đó không? Phương pháp quy đổi tác
nhân oxi hóa, quy đổi hỗn hợp sản phẩm khử của nito.
e) Kiểm tra, đánh giá kết quả hoạt động
+ Thông qua quan sát, GV biết được mức độ hoạt động tích cực của các nhóm và
của các HS
+ Thông qua cột K và cột W trong bảng KWLH của các nhóm, GV biết được HS
đã biết những gì về phương pháp quy đổi này, HS muốn biết thêm các dạng nào của
phương pháp này. Từ đó GV có thể nhận xét, đánh giá sơ bộ giữa các nhóm.
Hoạt động 2: Hình thành kiến thức
a) Mục tiêu hoạt động
- HS nêu được: Cấu tạo phân tử và số oxi hóa của nito trong HNO 3, tính chất vật
lí (trạng thái, màu sắc, tính tan), ứng dụng của axit nitric. Một số dạng toán quy đổi
oxit kim loại đã được học ở chương trình hóa 10 chương oxi – lưu huỳnh.
10
- HS giải thích được: Axit nitric vừa có tính axit mạnh (5 tính chất chung của
axit: làm quỳ tím hóa đỏ, tác dụng với bazo, tác dụng với oxit bazo, tác dụng với
kim loại, tác dụng với muối), vừa có tính oxi hóa rất mạnh (oxi hóa hầu hết các kim
loại, một số phi kim, nhiều hợp chất vô cơ và hữu cơ), tuy nhiên trọng tâm là tính
oxi hóa mạnh (N+5 bị khử về các số oxi hóa thấp hơn như N+4, N+2, N-3, N0)
b) Nội dung hoạt động
ND1: Tìm hiểu cấu tạo phân tử, tính chất vật lý, ứng dụng của axit nitric.
ND2: Tìm hiểu về tính chất hóa học, điều chế axit nitric trong phòng thí nghiệm và
trong công nghiệp
ND3: Tìm hiểu về các dạng toán quy đổi có HNO3
c) Phương thức tổ chức hoạt động
ND1: Tìm hiểu cấu tạo phân tử, tính chất vật lý, ứng dụng của axit nitric.
* GV cho HS hoạt động nhóm (mỗi nhóm từ 4 – 6 HS: 10 nhóm 4): Nghiên
cứu SGK và quan sát lọ đựng dung dịch HNO3 để trả lời các câu hỏi sau (ghi kết
quả vào bảng phụ; GV ghi câu hỏi ra phiếu học tập, sử dụng máy chiếu để chiếu
câu hỏi cho HS…)
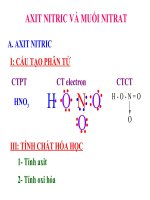
Câu 1:
+ Viết CTCT của phân tử HNO3. Xác định số oxi hóa của nitơ trong HNO3?
+ Liên kết trong phân tử HNO3? Phân tử HNO3 có phân cực không?
Câu 2: Nêu tính chất vật lý của HNO3?
+ Trạng thái
+ Màu sắc
+ Độ bền
+ Tính tan trong nước
+ Nồng độ của HNO3 đậm đặc và khối lượng riêng
Câu 3: Ứng dụng của HNO3?
11
ND2: Tìm hiểu về tính chất hóa học, điều chế axit nitric trong phòng thí nghiệm và
trong công nghiệp
- GV: Yêu cầu HS viết phương trình điện li của HNO 3, từ đó dự đoán được
tính chất hóa học nào? Thể hiện khi tác dụng với các chất nào?
GV: Yêu cầu HS làm thí nghiệm theo nhóm như cũ chứng minh tính axit
mạnh của HNO3 với:
+ Quỳ tím
+ CuO
+ Ca(OH)2
+ CaCO3
Nhận xét hiện tượng, viết phương trình phân tử và ion thu gọn.
GV: Từ số oxi hóa của N trong phân tử HNO 3 dự đoán tính chất hóa học của
HNO3?
- GV: cho HS quan sát thí nghiệm đối chứng, nhận xét, viết phương trình
+ Cu tác dụng với HCl
+ Cu tác dụng với HNO3 loãng, đặc
Xác định vai trò của HNO3 trong các phản ứng trên?
GV: Cho các 5 nhóm HS tiến hành thí nghiệm của Fe với HNO 3 đặc nóng, 5
Nhóm tiến hành thí nghiệm của Fe với HNO3 đặc nguội. Các nhóm quan sát kết
quả của nhau nhận xét hiện tượng, rút ra kết luận?
- GV: Cho HS quan sát video thí nghiệm của HNO 3 đặc với C, S; thí nghiệm
của HNO3 đặc với FeO, để nguội, nhỏ vài giọt dung dịch NaOH vào cho đến khi có
kết tủa xuất hiện. Các nhóm HS quan sát kết quả của nhóm mình và nhóm bạn,
nhận xét, viết phương trình, xác định vai trò của HNO3 trong các phản ứng đó?
- Tiếp theo GV cho HS hoạt động cá nhân: Đọc SGK và cho biết trong phòng
thí nghiệm điều chế HNO3 bằng cách nào? Trong công nghiệp HNO 3 được sản xuất
như thế nào?
12
ND3: Tìm hiểu về các dạng toán quy đổi có HNO3
- GV: Yêu cầu HS liệt kê các dạng quy đổi đã biết? Phát phiếu học tập cho HS
hoạt động cá nhân giải các bài toán quy đổi quen thuộc, phân loại dạng toán quy
đổi đó?
d) Dự kiến sản phẩm của học sinh
Ở ND1: HS có thể trả lời các ý sau:
- Cấu tạo phân tử:
+ CTCT:
H–O–N = O
O
+ Trong ptử HNO3: N có số oxi hóa +5
+ Liên kết trong phân tử HNO 3 là liên kết cộng hóa trị có cực, phân tử HNO 3
phân cực.
- Tính chất vật lý:
+ Trạng thái: lỏng
+ Màu sắc: không màu
+ Độ bền: kém bền, khi có ánh sáng axit nitric đặc đã bị phân hủy một
phần ra khí nitơ đioxit. Khí NO2 tan trong dung dịch axit, làm cho dung dịch có
màu vàng
+ Tính tan trong nước: tan theo bất kì tỉ lệ nào
+ Nồng độ của HNO3 đậm đặc 68% và khối lượng riêng D = 1,40 g/cm3
- Ứng dụng: dùng để điều chế phân đạm, thuốc nổ, thuốc nhuộm, dược
phẩm...
Ở ND2: HS có thể thực hiện được các yêu cầu sau
- Viết được phương trình điện li của HNO3
HNO3 H+ + NO3- => là axit mạnh
- Làm được các thí nghiệm chứng minh tính axit mạnh của HNO 3, thí nghiệm
của Fe với HNO3 đặc nguội
- Viết phương trình mô tả tính axit mạnh và tính oxi hóa mạnh của HNO3.
13
1. Tính axit : HNO3 là axit mạnh
+ Quỳ tím hoá đỏ
+ Tác dụng với oxít bazơ, bazơ, muối của các axít yếu muối nitrat.
2 HNO3 + CuO Cu(NO3)2 + H2O
2HNO3 +Ca(OH)2Ca(NO3)2+2H2O
2HNO3 + CaCO3 Ca(NO3)2 + CO2 + H2O
+5
- H N O3 Số OXH cao nhất nên chỉ có thể giảm => tính oxi hoá
2. Tính oxi hoá:
+ HNO3 có số OXH + 5 có thể bị khử thành:
o
+1
+2
+4
-3
N2, N2O, NO, NO2, NH4NO3 tuỳ theo nồng độ HNO3 và khả năng khử của chất
tham gia.
a. Tác dụng với kim loại:
+ Oxy hoá hầu hết kim loại (trừ Au, Pt).
0
+5
+2
+2
3Cu +8HNO3(l) 3Cu(NO3)2 + 2NO + 4H2O
3Cu0 + 8H+ + 2NO3-→ 3Cu2+ + 2NO + 4H2O
0
+5
+2
+4
Cu + 4HNO3đ Cu(NO3)2 + 2NO2 + 2H2O
Cu0 + 4H+ + 2NO3-→ Cu2+ + 2NO2 + 2H2O
+ Fe, Al, Cr thụ động hoá với HNO3 đặc, nguội
b. Tác dụng với phi kim:
HNO3 đặc, nóng OXH được một số phi kim C,S,P,... NO2
0
5
0
5
4
4
C + 4H N O3 C O2 + 4 N O2 + 2H2O
6
4
S + 6H N O3 H2 S O4 + 6 N O2+ 2H2O
c. Tác dụng với hợp chất:
14
+ HNO3 đặc oxi hoá nhiều hợp chất vô cơ và hữu cơ
2
5
3
4
Fe O + 4H N O3 Fe (NO3)3 + N O2 + 2H2O
+ Vải, giấy, mùn cưa, dầu thông….bị phá huỷ khi tiếp xúc HNO3 đặc
- Tìm hiểu về phương pháp điều chế HNO3 trong phòng thí nghiệm dựa vào phản
ứng axit tác dụng với muối để tạo muối mới axit mới. Trong công nghiệp đi từ hóa
chất phổ biến và có nhiều nitơ.
1.Trong PTN:Cho tinh thể NaNO3 (hoặc KNO3) tác dụng với H2SO4 đặc, đun nóng
o
t
NaNO3 + H2SO4(đ) ��
� HNO3 + NaHSO4
2. Trong CN:
* Sản xuất HNO3 từ NH3, không khí: Gồm 3 giai đoạn
- Oxi hoá khí NH3 bằng oxi kk thành NO:
3
2
850 900 C , Pt
4 N H3+ 5O2 �����
� 4 N O +6H2O H < 0
o
-Oxi hoá NO thành NO2 bằng oxi kk ở điều kiện thường : 2NO + O2 2NO2
- NO2 tác dụng với nước và oxi kk tạo HNO3:
4NO2 + O2 + 2H2O 4HNO3
* Dung dịch HNO3 có nồng độ 52 – 68 %
→ Để HNO3 có nồng độ cao hơn: Chưng cất với H2SO4 đậm đặc.
Ở ND3: HS làm được một số bài tập được đưa ra
Bài toán 1: Nung m gam bột sắt trong oxi thu đựơc 3 gam hỗn hợp chất rắn X. Hoà
tan hết hỗn hợp X trong dung dịch HNO 3 dư thoát ra 0,56 lít NO (đktc) là sản phẩm
khử duy nhất. giá trị của m là:
A. 2,52 gam
B. 1,96 gam
C. 3,36 gam
D. 2,1 gam
Bài giải
Cách 1: Quy hỗn hợp chất rắn X về nguyên tử là Fe và O
Ta xem 3 gam hỗn hợp X gồm (Fe, FeO, Fe 2O3 và Fe3O4) là hỗn hợp của x
mol Fe và y mol O. Ta có: mhh =56x+16y =3 (1).
Mặt khác quá trình cho và nhận electron như sau
15
3
0
Fe 3e � Fe+ 3e
x � 3x
3x
2
0
O 2e � O
y � 2y
5
2
N 3e � N
0,0750,025
...0,18 � 0,06
Áp dụng đinh luật bảo toàn electron: ne cho = ne nhận
hay: 3.nFe = 2nO + 3nNO
hay 3x
= 2y + 0,075 (2)
Từ (1) và (2) suy ra Fe = 0,045 mol => mFe = 56.0,045 = 2,52 gam A đúng
Cách 2: Quy hỗn hợp chất rắn X về hai chất Fe, Fe2O3
Fe + 4HNO3 Fe(NO3)3 + NO + 2H2O
0,025mol
n NO
0,025mol
0, 56
0, 025mol
22, 4
m Fe2O3 = 3 - 0,025 .56 = 1,6gam
n Fe(trong Fe2O3 ) 2.
1,6
0,02mol
160
mFe = 56(0,025 + 0,02) = 2,52 gam A đúng
Chú ý: Nếu n Fe(trong Fe2O3 )
1, 6
0, 01mol mFe = 56.(0,035) = 1,96g B sai
160
Cách 3: Quy hỗn hợp chất rắn X về hai chất FeO, Fe2O3
3FeO + 10HNO3 3Fe(NO3)3 + NO + 5H2O
3.0,025
0,025
mFeO = 3.0,025 . 72 = 5,4g n Fe(FeO)
5, 4
0, 075mol
72
m Fe2O3 = 3 - 5,4 = -2,4g
n Fe(Fe2O3 )
2.(2, 4)
4,8
0, 03mol
160
160
mFe = 56 .(0,075 + (-0,03)) = 2,52 gam A đúng
16
Chú ý:
+ Kết quả âm ta vẫn tính bình thường vì đây là phương pháp quy đổi
+ Nếu n Fe(Fe2O3 ) 0,015mol mFe = 56.0,06 = 3,36g C sai
Cách 4: Quy hỗn hợp chất rắn X về một chất là Fex Oy
3FexOy + (12x - 2y)HNO3 2Fe(NO3)3 +(3x-2y)NO + (6x -y)H2O
3.0,025
3x 2y
n Fex O y
0,025mol
3
3.0, 025
56x 16y 3x 2y
x 3 M
� m Fe3O2 200
y 2
mFe = 56.nFe = 56.3.nFe3O2
m Fe(oxit )
3.56.3
2, 52g A đúng
200
Chú ý: Fe3O2 là oxit giả định, không có thật.
Nếu m Fe2O3 160 � m Fe 3.2.56160 2,1g D sai
Bài toán 2: Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe 2O3 và Fe3O4 phản ứng hết
với dung dịch HNO3 loãng dư thu được 1,344 lít khí NO (sản phẩm khử duy nhất ở
đktc) và dung dịch X. Cô cạn dung dịch X sau phản ứng được m gam muối khan.
Tính m.
A. 14,52
B. 38,72
C. 19,36
D. 53,24
Bài giải
Quy hỗn hợp chất rắn X về nguyên tử là Fe và O
Ta xem 11.36 gam hỗn hợp gồm (Fe, FeO, Fe 2O3 và Fe3O4) là hỗn hợp của
x mol Fe và y mol O. Ta có: mhh =56x+16y =11,36 (1).
Mặt khác quá trình cho và nhận electron như sau
0
3
Fe 3e � Fe+ 3e
x � 3x
3x
0
2
O 2e � O
y � 2y
5
2
N 3e � N
...0,18 � 0,06
17
Áp dụng ĐLBT electron ta được:
n e 2y 0,18 3x, 3x 2y 0,18
(2)
Giải hệ (1) và (2) => x=0,16 mol, y=0,15 mol.
n Fe( NO3 )3 n Fe x 0,16mol, m Fe( NO3 )3 0,16.242 38,72gam B đúng..
Chú ý:
8x(2) + (1) ta có mhh + 24.nNO =80x = 80nFe
nFe = 1/80(mhh + 24.nNO) (công thức tính nhanh *)
Bài toán 3: Cho 8,16 gam hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3 phản ứng hết
với dung dịch HNO3 loãng (dung dịch Y), thu được 1,344 lít NO (đktc) và dung
dịch Z. Dung dịch Z hòa tan tối đa 5,04 gam Fe, sinh ra khí NO. Biết trong các
phản ứng, NO là sản phẩm khử duy nhất của N+5. Số mol HNO3 có trong Y là
A. 0,54 mol
B. 0,78 mol
C. 0,50 mol
D. 0,44 mol
Bài giải
Quy hỗn hợp chất rắn X về nguyên tử là Fe và O
Áp dụng công thức tính nhanh * ta có nFe = 1/80(mhh + 24.nNO) = 0,12 mol
=> nO = 0,09 mol
Quy hỗn hợp chất rắn X và 5,04 gam Fe về nguyên tử là Fe và O
Ta có nO = 0,09 mol => nFe = (8,16+5,04-16.0,09)/56 = 0,21 mol
Mặc khác quá trình cho và nhận electron như sau
0
2+
Fe → Fe
+
+ 2e
2
2H + O + 2e → H O
+
-
3
2
4H + NO + 3e → NO + 2H O
Suy ra nNO = (2.nFe – 2nO)/3 = 0,08 mol
Suy ra nHNO3 = 4nNO + 2nO = 0,5 mol
Đáp án C
Bài toán 4: Hoà tan 13,875 gam hỗn hợp X gồm Fe, FeO, Fe 2O3, Fe3O4 trong dung
dịch có chứa x mol HNO3 đặc nóng. Sau phản ứng thu được 1,68 lít NO duy nhất
18
(ở đktc), dng dịch X chứa y gam muối và còn lại 1,095 gam kim loại chưa tan. Giá
trị của x và y lần lượt gần với các giá trị nào nhất?
A. 0,35 và 37
B. 0,50 và 37
C. 0,35 và 40
D. 0,50 và 40
Bài giải
Quy hỗn hợp chất rắn X về nguyên tử là Fe và O
Gọi x = nFe phản ứng và y = nO
Ta có 56x + 16y = 13,875 – 1,095 (1)
và nNO = 1,68/22,4 = 0,075 mol
Mặt khác quá trình cho và nhận electron như sau
0
2+
Fe → Fe
+
+ 2e
+
2
2H + O + 2e → H O
-
3
2
4H + NO + 3e → NO + 2H O
Áp dụng đinh luật bảo toàn electron: ne cho = ne nhận
hay: 2.nFe = 2nO + 3nNO
2x
= 2y + 0,225 (2)
Từ (1) và (2) suy ra nFe = 0,2025 mol và nO = 0,09 mol
suy ra: x = mFe(NO3)2 = 0,2025x180 = 36,45 gam
suy ra: y = mHNO3 = 4x0,075 + 2x0,09=0,48 mol
Đáp án C đúng
Bài toán 5: Cho 9,12 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch
HCl (dư). Sau khi các phản ứng xảy ra hoàn toàn, được dung dịch Y; cô cạn Y thu
được 7,62 gam FeCl2 và m gam FeCl3. Giá trị của m là
A. 9,75.
B. 8,75.
C. 7,80.
D. 6,50.
Bài giải
Áp dụng phương pháp quy đổi nguyên tử
Ta xem 9,12 gam hỗn hợp gồm FeO, Fe 2O3 và Fe3O4 là hỗn hợp của FeO và
Fe2O3.
19
Phương trình hóa học:
FeO + 2HCl → FeCl2 + H2O (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
Ta có nFeCl2 = 7,62/127 = 0,06 mol
Từ (1) => nFeO = 0,06 mol => mFeO = 4,32 gam => mFe2O3 = 4,8 gam
=> nFe2O3 = 0,03 mol. Từ (2) => nFeCl3 = 0,06 mol => mFeCl3 = 9,75 gam
Đáp án A
Chú ý:
+ Khi quy đổi tùy theo yêu cầu của bài toán mà ta quy đổi cho hợp lí,
không cứng nhắc.
+ Bài toán quy đổi có thể quy đổi bằng nhiều cách nhưng cách nào
nhanh đến đáp án và số liệu dễ xử lí thì nên ưu tiên lựa chọn.
Bài toán 6: Hoà tan hoàn toàn 49,6 gam hh X gồm Fe, FeO, Fe 2O3 và Fe3O4 bằng
H2SO4 đặc, nóng thu được dung dịch Y và 8.96 lít khí SO 2(đktc). Tính thành phần
phần trăm về khối lượng của oxi trong hỗn hợp X và khối lượng muối trong dung
dịch Y lần lượt:
A. 20,97% và 140 gam
B. 79,03% và 180 gam
C. 20,97% và 180 gam
D. 79,03% và 140 gam
Bài giải
Áp dụng phương pháp quy đổi nguyên tử
Ta xem 49,6 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 là hỗn hợp của x
mol Fe và y mol O. Ta có: mhh =56x+16y =49,6 (1).
Mặt khác quá trình cho và nhận electron như sau
3
0
Fe 3e � Fe+ 3e
x � 3x
3x
0
2
O 2e � O
y � 2y
6
4
S 2e � S
...0,8 � 0, 4
Áp dụng ĐLBT electronlectron ta được:
n e 2y 0,18 3x, 3x 2y 0,8
(2)
Giải hệ (1) và (2) => x=0,7 mol, y=0,65 mol.
20
0,65.16
1
100% 20,97%, n Fe2 (SO4 )3 n Fe 0,35mol
249,6
2
m Fe2 (SO4 )3 0,35.400 140gam � A dung
%O
Bài toán 7: Hoà tan hết m gam hỗn hợp X gồm Fe, FeS , FeS 2, và S bằng
HNO3 nóng dư thu được 9,072 lít khí màu nâu duy nhất (đktc, sản phẩm khử duy
nhất ) và dung dịch Y. Chia dung dịch Y thành 2 phần bằng nhau.
Phần 1 cho tác dụng với dung dịch BaCl 2 dư thu được 5,825 gam kết tủa
trắng.
Phần 2 tan trong dung dịch NaOH dư thu được kết tủa Z, nung Z trong
không khí đến khối lượng không đổi được a gam chất rắn.
Tính giá trị của m và a.
Bài giải
Áp dụng phương pháp quy đổi nguyên tử
Xem hỗn hợp chất rắn X là hỗn hợp của x mol Fe và y mol S.
Quá trình cho và nhận electron như sau
3
0
Fe 3e � Fe+ 3e
x � 3x
3x
0
6
S 6e � S + 6e
6yy� y6y
y�
5
4
N 1e � N
0,4050,405
mol
...0,
405 � 0, 405mol
Áp dụng ĐLBT electron ta được:
n e 3x 6y n NO2
9,072
0, 405mol, 3x 6y 0,405 (1)
22, 4
Mặt khác trong 1/2 dung dịch Y:
21
3
0
3OH
t
Fe ���
� Fe(OH)3 �(Z) ��
� Fe 2 O 3
x
mol
2
x
................................ mol
4
6
2
Ba
S(SO 24 ) ���
� BaSO 4 �
y
y
mol..................... mol
2
2
y 5,825
n BaSO4
0, 025mol y 0, 05mol
2
233
Thay vào (1) ta được x=0,035 mol
Vậy m = mX=56x+32y=56.0,035+32.0,05=3,56 gam
và a m Fe2O3
x
0,035
.160
.160 1, 4gam
4
4
Bài toán 8: Hòa tan hoàn toàn 30,4 gam chất rắn X gồm Cu, CuS, Cu2S và S bằng
HNO3 dư, thoát ra 20,16 lít khí NO duy nhất (đktc) và dung dịch Y. Thêm Ba(OH) 2
dư vào Y thu được m gam kết tủa. Tìm giá trị của m?
Nhận xét: Đối với bài này nếu giữ nguyên hỗn hợp X thì học sinh sẽ khó viết được
phương trình bảo toàn electron. Vì vây, học sinh nên sử dụng phương pháp quy đổi
để giải thì bài toán sẽ đơn giản hơn.
Cách 1: Quy đổi 1.
Quy đổi hỗn hợp X thành
Cu: x mol
S: y mol
Ta có: mX= 64x + 32y = 30,4 (1)
Sơ đồ hóa bài toán:
2
Khí N O
0
Cu
X
5
H N O3
dư
(20,16 lít,đktc)
2
0
Cu
S
Dung dịch Y
30,4 gam
2+
Cu (OH ) 2
6
SO4
2-
Ba S O4
m gam
22
Các quá trình nhường nhận electron:
0
+2
0
+6
Cu � Cu + 2e
S � S +6e
x
y
2x
2
+5
N + 3e � N
6y
2,7
0,9
Theo bảo toàn electron: 2x+ 6y = 2,7 (2)
x = 0,3 mol
Từ (1) và (2) �
Cu: 0,3 mol
; vậy X gồm
y =0,35 mol
S: 0,35 mol
Theo bảo toàn nguyên tố đối với Cu và S:
nCu ( OH )2 nCu 0, 3mol
nBaSO4 nS 0, 35mol
� m 98.0,3 233.0,35 110,95 gam
Cách 2: Quy đổi 2 (quy đổi hỗn hợp nhiều chất về hai hay một chất).
Giải:
Cu: x mol
Quy đổi hỗn hợp X thành
CuS: y mol
Ta có: mX= 64x + 96y = 30,4 (3)
Sơ đồ hóa bài toán:
2
0
Cu
X
Khí N O
5
0
Cu S
+ H NO3 dư
(20,16 lít, đktc)
Cu2+
30,4 gam
Dung dịch Y SO42-
2
Cu (OH ) 2
6
Ba S O4
Các quá trình nhường nhận electron:
0
+2
2
+6
Cu � Cu + 2e
CuS � Cu S +8e
x
y
2x
8y
2
+5
N + 3e � N
2,7
0,9
23
Theo bảo toàn electron: 2x+ 8y = 2,7 (4)
Từ (3) và (4) �
x = - 0,05 mol
; vậy X gồm
y =0,35 mol
Cu: - 0,05mol
CuS: 0,35 mol
Theo bảo toàn nguyên tố đối với Cu và S:
nCu (OH )2 �nCu nCu nCuS 0,05 0,35 0,3mol
nBaSO4 nS nCuS 0, 35mol
� m 98.0,3 233.0,35 110,95 gam
Nhận xét: Chúng ta có thể quy đổi hỗn hợp X thành (Cu và CuS) hoặc (CuS và
Cu2S) cũng thu được kết quả như trên. Sử dụng phương pháp này giúp học sinh rèn
luyện được tư duy và giải quyết bài toán nhanh, chính xác khoa học.
Như vậy các bài toán trên đều sử dụng được phương pháp quy đổi nguyên tử
để giải quyết vấn đề
Ngoài dạng quy đổi về nguyên tử, còn một số bài tập giải quyết theo hướng quy
đổi tác nhân oxi hóa như các bài tập sau đây
Bài toán 9: Hỗn hợp X gồm Fe2O3, FeO và Cu (trong đó nguyên tố oxi chiếm
16% theo khối lượng). Cho m gam X tác dụng với 500 ml dung dịch HCl 2M (dư),
thu được dung dịch Y và còn lại 0,27m gam chất rắn không tan. Cho dung dịch
AgNO3 dư vào Y, thu được khí NO (sản phẩm khử duy nhất
của N+5) và 165,1 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 40.
B. 48.
C. 32.
D. 28.
Bài giải
Đây là một kiểu câu hỏi quen thuộc và có tính chất kinh nghiệm, người giải không
nên đặt ẩn mới mà hãy xoay tất cả theo m.
Phần kết tủa chứa 1 mol AgCl và 0,2 mol Ag.
24
Xét trên toàn bộ quá trình: nH 1 2nO/X 4nNO ��
� nNO
��
� nFe2 /Y nFe/X 3nNO nAg 3.
1 0,02m
4
1 0,02m
0,2 0,95 0,015m
4
BT�T
���
� nCu2 /Y 0,01m (0,95 0,015m) 0,025m 0,95
Y
(1)
(2)
(1) (2)
����
� 56.(0,95 0,015m) 64.(0,025m 0,95) (1 0,16 0,27)m��
� m 40 (gam)
Chọn đáp án A.
Bài toán 10: Hòa tan hoàn toàn 15,6 gam hỗn hợp gồm Fe, Fe3O4, Fe2O3, Mg, MgO
và CuO vào 200 gam dung dịch H2SO4 và NaNO3, thu được dung dịch X chỉ chứa
muối sunfat trung hòa của kim loại, hỗn hợp khí Y gồm 0,01 mol N2O và 0,02 mol
NO. Cho X phản ứng với dung dịch Ba(OH)2 dư, thu được 89,15 gam kết tủa. Lọc
kết tủa nung trong không khí đến khối lượng không đổi, thu được 84,386 gam chất
rắn. Nồng độ phần trăm của FeSO4 trong X có giá trị gần nhất với giá trị nào sau
đây?
A. 0,85.
B. 1,06.
C. 1,45.
D. 1,86.
Bài giải
nNaNO nN/� 0,04
Có ngay
3
Đặt nH SO
2
4
�
�nO/hh a 0,09
a nBaSO ��
��
4
�nOH/89,15 gam n()/X nNa 2a 0,04
25