bộ đề kiểm tra hoá 8 cả năm - có ma trận và đáp án
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (151.32 KB, 11 trang )
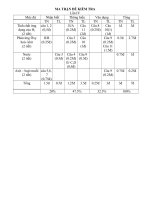
B à i K i ể m t r a 4 5 s ố 1 M ô n h o á h ọ c 8
A/ Ma trận đề
Nội dung kiến
thức
Nhận biết Thông hiểu Vận dụng Tổng
điểm
TN TL TN TL TN TL
Nguyên tử
Phân tử
I.1 0,5đ I.3 0,5đ
Đơn chất
Hợp chất
I.10 0,5 đ I.2 0,5đ
I.7 0,5đ
I.8 0,5đ
Qui tắc hoá trị
I.9 0,5đ
I.4 0,5đ
I.5 0,5đ
I.6 0,5đ
Công thức hoá
học
II.11 2đ
II.12
3đ
0,5đ 2đ 1,5đ 3đ 3đ 10đ
B/ Đề bài
I/ Trắc nghiệm khách quan (4điểm).
Khoanh tròn phơng án đúng trong các câu sau đây:
Câu 1:
A. Proton mang điện tích dơng, electron mang điện tích âm.
B. Proton và electron có khối lợng khác nhau.
C. Proton khó bị tách khỏi nguyên tử còn electron có thể bị tách khỏi nguyên tử.
D. Cả A, B, C đều đúng.
Câu 2: Để tạo đợc một hợp chất thì cần tối thiểu:
A. 1 loại nguyên tử
B. 2 loại nguyên tử
C. 3 loại nguyên tử
D. 2 loại nguyên tử trở lên.
Câu 3: Một hợp chất mà phân tử gồm 2 nguyên tử nguyên tố X liên kết với 3 nguyên tử nguyên tố
oxi và có phân tử khối là 160 đvC. X là:
A. Fe B. Mg C. Zn D. Cu
Câu 4: Biết hoá trị của P là V. Công thức hoá học phù hợp với quy tắc hoá trị là:
A. P
4
O
4
B. P
4
O
10
C.P
5
O
2
. D. P
2
O
5
Câu 5: Nguyên tố X có hoá trị II, nguyên tố Y có hoá trị III. Hợp chất tạo bởi X và Y có công thức
hoá học là:
A. XY B. X
2
Y
3
C. X
3
Y
2
D. XY
3
Câu 6: Dãy các công thức hoá học viết đúng quy tắc hoá trị là:
A. CaO, ZnCl
2
, AlPO
4
, HCl
2
B. MgSO
4
, CuO, Fe
2
(NO
3
)
3
, HCl
C. K
2
O, HgCl
2
, H
3
SO
4
, MgCl
D. Na
2
O, H
3
PO
4
, Al(OH)
3
, K
2
CO
3
Câu 7: Khối lợng tính theo gam của nguyên tử Ca là:
A. 6,64.10
-24
B. 6,64.10
-26
C. 6,64.10
-25
D. 6,64.10
-23
Câu 8: Trong phân tử của hợp chất A có chứa hai loại nguyên tử là nguyên tử đồng và nguyên tử
clo. PTK của A là 135. Số nguyên tử đồng và nguyên tử clo có trong A lần lợt là:
A. 1 và 2 B. 2 và 3 C. 2 và 1 D. 3 và 2
Câu 9: CTHH hợp chất của nguyên tố A với O và công thức hoá học hợp chất của nguyên tố B với
H lần lợt là: A
2
O và B
3
PO
4
. CTHH đúng của hợp chất tạo bởi nguyên tố A và B là:
A. AB B. AB
3
C. A
2
B
3
D. A
3
B
Câu 10: Số đơn chất có trong các chất N
2
, CaO, H
2
O, O
3
, NaNO
3
, H
2
S, Br
2
, AlCl
3
, Zn, K
2
CO
3
là:
A. 1 B. 3 C. 4 D. 5
II. Tự luận (5điểm).
Câu 11: Nêu ý nghĩa của các công thức hoá học sau: CuCl
2
Câu 12: Lập công thức hoá học của hợp chất tạo bởi:
a) Mg hoá trị II và nhóm (NO
3
) hoá trị I.
b) Al hoá trị III và nhóm (SO
4
) hoá trị II.
§¸p ¸n biÓu ®iÓm bµi kt sè 1 líp 8– –
§¸p ¸n
BiÎu ®iÓm
C©u1-10 1D – 2B – 3A – 4D– 5C – 6D – 7D – 8A – 9D – 10C 0,5 . 10 = 5®
C©u 11 CTHH cña CuCl
2
cho biÕt:
- Hîp chÊt do 2 nguyªn tè Cu vµ Cl t¹o nªn.
- Trong 1 ph©n tö CuCl
2
cã 1Cu vµ 2Cl.
- PTK = 64 + 2. 35,5 = 135 (®vC)
2®
C©u 12 a)
- Gäi CTHH d¹ng chung: Mg
x
(NO
3
)
y
.
- Theo qui t¾c ho¸ trÞ ta cã: II.x = I.y
2
1
==
II
I
y
x
- CTHH cña hîp chÊt lµ: Mg(NO
3
)
2
0,5 . 3 = 1,5®
b)
- Gäi CTHH d¹ng chung: Al
x
(SO
4
)
y
.
- Theo qui t¾c ho¸ trÞ ta cã: III.x = II.y
3
2
==
III
II
y
x
- CTHH cña hîp chÊt lµ: Al
2
(SO
4
)
3
0,5 . 3 = 1,5®
Bài Kiểm tra 45 số 2 Môn hoá học lớp 8
A/ Ma trận đề
Nội dung kiến
thức
Nhận biết Thông hiểu Vận dụng Tổng
điểm
TN TL TN TL TN TL
Hiện tợng vật
lí hoá học
I.1 0,5đ
Định luật
BTKL
II.7b
1đ
I.2 0,5đ
I.6 0,5đ
II.7c
1đ
Phản ứng hoá
học I.5 0,5đ
II.7a
1đ
II.8 4đ
Phơng trình
hoá học
I.3 0,5đ
I.4 0,5đ
1,5đ 0,5đ 1đ 1đ 6đ 10đ
B/ Đề bài.
I. Trắc nghiệm khách quan (3 điểm).
Câu 1: Cho các hiện tợng sau đây:
a) Nhiệt độ Trái Đất tăng lên làm băng ở hai cực tan ra.
b) Than đốt là xong còn lại là xỉ than.
c) Các quả bóng bay bay trên bầu trời và nổ tung.
d) Một lá đồng bị nung nóng, trên mặt lá đồng có phủ một lớp màu đen.
e) Trứng bị thối.
Hiện tợng hoá học là:
A. a, b, d B. b, d, e C. a, d, e D. a, c, e
Câu 2: : Đốt cháy 32 gam kim loại đồng (Cu) trong khí oxi thu đợc 40 g đồng (II) oxit (CuO).
Khối lợng khí oxi tham gia phản ứng là:
A. 8g B. 72g C. 12g D. Kết quả khác.
Câu 3: Cho sơ đồ phản ứng sau:
Hệ số a, b, c, d thích hợp để có phơng trình hoá học đúng là:
A. 1, 2, 3, 1 B. 1, 2, 4, 5 C. 2, 3, 1, 3 D. 3, 1, 3, 2
Câu 4: Phơng trình hoá học đã cân bằng đúng là:
Câu 5: Trong phản ứng hoá học:
A. Liên kết giữa các phân tử thay đổi, số nguyên tử của các nguyên tố không đổi.
B. Liên kết giữa các nguyên tử thay đổi, số nguyên tử của các nguyên tố không đổi.
C. Liên kết giữa các nguyên tử không đổi, số nguyên tử của các nguyên tố thay đổi.
D. Liên kết giữa các phân tử không đổi, số phân tử của các nguyên tố thay đổi.
Câu 6: Cho 9,6g hỗn hợp hai chất NaOH, KOH tác dụng hoàn toàn với 12,7g FeCl
2
. Sau phản ứng
thu đợc chất rắn và 13,3g hỗn hợp hai chất khác. Khối lợng chất rắn thu đợc là:
A. 9g B. 10,2g C. 16,4g D. Kết quả khác
II. Tự luận (7 điểm).
Câu 7: Có thể thu đợc kim loại sắt (Fe) bằng cách cho khí cacbon oxit (CO) tác dụng với sắt (III)
oxit (Fe
2
O
3
). Ngoài ra còn một sản phẩm nữa là khí cacbon đioxit (CO
2
).
a) Lập PTHH? Cho biết tỉ lệ số phân tử Fe
2
O
3
và số nguyên tử Fe có trong phản ứng?
b) Viết biểu thức của định luật bảo toàn khối lợng đối với phản ứng trên?
c) Khi cho 16,8g CO tác dụng hết với 32g Fe
2
O
3
thì có 26,4 g CO
2
tạo thành. Tính khối lợng Fe
thu đợc sau phản ứng?
Câu 8: Lập phơng trình hoá học của các phản ứng sau đây:
A. KMnO
4
K
2
MnO
4
+ MnO
2
+ 2O
2
t
o
B. 2KMnO
4
K
2
MnO
4
+ 2MnO
2
+ O
2
t
o
C. 2KMnO
4
K
2
MnO
4
+ MnO
2
+ O
2
t
o
D. KMnO
4
K
2
MnO
4
+ MnO
2
+ O
2
t
o
a Al + b CuSO
4
c Al
2
(SO
4
)
3
+ d Cu.
d) C
x
H
y
+ O
2
CO
2
+ H
2
O
t
o
a) HgO Hg + O
2
t
o
b) Al
+ O
2
Al
2
O
3
t
o
c) Fe + H
2
SO
4
Fe
2
(SO
4
)
3
+ H
2
O + SO
2
§¸p ¸n biÓu ®iÓm bµi kt sè 2 líp 8– –
§¸p ¸n
BiÎu ®iÓm
C©u1-6 1B – 2A – 3C – 4C– 5B – 6A 0,5 . 6 = 3,0®
C©u 7 a)
1®
b) mFe
2
O
3
+ mCO = mFe + m CO
2
1®
c) mFe = mFe
2
O
3
+ mCO – mCO
2
= 32 + 16,8 – 26,4 = 22,4 (g)
1®
C©u 8
4®
Fe
2
O
3
+ 3CO 2Fe + 3CO
2
t
o
d) C
x
H
y
+ O
2
x CO
2
+ H
2
O
t
o
a) 2HgO 2Hg + O
2
t
o
b) 4Al
+ 3O
2
2Al
2
O
3
t
o
c) Fe + H
2
SO
4
Fe
2
(SO
4
)
3
+ H
2
O + SO
2
B à i K i ể m t r a 4 5 s ố 3 M ô n h o á h ọ c 8
A/ Ma trận đề
Nội dung kiến
thức
Nhận biết Thông hiểu Vận dụng Tổng
điểm
TN TL TN TL TN TL
1. Các công
thức tính toán
liên quan
I. 1,2
1đ
I5 0,5 đ
I3
0,5đ
I6 0,5
đ
II8bc 2,5
đ
2. Công thức
hóa học PT
hóa học
II7ab1,5
đ
II8a0,75
đ
I4
0,5đ
II7c - 0,75 đ
Định luật
BTKL
II8d1,5đ
Tổng điểm 1,5 đ 2,25 đ 1 đ 1,5 đ 0,5 đ 3,25 đ 10 đ
I. Trắc nghiệm khách quan (4,5 điểm).
Chọn phơng án đúng trong các câu sau đây:
Câu 1: Thể tích ở đktc của 0,75 mol khí hiđro là:
A. 18 lít B. 1,5 lít C. 16,8 lít. D. 9 lít
Câu 2: Số mol Al có trong 4,05 g là:
A. 109,35 B. 0,15 C. 7,6 D. 6,67
Câu 3: Khối lợng của 6.10
23
phân tử khí CO
2
là:
A. 88g B. 22,4 g C. 22 g D. 44 g
Câu 4: Một chất khí A có tỉ khối so với khí hiđro là 22. Công thức hoá học của hợp chất đó là:
A. CO
2
B. CO C. N
2
D. O
2
Câu 5: Thành phần phần trăm của nguyên tố Al có trong hợp chất Al
2
O
3
là:
A. 47,06 % B. 55,08 % C. 52,94 % D. 48,96 %
Câu 6: Một hợp chất tạo bởi hai nguyên tố là lu huỳnh và oxi, trong đó oxi chiếm 60 % về khối l-
ợng. Hợp chất này có tỉ khối với khí hiđro là 40. Công thức hoá học của hợp chất là:
A. SO
2
B. SO
3
C. SO D. S
2
O
3
II. Tự luận (5,5 điểm)
Câu 7: Cân bằng các phơng trình hoá học sau đây:
Câu 8: Hoà tan hết 12 g kim loại Mg vào dung dịch axit clohiđric HCl thu đợc muối magie clorua
MgCl
2
và khí hiđro. Tính thể tích khí hiđro thu đợc ở đktc?
a) Viết PTHH?
b) Tính thể tích khí H
2
thu đợc sau p?
c) Tính khối lợng muối thu đợc sau phản ứng?
d) Dẫn khí H
2
đi qua 40g CuO nung nóng cho p xảy ra vừa đủ. Sau phản ứng thu đợc Kim
loại đồng và 9g H
2
O. Tính khối lợng đồng thu đợc?
(Cho H = 1, C = 12, O = 16, Mg = 24, Al = 27, S = 32, Cl = 35,5)
C
n
H
2n-2
+ O
2
CO
2
+ H
2
O
t
o
t
o
Mg + O
2
MgO
Al + HCl AlCl
3
+ H
2