Download Ma trận đề và đáp án kiểm tra 1 tiết hóa học 8
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (113.35 KB, 3 trang )
<span class='text_page_counter'>(1)</span><div class='page_container' data-page=1>
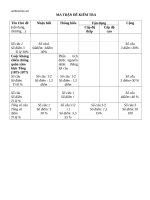
<i><b>Nội dung /mức độ</b></i> <i><b>Biết</b></i> <i><b>Hiểu</b></i> <i><b>Vận dụng</b></i> <i><b>Trọng</b></i>
<i><b>số</b></i>
<i><b>TNKQ</b></i> <i><b>TL</b></i> <i><b>TNKQ</b></i> <i><b>TL</b></i> <i><b>TNKQ</b></i> <i><b>TL</b></i>
<i><b>Hiđro</b></i>
Tính
chất vật
lí, ứng
dụng đ/c
H2
Xác định
các loại
phản ứng
T/c hóa
học của
H2, PƯ
thế
Viết
PTHH
dựa vào
T/c HH,
đ/c H2
<i>Số câu</i>
<i>Điểm</i> <i>0,5đ1</i> <i>1đ1</i> <i>1đ2</i> <i>1đ3</i> <i><b>3,5đ</b><b>7</b></i>
<i><b>Nước</b></i>
T/c hóa
học của
nước
Viết
PTHH
dựa vào
T/c HH
của
nước
Tính
tốn
theo
PTHH
nhận biết
chất dựa
vào tc hh
<i>Số câu</i>
<i>Điểm</i> <i>1đ2</i> <i>0,5đ2</i> <i>0,5đ1</i> <i>1đ1</i> <i><b>3đ</b><b>6</b></i>
<i><b>Axit, bazơ, muối</b></i>
Gọi tên,
phân
loại các
hợp chất
<i>Số câu</i>
<i>Điểm</i>
<i>1</i>
<i>2đ</i>
<i><b>1</b></i>
<i><b>2đ</b></i>
<i><b>BT định lượng tính</b></i>
<i><b>theo PTHH</b></i> điều chế H2t/c hh và
<i>Số câu</i>
<i>Điểm</i> <i>1,5đ2</i> <i><b>1,5đ</b><b>2</b></i>
<i><b>Tổng: Số câu</b></i>
<i><b> Số điểm</b></i>
<i><b> %</b></i>
<i><b>1</b></i>
<i><b>0,5đ</b></i>
<i><b>5%</b></i>
<i><b>1</b></i>
<i><b>1đ</b></i>
<i><b>10%</b></i>
<i><b>4</b></i>
<i><b>2đ</b></i>
<i><b>20%</b></i>
<i><b>6</b></i>
<i><b>3,5đ</b></i>
<i><b>35%</b></i>
<i><b>1</b></i>
<i><b>0,5đ</b></i>
<i><b>5%</b></i>
<i><b>3</b></i>
<i><b>2,5đ</b></i>
<i><b>25%</b></i>
<i><b>14</b></i>
<i><b>10đ</b></i>
<i><b>100%</b></i>
<b>ĐỀ BÀI:</b>
<b>I. Trắc nghiệm :</b><i><b>(3 điểm)</b></i>
<i><b>Câu 1:</b></i> Nhóm các chất đều phản ứng được với <i><b>Nước </b></i>là :
<b>A.</b> CaO, H2 <b>B.</b> CuO; O2 <b>C.</b> Na2O , P <b>D.</b> P2O5 ; CaO
<i><b>Câu 2:</b></i> Khí Hidro được bơm vào khinh khí cầu, bóng thám khơng vì Hidro là khí
<b>A.</b> khơng màu. <b>B.</b> khí nhẹ nhất trong các loại khí.
<b>C.</b> có tác dụng với Oxi trong khơng khí. <b>D.</b> ít tan trong nước.
<i><b>Câu 3:</b></i> Cho chất X vào H2O được dung dịch làm đổi màu q tím thành xanh: Chất X là:
<b>A.</b> Mg <b>B.</b> P2 O5 <b>C.</b> BaO <b>D.</b> Fe2O3
<i><b>Câu 4:</b></i> Đốt khí Hiđro trong khơng khí sẽ có
<b>A.</b> khói trắng <b>B.</b> ngọn lửa màu đỏ
<b>C.</b> ngọn lửa màu xanh nhạt <b>D.</b> khói đen và hơi nước tạo thành
<i><b>Câu 5:</b></i> Phản ứng giữa khí H2 với khí O2 gây nổ khi
</div>
<span class='text_page_counter'>(2)</span><div class='page_container' data-page=2>
Oxi là 4 : 1
<b>C.</b> tỉ lệ về số mol Hiđro và Oxi là 1 : 2 <b>D.</b> tỉ lệ về thể tích Hiđro và Oxi là 2 : 1
<i><b>Câu 6:</b></i> Khối lượng nước thu được khi đốt 112 lít khí H2 (đktc) trong khí O2 dư là
<b>A.</b> 90gam <b>B.</b> 70 gam <b>C.</b> 100gam <b>D.</b> 80 gam
<b>Tự luận :</b><i><b>(7 điểm)</b></i>
<b>Câu 1(2đ):</b> Hãy phân loại và gọi tên các chất có cơng thức hố học sau: K2O, HBr,
CaCO3, Fe(OH)3, H2SO4, Ba(OH)2, CO2, Mg(HCO3)2.
<b>Câu 2(2,5đ):</b> Lập PTHH hoàn thành chuyển đổi sau(ghi rõ điều kiện phản ứng nếu có)
Hãy cho biết mỗi phản ứng thuộc loại nào?
H3PO4
Fe3O4 Fe H2 H2O
KOH
<b>Câu 3(1đ):</b> Bằng phương pháp hóa học, hãy nhận biết các chất bột đựng trong các lọ bị
mất nhãn sau: MgO; K2O; CaO; P2O5.
<b>Câu 4(1,5đ)</b>Cho 19,5 gam Kẽm vào bình chứa dung dịch axit clohidric.
a. Viết phương trình hóa học của phản ứng.
b. Tính khối lượng axit clohiđric cần dùng
c. Nếu dùng tồn bộ lượng chất khí vừa sinh ra ở phản ứng trên để khử 48gam
sắt(III)oxit thu được m gam chất rắn. Tính khối lượng m?
(Cho Zn = 65 ; H = 1 ; Cl = 35,5 ; Fe = 56 ; O= 16)
<b>ĐÁP ÁN </b>
<b>Câu</b> <b>Nội dung</b> <b>Điểm</b>
Trắc
nghiệm:
(3 điểm)
<b> </b>Câu 1 : D
Câu 2 : B
Câu 3 : C
Câu 4: C
Câu 5: D
Câu 6: A
0,5đ/câu
đúng
Tự luận:
(7 điểm)
<i><b>Câu 1 (2đ)</b></i>
Oxit bazơ: K2O: Kali oxit
Oxit axit: CO2: Cacbonđioxit
Axit khơng có oxi: HBr: Axit bromhiđric
Axit có oxi: H2SO4: Axit sunfuric
Bazơ tan trong nước: Ba(OH)2: Bari hiđroxit
Bazơ không tan trong nước: Fe(OH)3: Sắt (III) hiđroxit
</div>
<span class='text_page_counter'>(3)</span><div class='page_container' data-page=3>
Muối trung hoà: CaCO3: Canxi cacbonat
Muối axit: Mg(HCO3)2: Magie hiđrocacbonat
<i><b>Câu 2 (2,5đ)</b></i>
PTHH:
Fe3O4 + 4H2 →
t0
3Fe + 4H2O (p/ư thế)
Fe + 2HCl → FeCl2 + H2 (p/ư thế)
H2 + O2 →
t0
H2O (p/ư hóa hợp)
3H2O + P2O5 → 2H3PO4 (p/ư hóa hợp)
2H2O + 2K → 2KOH + H2 (p/ư thế)
0,25đ/pư
đúng
<i><b>Câu 3 (1đ)</b></i>
Cho các mẩu thử vào nước sau đó nhúng quỳ tím vào các
dd thu được;
MgO: khơng tan
K2O: tan tạo dd trong suốt làm quỳ tím chuyển xanh
CaO: Tan, tạo dd đục làm quỳ tím chuyển xanh
P2O5: Tan, tạo dd làm quỳ tím chuyển đỏ
0,25đ/chấ
t nhận
biết được
<i><b>Câu 4 (1,5đ)</b></i>
a. Zn + 2HCl <sub> ZnCl</sub><sub>2</sub><sub> + H</sub><sub>2</sub><sub> </sub>
0,3mol 0,6mol 0,3mol
0,25đ
19,5
0,3( )
65
<i>Zn</i>
<i>n</i> <i>mol</i>
0,25đ
2 0,6( )
<i>HCl</i> <i>Zn</i>
<i>n</i> <i>n</i> <i>mol</i> <sub> </sub>
36,5 0,6 21,9( )
<i>HCl</i>
<i>m</i> <i>gam</i> 0,25đ
c. Fe2O3 + 3H2
<i>o</i>
<i>t</i>
<sub> 2Fe + 3H</sub><sub>2</sub><sub>O </sub>
0,1mol 0,3mol 0,2mol 0,25đ
2 3
48
0,3( )
160
<i>Fe O</i>
<i>n</i> <i>mol</i>
2 0,3( )
<i>H</i>
<i>n</i> <i>mol</i>
0,25đ
Ta có tỉ lệ:
0,3 0,3
1 3 <sub>; Fe</sub><sub>2</sub><sub>O</sub><sub>3 </sub><sub>dư ; m gồm Fe</sub><sub>2</sub><sub>O</sub><sub>3</sub><sub> dư và Fe </sub>
(0,3 0,1) 160 0, 2 56 43, 2( )
<i>m</i> <i>gam</i>
</div>
<!--links-->