Bài 17. Phản ứng oxi hoá - khử
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (131.77 KB, 6 trang )
<span class='text_page_counter'>(1)</span><div class='page_container' data-page=1>
Ngày soạn: 20/8/2017
Ngày dạy:
Người soạn: Đồng Thị Hương
<i><b>Chương 4: Phản ứng oxi hóa –khử</b></i>
<i><b>Bài 17: </b></i><b>Phản ứng oxi hóa – khử ( Tiết 2)</b>
<b>I,Về mục tiêu</b>
<i>1, Kiến thức</i>
Hiểu được:
- Các bước lập phương trình phản ứng oxi hố - khử,
- Ý nghĩa của phản ứng oxi hoá - khử trong thực tiễn
Vận dụng được :
+ lập được PTHH của phản ứng oxi hóa khử dựa vào số oxi hóa ( cân bằng theo phương pháp
thăng bằng electron)
+ nhận biết được các quá trình oxi hóa- khử trong thực tiễn có thể gặp.
<i>2, Kĩ năng</i>
- Lập PTHH của 1 số phản ứng oxi hóa- khử đơn giản
- Rèn luyện kĩ năng xác định số oxi hóa của nguyên tố và cân băng phương trình theo phương pháp
thăng bằng e.
<i>3, Thái độ</i>
- Nhận thức rõ tầm quan trọng của việc nắm vững kiến thức về phản ứng oxi hoá -khử đối với sản
xuất hố học và bảo vệ mơi trường
- Có thái độ học tập tích cực và u thích bộ mơn hố học
<i>4, Phát triển năng lực</i>
- NL sử dụng ngơn ngữ hóa học
- NL tư duy hóa học
- NL tính tốn
- NL tự học
- NL vận dụng kiến thức hóa học vào thực tiễn
</div>
<span class='text_page_counter'>(2)</span><div class='page_container' data-page=2>
<i>1, Giáo viên </i>
- Chuẩn bị giáo án đầy đủ
- Phiếu học tập
<i>2, Học sinh</i>
- Xem lại các kiến thức về phản ứng Oxi hóa khử đã được học ở THCS
- Đọc trước bài mới
<b>III, Phương pháp dạy học</b>
- Phương pháp thuyết trình
- Phương pháp vấn đáp tìm tịi
- Phương pháp trực quan
<b>IV, Tiến trình dạy học</b>
1, Ổn định lớp
<i> 2, Kiểm tra bài cũ </i>
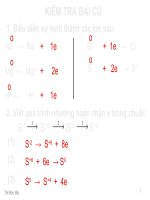
Câu hỏi : <b>HS1</b>:Trong hợp chất nào, nguyên tố S không thể hiện tính oxi hóa ?
A, Na2S
B, <b>Na2CO3</b>
C, SO2
D,H2SO4
<b>HS2 :</b> Trong phản ứng Zn + CuSO4 Cu + ZnSO4
1 mol Cu2+ đã :
A, Nhường 1 mol e
B, Nhường 2 mol e
C, Nhận 1 mol e
D, Nhận 2 mol e
3, Vào bài mới
</div>
<span class='text_page_counter'>(3)</span><div class='page_container' data-page=3>
Hoạt động của giáo viên Hoạt động của học sinh Nội dung
<i><b>Hoạt động 1: Lập phương trình hóa học của phản ứng oxi hóa khử</b></i>
Gv: Nêu nội dung phương pháp
thăng bằng electron
Gv: Nêu các bước lập phương
trình hóa học
Sau đây, chúng ta cùng nhau lập
phương trình hóa học của phản
ứng oxi hóa theo nội dung và các
bước nêu trên :
VD:
P + O2 -> P2O5
Bước 1: Xác định số oxi hóa các
chất => Chất khử và chất oxi hóa?
Cung cấp cho học sinh “ bí quyết 1
“
-Nếu oxi, hidro, kim loại trong
<i>phản ứng khơng thay đổi dạng kết </i>
<i>hợp thì số OXH không thay đổi </i>
<i>nên ta không xét</i>
<i>-Số OXH của kim loại nhóm A khi </i>
<i>tham gia phản ứng bằng đúng số </i>
<i>thứ tự của nhóm</i>
+Bước 2: Viết q trình oxi hóa
khử và cân bằng?
+ Bước 3: Hãy xác định hệ số của
chất oxi hóa và chất khử, tìm bội
số chung nhỏ nhất?
Các hệ số thỏa mãn: tổng số e cho
bằng tổng số e nhận, hệ số của quá
trình khử là số e nhường, hệ số của
quá trình oxi hóa là số e nhận.
Cung cấp cho học sinh “ bí quyết
2”
<i>Hệ số của q trình khử là thương</i>
<i>của BCNN chia cho số e nhường</i>
<i>Hệ số của q trình oxi hóa là </i>
<i>thương của BCNN chia cho số e </i>
<i>thu</i>
+Bước 4: Điền hệ số vào phương
trình và kiểm tra .
. Kiểm tra cân bằng số nguyên tử
của các nguyên tố và cân bằng
điện tích 2 vế để hoàn thành việc
lập PTHH
GV: muốn nhanh và chính xác, các
bạn nên tiến hành theo qui trình
sau:
Cung cấp cho học sinh “bí quyết
Học sinh ghi bài
Học sinh trả lời:
Bước 1:
Po<sub> + O2</sub>0<sub> -> P2</sub>+5<sub>O2</sub>
Chất khử :P
Chất oxi hóa:O2
Bước 2:
P0<sub> -> P</sub>+5<sub> + 5e</sub>
O20<sub> + 4e -> 2O</sub>-2
Bước 3:
4x P0<sub> -> P</sub>+5<sub> + 5e</sub>
5x O20<sub> + 4e -> 2O</sub>-2
Bước 4:
4P +5O2 ->2 P2O5
<i><b>II, Lập phương trình hóa học </b></i>
<i><b>của phản ứng oxi hóa khử</b></i>
=
Lập phương trình hóa học bao
gồm 4 bước sau :
Bước 1: Xác định số oxi hóa của
các nguyên tố trong phản ứng để
tìm chất oxi hóa và chất khử.
Bước 2: Viết q trình oxi hóa và
q trình khử , cân bằng mõi q
trình.
Bước 3: Tìm hệ số thích hợp cho
chất oxi hóa và chất khử sao cho
tổng e nhường = tổng e nhận
Bước 4: Đặt hệ số vừa tìm vào
phản ứng, từ đó hồn thành và
kiểm tra lại các số nguyên tử.
4P +5O2 ->2 P2O5
Bước 1:
</div>
<span class='text_page_counter'>(4)</span><div class='page_container' data-page=4>
3”
Chất nào phản ứng chỉ biến đổi
một dạng kết hợp thì cân bằng
trước, nhiều dạng thì cân bằng sau.
- Khi cân bằng chất nào trước thì
điền hệ của sơ đồ vào vế trái của
phản ứng rồi cân bằng nguyên tử ở
vế phải.
- Còn khi cân bằng chất nào sau
thì lại đưa hệ số của sơ đồ vào vế
phải của phương trình trước rồi
cân bằng các nguyên tử vế trái
Câu hỏi: Cho phản ứng sau , 2 học
sinh lên bảng lập PTHH theo các
bước như trên:
NH3+ Cl2 -> N2 + HCl
Fe2O3 + CO-> Fe + CO2
Học sinh lên bảng trình bày
NH3+ Cl2 -> N2 + HCl
Bước 1:
N-3<sub>H3 + Cl2</sub>0<sub> -> N2</sub>0<sub> + HCl</sub>-1
Bước 2:
2N-3<sub> -> N2</sub>0<sub> + 6e</sub>
Cl20 <sub> + 2e -> 2Cl</sub>-1
Bước 3:
1x 2N-3<sub> -> N2</sub>0<sub> + 6e</sub>
3x Cl20 <sub> + 2e -> 2Cl</sub>-1
Bước 4:
2 NH3 + 3 Cl2 -> N2 + 6HCl
Fe2O3 + CO-> Fe + CO2
Bước 1 :
Fe+3<sub>2O3 + C</sub>+2<sub>O-> Fe</sub>0<sub> + C</sub>+4<sub>O2</sub>
Bước 2:
C2+<sub> → C</sub>+4<sub> + 2e ( QT oxi hoá)</sub>
Fe3+ <sub> + 3e → Fe</sub>0 <sub>( QT khử)</sub>
Bước 3:
3 x C+2<sub> → C</sub>+4<sub> + 2e</sub>
2 x Fe3+ <sub> + 3e → Fe</sub>0
Bước 4 :
Fe2O3 + 3CO-> 2Fe + 3CO2
Bước 2:
2N-3<sub> -> N2</sub>0<sub> + 6e</sub>
Cl20 <sub> + 2e -> 2Cl</sub>-1
Bước 3:
1x 2N-3<sub> -> N2</sub>0<sub> + 6e</sub>
3x Cl20 <sub> + 2e -> 2Cl</sub>-1
Bước 4:
2 NH3 + 3 Cl2 -> N2 + 6HCl
Fe2O3 + 3CO-> 2Fe + 3CO2
</div>
<span class='text_page_counter'>(5)</span><div class='page_container' data-page=5>
GV: phản ứng oxi hóa- khử là loại
phản ứng hóa học phổ biến và có
tầm quan trọng trong đời sống và
trong sản xuất.
u cầu hS lấy ví dụ ( có gợi ý)
Học sinh trả lời
Là phản ứng quan trọng trong đời
sống và sản xuất
Là một trong những phản ứng
quan trọng nhất của thiên nhiên
trong sự hô hấp, sự cháy ....
HS:
+quá trình đốt than củi: C +O2 →
CO2
+ quá trình sắt gỉ:
4Fe + 3O2 + 2nH2O →
2Fe2O3.nH2O
GV: nhận xét và bổ sung:
+ sản xuất HCl: H2+ Cl2→ 2HCl
+sản xuất NH3: H2+ 3N2→ 2NH3
+ sản xuất gang thép:
FeS2 + O2 → FeS + SO2
4FeS + 7 O2 → 2Fe2O3 + 4SO2
Khử chua ở những vùng quặng
pirit sắt: FeS2. Đất bị chua là do:
4FeS2+ 15O2+ 2H2O →
2Fe2(SO4)3
Để khử chua: bón vơi
Ca(OH)2+ H2SO4→ CaSO4 + H2O
III , Ý nghĩa của phản ứng oxi
hóa khử
+, Phản ứng oxi hóa khử có ý
nghĩa vơ cùng quan trọng : năng
lượng ta dùng là năng lượng của
phản ứng oxi hóa khử
+, Là cơ sở của các q trình sản
xuất nhôm, gang, luyện kim....
phục vụ con ngừoi và sản xuất
+ Giúp bảo vệ môi trường và loại
bỏ khí thải CO2 , SO2 .. bằng
cách dẫn qua bể nước vôi.
CO2 + Ca(OH)2 -> CaCO3
+H2O
+ Làm giảm độ chua của đất
<i>4, Củng cố và dặn dò</i>
<i>a, Củng cố:</i>
Giáo viên phát các phiếu học tập cho học sinh , yêu cầu học sinh cân bằng và nhận xét chéo với bạn bên
cạnh mình :
1, MnO2 + HCl -> MnCl2 + Cl2 + H2O
2,Cu + HNO3 -> Cu(NO3)2 + NO + H2O
3,Fe3O4 + HNO3 -> Fe(NO3)3 + NO + H2O
4, KMnO4 + HCl → MnCl2 + 2KCl + 5Cl2 + H2O
<i>b, Dặn dị</i>
+ Học sinh ơn lại bài cũ
</div>
<span class='text_page_counter'>(6)</span><div class='page_container' data-page=6>
<b>IV, Rút kinh nghiệm </b>
</div>
<!--links-->