- Trang chủ >>
- Y - Dược >>
- Y học cổ truyền
Bài giảng Hóa học hữu cơ 1 - ĐH Phạm Văn Đồng
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (2.78 MB, 20 trang )
<span class='text_page_counter'>(1)</span><div class='page_container' data-page=1>
<b>Y BAN NHÂN DÂN T NH QU NG NGẩI</b>
<b>TR</b> <b>NG Đ I H C PH M VĂN Đ NG</b>
<b>---00--- </b>
<b>V</b> <b>NG C M H</b> <b>NG</b>
<b>BẨI GI NG</b>
<b>HịA H C</b>
<b>H U C</b>
<b> 1 </b>
</div>
<span class='text_page_counter'>(2)</span><div class='page_container' data-page=2>
<b>L I M Đ U </b>
<i>Bài giảng Hóa học</i> <i>hữu cơ</i> <i>1 được biên soạn theo chương trình chi tiết </i>
<i>Hóa học</i> <i>hữu cơ</i> <i>1 của ngành sư phạm, bậc cao đẳng (gọi tắt là CĐSP); </i>
<i>chương trình chi tiết của mơn học nàyđã được Bộ mơn Hóa học thuộc khoa </i>
<i>Cơ bản Trường Đại học Phạm Văn Đồng phát hành. Nội dung cô đọng của </i>
<i>bài giảng được chọn lọc từ nhiều giáo trình, tài liệu tham khảo và phù hợp </i>
<i>với đối tượng sinh viên CĐSP.</i>
<i>Để tạo điều kiện cho sinh viên CĐSP tăng cường việc tự học, tự </i>
<i>nghiên cứu, trong mỗi chương của bài giảng có những bài tập và câu hỏi ôn </i>
<i>tập. Tuy nhiên, ở mức độ là một bài giảng với những nội dung chính nên </i>
<i>khơng thể có đủ các phần đọc thêm, mở rộng kiến thức. Vì vậy, khi nghiên </i>
<i>cứu, tự học</i> <i>sinh viên nên kết hợp với các giáo trình khác để mở rộng kiến </i>
<i>thức.</i>
<i>Bài giảng dung cho sinh viên các ngành Hóa, Hóa - Sinh, Hóa - Lí, </i>
<i>Hóa - Địa các trường CĐSP</i> <i>đồng thời cũng là tài liệu tham khảo cho giáo </i>
<i>viên Hóa học các trường THCS.</i>
<i>Rất mong được sự góp ý của đồng nghiệp để bài giảng được hoàn </i>
<i>thiện hơnnhằm phục vụhữu hiệu việc học tập, nghiên cứu của sinh viên. </i>
<i>Xin chân thành cảm ơn Lãnh đạoTrường, Khoa, Bộ mơn</i> <i>Hóa học đã </i>
<i>tạo điều kiện bài giảng này được lên website của trường.</i>
</div>
<span class='text_page_counter'>(3)</span><div class='page_container' data-page=3>
<b>Ch ng 1. Đ I C</b> <b>NG</b>
<b>1.1. H p ch t h u c vƠ hóa h c h u c</b>
<b>1.1.1. Đ nh nghĩavƠ đ i t ng nghiên c u c a hóa h c h u c</b>
Trong số gần 110 ngun tố hóa học đã có tên chính th c trong b ng tuần hoàn, cacbon
là một nguyên tố rất đặc biệt chỗ: các nguyên tử cacbon có thể kết hợp với nhau và với
nguyên tử c a các nguyên tố khác t o nên kho ng hơn hai mươi triệu hợp chất khác nhau,
đấy là những hợp chất c a cacbon. Trongkhi đó, tất c ngun tố cịn l i chỉ có thể t o nên
được hơn một triệu hợp chất không ch a cacbon.
Các hợp chất c a cacbon được gọi là hợp chất hữu cơ, trừ một số ít hợp chất đơn gi n
như các oxit c a cacbon, các muối cacbonat và cacbua kim lo i.
Ngành hóa học chuyên nghiên c u các hợp chất hữu cơ, t c là các hợp chất c a
cacbon, được gọi là Hóa học hữu cơ.
Vì các hợp chất hữu cơ gồm hai lo i chính là hiđrocacbon và các dẫn xuất c a chúng,
nên cũng có thể coi Hóa học hữu cơ là ngành hóa học chuyên nghiên c u hiđrocacbon và
các dẫn xuất c a hiđrocacbon.
Vậy đối tượng nghiên c u c a Hóa học hữu cơ là các hợp chất c a cacbon, bao gồm
hiđrocacbon và các dẫn xuất c a chúng.
<b>1.1.2. Đặc điểm chung c a các h p ch t h u c</b>
1.1.2.1. Cấu t o
- Ch a C, ngồi ra cịn H, O, N, halogen, S, P và các nguyên tố khác.
- Liên kết: thư ng là liên kết cộng hố trị, ít có liên kết ion.
- Nguyên tử C liên kết với nhau và liên kết với các nguyên tố khác nên t o thành m ch
h hoặc m ch vòng.
1.1.2.2. Tính chất vật lý
- Dễ nóng ch y và dễ bay hơi.
- Thư ng không tan hoặc tan rất ít trong nước nhưng dễ tan trong các dung môi hữu cơ.
1.1.2.3. Tính chất hố học
- Kém bền nhiệt nên dễ bị phân huỷ b i nhiệt, đa số cháy khi bị đốt.
- Ph n ng: thư ng diễn ra chậm, không hồn tồn, và khơng theo một hướng nhất
</div>
<span class='text_page_counter'>(4)</span><div class='page_container' data-page=4>
<b>1.1.3. Phơn lo i các h p ch t h u c</b>
1.1.3.1. Phân lo i theo nhóm ch c
Các hợp chất hữu cơ có thể được phân chia thành hai lo i chính là hiđrocacbon (phân
tử chỉ cấu thành chỉ b i hai nguyên tố C và H) và các dẫn xuất c a hiđrocacbon (một hay
nhiều nguyên tử H trong phân tử hiđrocacbon được thay thế bằng một hay nhiều nguyên tử
hoặc nhóm nguyên tử khác).
Các dẫn xuất c a hiđrocacbon là những hợp chất có nhóm đặc trưng hay nhóm ch c;
hiđrocacbon cũng có thể có nhóm ch c. Nhóm ch c là nhóm nguyên tử hoặc nguyên tử
quyết định đặc tính hóa học c a phân tử hữu cơ. Sau đây là một số nhóm ch c chính:
- Nằm trong m ch C: anken (C = C); ankin (C ≡ C)
- Ch a oxi: ancol (-OH); ete (C-O-C); andehit (-CH = O); axit (- COOH)
- Ch a nitơ: amin (-NH2) ; nitrin (-C ≡ N)
- Ch a c oxi và nitơ: amit (-CO-NH2); nitro (-NO2)
- Ch a lưu huỳnh: thiol (-SH); thioete (-S-)
- Ch a nguyên tử halogen: dẫn xuất clo (-Cl); dẫn xuất brom (-Br)
1.1.3.2. Phân lo i theo m ch cacbon
Hợp chất hữu cơ
Hợp chất khơng vịng Hợp chất vịng
HC no HC khơng no HC đồng vịng HC dị vịng
khơng thơm thơm thơm Không
thơm
</div>
<span class='text_page_counter'>(5)</span><div class='page_container' data-page=5>
<b>1.2. C u t o phơn t h p ch t h u c</b>
<b>1.2.1. ThƠnh ph n nguyên t vƠ công th c phơn t</b>
Thành phần nguyên tố c a hợp chất hữu cơ được biểu thị bằng các công th c sau:
- Cơng th c tổng qt<i>:</i>Cho biết thành phần định tính các nguyên tố.
Ví dụ: CxHyOzNt (x, y, z, t là những số nguyên dương) cho biết phân tử có 4 nguyên
tố: C, H, O và N
- Công th c đơn gi n: Cho biết tỉ lệ số lượng các nguyên tố trong phân tử.
Ví dụ: CH2O cho biết tỉ lệ các nguyên tử C : H : O là 1 : 2 : 1
- Công th c phân tử: Cho biết rõ số lượng nguyên tử c a mỗi nguyên tố trong phân tử.
Ví dụ: C2H6: etan
Để xác định thành phần nguyên tố dùng phương pháp phân tích định tính và định
lượng
1.2.1.1. Phân tích định tính các nguyên tố
Xác định các lo i nguyên tố có trong hợp chất hữu cơ dựa trên nguyên tắc chuyển các
nguyên tố cần xác định thành chất vô cơ đơn gi n rồi nhận ra các chất vô cơ này bằng ph n
ng đặc trưng
a. Phân tích C và H
Nung hợp chất hữu cơ với CuO(chất oxi hoá) để chuyển C thành CO2 và H thành H2O
rồi nhận ra CO2 bằng nước vơi trong (khi đó sinh ra kết t a trắng CaCO3) và nhận ra H2O
bằng CuSO4khan (bột CuSO4màu trắng chuyển thành CuSO4.5H2O màu xanh):
[C] + 2CuO → CO2 + 2Cu
hợp chất hữu cơ (h.c.h.c)
[2H] + CuO → H2O + Cu
h.c.h.c
CO2 + Ca(OH)2 → CaCO3 + H2O
5H2O + CuSO4 → CuSO4.5H2O
b. Phân tích N
Nung hợp chất hữu cơ với Na sinh ra NaCN. Để nhận ra ion CN- (ch a nitơ) ta thêm
Fe2+ và Fe3+ rồi axit hoá nhẹ, ion CN- sẽ cho kết t a màu xanh đậm đặc trưng (gọi là xanh
</div>
<span class='text_page_counter'>(6)</span><div class='page_container' data-page=6>
Na + [C] + [N] → NaCN
h.c.h.c
Fe2+ + 6CN(-) → [Fe(CN)6]4-
4Fe3+ + 3[Fe(CN)6]4- → Fe4[Fe(CN)6]
c. Phân tích halogen
Đốt cháy một băng giấy lọc đầu có tẩm ancol etylic (dùng làm nhiên liệu) và một ít
chất hữu cơ ch a halogen (X) sẽ sinh ra hiđro halogenua, s n phẩm này được nhận ra nh
dung dịch AgNO3(t o kết t a AgX tan được trong amoniac):
[X] + [H] → HX
h.c.h.c h.c.h.c hoặc ancol
HX + AgNO3 → AgX + HNO3
AgX + 3NH3 + H2O → [Ag(NH3)2]OH + NH4X
(tan)
d. Phân tích lưu huỳnh
Nung hợp chất hữu cơ với Na sẽ sinh ra Na2S; s n phẩm này được nhận ra b i Pb2+
(t o kết t a đen):
[S] + 2Na → Na2S
h.c.h.c
Pb2+ + S2- → PbS
1.2.1.2. Phân tích định lượng các nguyên tố
Phân tích định lượng nhằm xác định thành phần phần trăm về mặt khối lượng c a các
nguyên tố trong phân tử hợp chất hữu cơ. Nguyên tắc chung là chuyển hoàn toàn các nguyên
tố trong một lượng cân nhất định c a chất hữu cơ thành các chất vô cơ đơn gi n, sau đó xác
định khối lượng (hoặc thể tích khí) c a các s n phẩm đó rồi tính thành % các nguyên tố.
a. Phân tích C và H
Nung nóng một lượng cân chính xác<i> a</i> (mg) hợp chất hữu cơ với bột CuO (lấy dư)
trong dịng khí oxi. Khí CO2 và hơi nước sinh ra được hấp thụ hoàn toàn và riêng rẽ b i bình
ch a các chất hấp thụ thích hợp được cân trước và sau thí nghiệm. Ví dụ dùng Mg(ClO4)2 để
hấp thụ nước, dùng amiăng tẩm NaOH để hấp thụ CO2.
</div>
<span class='text_page_counter'>(7)</span><div class='page_container' data-page=7>
b. Phân tích N
Nung nóng 1 lượng cân chính xác<i> a</i> (mg) hợp chất hữu cơ với bột CuO (lấy dư) trong
dịng khí CO2 để chuyển hết nitơ trong hợp chất hữu cơ thành khí nitơ. Dẫn khí sinh ra vào
dụng cụ đo khí gọi là “nitơ kế” có ch a dung dịch KOH đậm đặc để hấp thụ hết CO2 và
H2O. Gi sử thu được V (ml) khí nitơ, đo nhiệt độ <i>t</i>, áp suất khí quyển là <i>p</i>, áp suất hơi
nước là <i>f</i>, ta tính được:
Việc xác định N, C, H hiện nay đã được tự động hoá bằng cách dẫn khí t o thành vào
máy sắc kí khí, máy cho biết ngay hàm lượng N, C, H
c. Phân tích halogen
Nung nóng chất hữu cơ với axit nitric bốc khói có mặt AgX, đem phân tích bằng
phương pháp cân.
d. Phân tích lưu huỳnh
Nung nóng chất hữu cơ với axit nitric bốc khói, lưu huỳnh trong phân tử hữu cơ được
chuyển thành SO4
2-<sub>t o ra kết t a BaSO</sub>
4 được phân tích bằng cách cân.
e. Phân tích oxi
Thơng thư ng hàm lượng oxi trong hợp chất hữu cơ đợc xác định gián tiếp bằng cách
lấy 100% trừ cho tổng số % c a các nguyên tố khác trong hợp chất. Tuy vậy, khi cần thiết
cũng có thể xác định trực tiếp bằng cách chuyển oxi trong hợp chất hữu cơ thành CO rồi
định lượngCO dựa theo ph n ng:
5CO + I2O5 → 5CO2 + I2
1.2.1.3. Thiết lập công th c phân tử (CTPT)
2 2
2 2
CO CO
C
H O H O
H
12m
12m
.100
m
%C
44
44a
2m'
2m'
.100
m
%H
18
18a
2
2
N
N
28 p f 1
m .V. .
t
22.400 <sub>760 1</sub>
273
m .100
%N
</div>
<span class='text_page_counter'>(8)</span><div class='page_container' data-page=8>
Sau khi phân tích nguyên tố và xác định phân tử khối ta có cơng th c phân tử dựa vào
1 trong 3 phương pháp phổ biến sau:
a. Lậpcông th c đơn gi n nhất (công th c ngun) từ đó lập CTPT
Phân tích định lượng: mH, mC, mO, mN, ...Chia các đ i lượng này cho các khối lượng
mol nguyên tử tương ng, rồi chia cho ước số chung lớn nhất ta thu được tỉ lệ về số lượng
nguyên tử c a các nguntố trong phân tử. Từ đó lập cơng th c đơn gi n nhất.
Ví dụ: Đốt hồn toàn 0,09g X cho 0,13g CO2 và 0,054g H2O. Tỉ khối hơi c a X so với
hidro là 30. Hãy thiết lập CTPT c a X?
Công th c đơn gi n nhất: CH2O
PTK : MX = 2.30 = 60
Hay (12.1+1.2+16.1)n = 60 → n = 2
Vậy CTPT c a X là (CH2O)2 hay C2H4O2
b. Dựa vào khối lượng các s n phẩm đốt cháy và Mx mà không qua công th c đơn gi n nhất
Đặt CT c a hợp chất X là CxHyOz
Theo sơ đồ
z được tính từ x, y và Mxdựa theo CxHyOz
Theo ví dụ trên: ta tính được x = 2, y = 4, z = 2.
c. Dựa vào thành phần % các nguyên tố và Mx
Thành phần % các nguyên tố tỉ lệ với khối lượng mỗi nguyên tố trong phân tử:
C
H
O
12.0,13
m 0,036(g)
44
2.0,054
m 0,006(g)
18
m 0,09 (0,036 0,006) 0,048(g)
0,036 0,006 0,048
C: H : O : : 1: 2:1
12 1 16
2 2
2 2
x y Z 2 2
X
CO H O
X CO X H O
y
C H O xCO H O
2
y
18 <sub>M</sub>
44x <sub>2</sub>
m m a
M .m M .m
x ,y
</div>
<span class='text_page_counter'>(9)</span><div class='page_container' data-page=9>
<b>1.2.2. Công th c c u t o, thuyết c u t ohóa h c</b>
1.2.2.1. Cơng th c cấu t o
Nếu như CTPT chỉ cho biết số lượng ngun tử trong phân tử thì CTCT cịn cho biết
trật tự kết hợp và cách liên kết giữa các nguyên tử trong phân tử, t c thể hiện cấu t o hóa
học c a phân tử hữu cơ
Khi biểu diễn CTCT cần tuân theo 1 số qui định:
- Mỗi liên kết đơn được biểu thị bằng 1 v ch nối, nguyên tố có bao nhiêu hóa trị được
biểu thị bằng bấy nhiêu v ch xung quanh kí hiệu đó.
- H có hóa trị 1, có 1 v ch: -H.
- O có hóa trị 2, có 2 v ch: =O hoặc -O-
- CTCT:
Tuy nhiên để cho gọn trong CTCT ngư i ta có thể bỏ qua khơng biểu diễn v ch liên
kết.
Ví dụ: CH3CH2OH hoặc CH2=CH-CH=CH2
Trong nhiều cơng th c d ng vịng có thể khơng ghi kí hiệu nguyên tử cacbon, hoặc
nhóm metylen (-CH2-), metin (-C), mà hiểu ngầm sự có mặt c a các nhóm đó qua các
v ch hóa trị c a chúng đỉnh đa giác.
Ví dụ:
Để thiết lập CTCT c a 1 hợp chất hữu , ngư i ta áp dụng các phương pháp thực
nghiệm (phương pháp hóa học và phương pháp vật lí) kết hợp với thuyết cấu t o hóa học.
1.2.2.2. Thuyết cấu t o hóa học
X
X X X
M
12x
1y
16z 12x y 16z
%C %H %O
100
100
M .%C
M .%H
M .%O
x
;y
;z
</div>
<span class='text_page_counter'>(10)</span><div class='page_container' data-page=10>
Ngày 11/9/1861 t i hội nghị hóa học Speyer (Đ c) Butlerop đã đọc b n báo cáo khoa
học về cấu t o hóa học c a các chất. Nội dung chính gồm những luận điểm sau:
- Các nguyên tử trong hợp chất hữu cơ kết hợp với nhau theo 1 trật tự xác định và theo
đúng hoá trị c a chúng; sự thay đổi trật đó sẽ có chất mới.
- C trong phân tử hợp chất hữu cơ ln ln có hố trị 4. Các nguyên tử C không
những liên kết với các nguyên tố khác mà còn liên kết với nhau để t o m ch C có d ng khác
nhau (m ch khơng nhánh, m ch có nhánh, m ch vịng..).
- Tính chất c a hợp chất hữu cơ phụ thuộc vào thành phần phân tử (b n chất và số
lượng các nguyên tử ) và cấu tao hoá học (th tự kết hợp các nguyên tử). Các nguyên tử
trong phân tử có nh hư ng lẫn nhau (thư ng các nguyên tử liên kết trực tiếp với nhau m nh
hơn gián tiếp).
<b>1.2.3. Khái ni m về đ ng đẳng vƠ đ ng phơn c u t o</b>
1.2.3.1. Đồng đẳng
Là hiện tượng các chất hữu cơ có cấu t o và tính chất tương tự nhau, nhưng thành phần
phân tử sai khác nhau 1 hoặc nhiều nhóm metylen (-CH2-)
1.2.3.2. Đồng phân
Là hiện tượng ng với 1 cơng th c phân tử có 2 hoặc nhiều hợp chất khác nhau.
Nguyên nhân c a hiện tượng đồng phân là do nhiều chất có cùng một CTPT song cấu
trúc l i khác nhau, cấu trúc gồm cấu t o hóa học lẫn cấu trúc khơng gian nên có 2 lo i đồng
phân: đồng phân cấu t o và đồng phân không gian
Đồng phân cấu t o (đồng phân phẳng): là những chất có cùng một CTPT nhưng có cấu
t o khác nhau và do đó tính chất khác nhau.Ví dụ:
- Đồng phân cấu t o về m ch cacbon: do sự sắp xếp m ch cacbon khác nhau.
Butan Isobutan
CH<sub>3</sub>-CH<sub>2</sub>-CH<sub>2</sub>-CH<sub>3</sub> CH<sub>3</sub>-CH-CH<sub>3</sub>
CH<sub>3</sub>
- Đồng phân cấu t o về nhóm ch c: do sự khác nhau về lo i nhóm ch c
CH3-CH2-OH ; CH3-O-CH3
- Đồng phân cấu t o về vị trí: các đồng phân khác nhau về vị trí nhóm ch c, vị trí
nhóm thế, vị trí liên kết bội.
</div>
<span class='text_page_counter'>(11)</span><div class='page_container' data-page=11>
C4H8: CH3-CH=CH-CH3 ; CH2=CH-CH2-CH3
<b>1.3. C u trúc không gian vƠ đ ng phơn l p thể</b>
<b>1.3.1. Khái ni m về c u trúc không gian vƠ công th c mô t c u trúc không gian</b>
1.3.1.1. Thuyết cacbon t diện
Được ch ng minh nh hoá học lượng tử và thí nghiệm lí-hố học. Năm 1874, Lebel và
Vant’Hoff đã đưa ra thuyết cấu t o t diện c a cacbon. Thuyết này cho rằng nguyên tử C a,
b, c, d được phân bố trong 1 t diện đều, nguyên tử C nằm t i tâm t diện, bốn nhóm a, b, c,
d nằm t i 4 đỉnh c a t diện,thuyết này hồn tồn phù hợp với thuyết lai hóa C ( tr ng thái
lai hóa sp3 ).
1.3.1.2. Cơng th c mô t cấu trúc không gian
Công th c mơ t cấu trúc khơng gian gồm có 3 lo i:
a. Công th c phối c nh
Cách 1: Trong công th c phối c nh, các nét g ch liền bình thư ng (-) biểudiễn liên kết
cộng hóa trị có trục nằm trên mặt phẳng giấy, các nét g ch gián đo n mô t liên kết hướng
phía sau t giấy, cịn nét đậm chỉ liên kết về phía trước t giấy.
Ca, Cb: nối trên mặt phẳng giấy
Cc: nối trước mặt phẳng giấy
Cd: nối sau mặt phẳng giấy
Cách 2: Công th c phối c nh thư ng chỉ dùng cho các phân tử có liên kết đơn C-C
trung tâm. Theo cách biểu diễn này liên kết C-C được biểu diễn bằng đư ng chéo từ trái qua
ph i và xadần ngư i quan sát.
</div>
<span class='text_page_counter'>(12)</span><div class='page_container' data-page=12>
Trong công th c Newman, ngư i ta qui ước quan sát việc nhìn thẳng trục liên kết C-C
trung tâm, nguyên tử C th nhất gần ngư i quan sát được biểu diễn bằng 1 chấm t i vòng
tròn, 3 liên kết t o góc 1200
. Nguyên tử C th 2 bị che khuất.
Ví dụ: D ng meso c a axit tactric có thể biểu diễn bằng cơng th c Newman như sau:
c. Công th c Fisher
Trong công th c chiếu này, ngư i ta qui ước nguyên tử cacbon t diện như 1 dấu chữ
thập.
- 2 nối nằm ngang được qui ước là 2 nối trước mặt phẳng.
- 2 nối thẳng đ ng sau mặt phẳng.
Ví dụ: axit lactic CH3CHOHCOOH
</div>
<span class='text_page_counter'>(13)</span><div class='page_container' data-page=13>
COOH > -CHO > -CH2OH > -CH3
<b>1.3.2. Đ ng phơn hình h c</b>
Đồng phân hình học (đồng phân <i>cis</i>/<i>trans</i> ) là 1 lo i đồng phân không gian (hay đồng
phân lập thể), đồng phân này xuất hiện nhiều lo i hợp chất đặc biệt là các hợp chất có nối
đơi C=C, C=N, N=N hoặc vịng no (vòng nhỏ) và mỗi nguyên tử C c a nối đơi hay mắc
vịng ph i có 2 nhóm thế khác nhau.
- a khác b và c khác d.
- Chất có nhóm thế giống nhau hay gần giống nhau cùng 1 phía gọi là đồng phân <i>cis,</i>
khác phía gọi là đồng phân <i>trans</i>.
Thư ng đồng phân <i>trans </i>bền hơn <i>cis</i>và có nhiệt độ nóng ch y cao hơn nhưng nhiệt độ
sơi và mô men lưỡng cực thấp hơn.
Đối với các hợp chất hữu cơ có nhiều nối đơi liên hợp số đồng phân <i>cis-trans</i>như:
</div>
<span class='text_page_counter'>(14)</span><div class='page_container' data-page=14>
Đồng phân quang học là những hợp chất có cùng cơng th c khai triển trong mặt phẳng
nhưng công th c lập thể khác nhau, do đó đưa đến kết qu là hiệu ng c a chúng trên ánh
sáng phân cực phẳng khác nhau.
1.3.3.1. Khái niệm về tính quang ho t và tính khơng trùng vật nh
Tính chất làm quay mặt phẳng c a ánh sáng phân cực sang bên ph i hoặc sang bên trái
một góc <sub>được gọi là tính quang ho t, cịn các chất có ho t động quang học gọi là chất </sub>
quang ho t.
Điềukiện xuất hiện tính quang ho t mộtchất: là ph i có yếu tố khơng trùng vật- nh.
Ví dụnhư 2 bàn tay đối x ng nhau qua gương phẳng nhưng khơng chồng khít lên nhau.
Đồng phân quang học có ch a C bất đối, kí hiệu C* <sub>là C mang bốn nguyên tử hay </sub>
nhóm nguyên tử khác nhau.
C*a,b,c,d với a khác b khác c khác d.
Ví dụ:
Vậy đối với chất hữu cơ hiện tượng đồng phân quang học đặc trưng cho những phân tử
không trùng với hình nh c a chúng trong gương.
Khi có 1 C* thì có 2 đồng phân quang học, có2 cấu hình đối x ng nhau qua mặt phẳng
gương, tương tự ngư i và nh qua gương.
Ví dụ: Glixerandehit CH2OH-CHOH-CHO có 1C* vì nối với 1 nguyên tử hay nhóm
nguyên tử khác nhau –H, -OH, -CH2OH, -CHO.
- Hai d ng (+, -) glixerandehit là những đồng phân quang học c a nhau, chúng chỉ khác
</div>
<span class='text_page_counter'>(15)</span><div class='page_container' data-page=15>
- Hai chất đối quang có cấu t o hóa học giống nhau, kho ng cách giữa các nguyên tử
trong phân tử giống nhau, chúng chỉ khác nhau về sự phân bố các nguyên tử và nhóm
nguyên tử chung quanh C*<sub>nên còn gọi là đồng phân cấu hình (vì sự khác nhau</sub> <sub>về cấu hình) </sub>
hay đồng phân không gian.
- Hỗn hợp 2 chất đối quang c a nhau với số mol bằng nhau gọi là biến thể raxemic. Ví
dụ: (+, -) glixerandehit.
Trong cơng th c Fischer, nhóm OH t i C* <sub>đánh số lớn nhất được phân bố bên ph i </sub>
gọi là D-, còn bên trái gọi là L-. D viết tắt từ Dextrorotatory: quay ph i, L viết tắt từ
Levorotatory: quay trái.
Khi số nguyên tử C* <sub>tăng lên, số đồng phân quang học tăng lên nếu có nC</sub>*
(khơng
giống nhau) thì có 2n<sub>đồng phân quang học.</sub>
<b>1.3.4. S l c về đ ng phơn c u d ng</b>
Là lo i đồng phânsinh ra do sự quay quanh 1 hay nhiều liên kết đơn (trục liên kết) t o
ra nhiều d ng hình học khác nhau, với thế năng khác nhau. Các cấu d ng này có độ bền
khác nhau về mặt năng lượng, cấu d ng bền có m c năng lượng thấp nhất.
Đồng phâncấu d ng được biểu diễn bằng công th c phối c nh hay Newman.
1.3.4.1. Cấu d ng c a hợp chất m ch h
Đặc trưng cấu d ng c a hợp chất m ch h là cấu d ng che khuất và cấu d ng xen kẽ.
Thông thư ng d ng che khuất kém bền hơn d ng xen kẽ vì các nguyên tử H 2 C gần nhau
đẩy nhau.
Ví dụ: với 1,2-dibromoetan
- Cấu d ng xen kẽ (cấu d ng lệch): bao gồm đối lệch (lệch 180o) và bán lệch (lệch
60o).
</div>
<span class='text_page_counter'>(16)</span><div class='page_container' data-page=16>
Công th c Newman:
- Cấu d ng che khuất: gồm che khuất tồnphần và bán phần.
Cơng th c phối c nh:
Công th c Newman:
1.3.4.2. Cấu d ng c a hợp chất m ch vòng
Xét cấu d ng c a xiclohexan : gồm cấu d ng bền và cấu d ng không bền
- D ng bền: là d ng ghế (hình gấp khúc như hình ghế)
</div>
<span class='text_page_counter'>(17)</span><div class='page_container' data-page=17>
<b>1.4. C u trúc electron. Liên kết cộng hóa tr vƠ các liên kết yếu</b>
<b>1.4.1. B n ch t vƠ đặc điểm c a liên kết cộng hóa tr</b>
Trong hố học vơ cơ liên kết ch yếu là liên kết ion, thì trong hố học hữu cơ liên kết
ch yếu là liên kết cộng hoá trị.
Thuyết cổ điển: Cho rằng khi 2 nguyên tử liên kết với nhau thì mỗi ngun tử góp 1
electron c a mình, các electron ch y trên 1 quĩ đ o với electroncũ làm nên lớp vỏ khí trơ.
Thuyết hiện đ i: Liên kết cộng hoá trị được t o ra do sự xen ph cực đ i các obitan
nguyên tử (AO) t o nên obitan phân tử (MO).
1.4.1.1. Sự xen ph obitan
Có 2 kiểu xen ph chính:
- Xen ph trục: t o thành liên kết (liên kết đơn).
Liên kết <sub>được hình thành do sự xen ph trục nằm trên trục nối 2 h t nhân c a 2 </sub>
nguyên tử đó.
- Xen ph bên: t o liên kết (liên kết đôi, liên kết ba).
Liên kết được hình thành nh sự xen ph bên c a 2 obitan p c nh nhau và có trục
song song với nhau (thư ng là 2AOpxhoặc 2AOpy).
Liên kết kém bền hơn liên kết nên dễ bị đ t ra trong các ph n ng hóa học.
1.4.1.2. Sự lai hóa obitan
Để gi i thích hóa trị 4 c a cacbon, ngư i ta cho rằng tr ng thái kích thích 1electron
2s chuyển sang obitan trống 2p.
Tr ng thái cơ b n C có cấu hình: 1s22s22p2
Tr ng thái kích thích: 1s22s22p3
</div>
<span class='text_page_counter'>(18)</span><div class='page_container' data-page=18>
Có 3 kiểu lai hóa:
- Lai hóa sp3 (lai hóa t diện). Liên kết đơn.
1AO-s + 3AO-p = 4AO-sp3 .
Khi 1 obitan s và 3 obitan p tổ hợp với nhau t o thành 4 obitan lai hóa sp3<sub>. Trục</sub>
các
obitan này t o góc 1090
28' và hướng về 4 đỉnh c a 1 t diện đều mà tâm là nguyên tử
cacbon.
Trong các phân tử hợp chất hữu cơ các obitan sp3 <sub>sẽ xen ph trục với AO các nguyê</sub>
n
tử khác t o nên liên kết .
Ví dụ: Xét sự hình thành liên kết <sub>trong phân tử etan.</sub>
- Lai hóa sp2 (lai hóa tam giác). Liên kết đơi.
1AO-s + 2AO-p = 3AO-sp2
Khi 1 obitan s và 2 obitan p tổ hợp với nhau t o thành 3 obitan lai hóa sp2có trục nằm
trên một mặt phẳngvà t o góc 1200<sub>và hướng về 3 đỉnh c a 1 tam giác mà tâm là nguyên tử </sub>
cacbon.
Obitan sp2 sẽ xen ph với AO c a nguyên tử khác t o những liên kết . Khi ấy mỗi
cacbon sp2 cịn một AO-2p chưa lai hố và có trục thẳng góc với mặt phẳng ch a các trục
c a 3 obital sp3<sub>, AO này sẽ xen ph bên với AO</sub>
-2p c a nguyên tử C khác t o liên kết .
</div>
<span class='text_page_counter'>(19)</span><div class='page_container' data-page=19>
Ví dụ: etylen
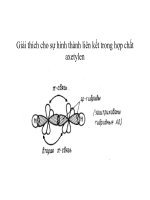
- Lai hóa sp (lai hóa đư ng thẳng). Liên kết ba.
1AO-s + 1AO-p = 2AO-sp
Khi 1 obitan s và 1 obitan p tổ hợp với nhau t o thành 2 obitan lai hóa sp có trục nằm
trên 1 đư ng thẳng và t o góc 1800
- 2AO-sp xen ph trục với AO c a 2 nguyên tử khác t o liên kết với góc hố trị
1800. Cịn 2 AO-2p chưa lai hố có trục thẳng góc với nhau và cùng thẳng góc với trục đối
x ng chung c a 2 AO-sp, sẽ xen ph bên với 2AO chưa lai hoá c a nguyên tử khác t o 2
liên kết <sub>. Tập hợp gồm 2 liên kết </sub> và 1 liên kết giữa 2 nguyên tử t o thành liên kết ba.
Ví dụ: axetilen
1.4.1.3. Một số đặc điểm c a liên kết cộng hóa trị
a. Năng lượng liên kết
< 0: To nhiệt : Năng lượng to ra khi hình thành phân tử từ các nguyên tử (t o
liên kết).
> 0: Thu nhiệt: Phân tử bị phá vỡ (liên kêt bị đ t).
</div>
<span class='text_page_counter'>(20)</span><div class='page_container' data-page=20>
Ta phân biệt năng lượng liên kết là những giá trị trung bình khơng tính đến phần cịn
l i c a phân tử sau khi làm đ t 1 liên kết, còn năng lượng phân li liên kết là đ i lượng đặc
trưng cho sự phân cắt 1 liên kếtnhất định c a một phân tử cụ thể.
Ví dụ: Metan
Năng lượng liên kết C – H là 1659 : 4 = 415 KJ/mol.
Năng lượng phân li liên kết: không bằng nhau
b. Độ dài liên kết - dA-B
Kho ng cách giữa 2 h t nhân c a 2 nguyên tử liên kết với nhau được gọi là độ dài liên
kết.
Ví dụ: liên kết C -C C = C C C
d 1,54A0 1,34A0 1,20A0
- Một cách gần đúng tính dA-Btừ các bán kính cộng hố trị rA và rB : dA-B = rA + rB
- Nhìn chung bậc c a liên kết (đơn, đơi hoặc ba) càng tăng thì liên kết càng ngắn; đối
với liên kết đơn giữa C với nguyên tử khác, d gi m khi tăng tỉ lệ s trong AO lai hoá: sp3 >
sp2 > sp.
<b>1.4.2. Liên kết hiđro </b>
1.4.2.1. Khái niệm
Liên kết hiđro (biểu thị bằng 3 dấu chấm) là một liên kết yếuxuất hiện giữa nguyên tử
H và nguyên tử hoặc nhóm ngun tử có tính âm điện như O, N, F...trong đó có ít nhất một
ngun tử có cặp electron chưa sử dụng (tự do) nh tương tác tĩnh điện yếu kho ng 20-25
KJ/mol
4
CH 4H C , H 1659KJ / mol
3 3
2 2
CH H CH H , H 435KJ / mol
CH H CH H , H 433KJ / mol
CH H C H H , H 433KJ / mol
C H C H , H 338KJ / mol
</div>
<!--links-->