Đề ôn lý thuyết và bài tập mẫu môn hóa đề 10
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (224.18 KB, 10 trang )
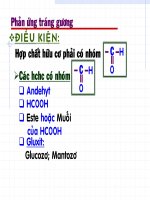
Phaàn 2
Các định luật trong hóa học
Cần nhớ 3 Định luật sau:
ĐỊNH LUẬT
BẢO TOÀN ĐIỆN TÍCH
( ĐLBTĐT)
ĐỊNH LUẬT
BẢO TOÀN KHỐI LƯNG
( ĐLBTKL)
ĐỊNH LUẬT
THÀNH PHẦN KHÔNG ĐỔI
( ĐLTPKĐ)
1. ĐỊNH LUẬT BẢO TOÀN ĐIỆN TÍCH
( ĐLBTĐT): Có 3 nội dung cần nhớ
Trong dung dịch
ΣMol điện tích (+) =ΣMol điện tích (-)
Trên phương trình ion:
Σ đ.tích Vế trái
=
Σ đ.tích vế phải
Các quá trình oxi hóa khử
Σ Số e cho
=
Σ số e nhận
Σ mole cho = Σ mole nhận
2. ĐỊNH LUẬT BẢO TOÀN KHỐI LƯNG
( ĐLBTKL): Có 3 nội dung cần nhớ
Trong dung dịch
Σmion trong dd = Σmchất tan trong dd
Với:
m ion =• nion
x
M ion
M ion=Mnguyên tố tạo ion
Aùp duïngï 1:
Na+ : x mol
Al3+: y mol
ddA SO 2-: z mol
4
Cl-: t mol
Tính khối lương muối trong ddA theo x, y, z, t
Trong dung dịch
Σmion trong dd = Σmchất tan trong dd
m ion =
x
M ion
M ion=Mnguyên tố tạo ion
p dụng 1:
Na+ : x mol
Al3+: y mol
ddA SO 2-: z mol
4
Cl-: t mol
Tính khối lương muối
trong ddA theo x, y, z, t
Giải:
Theo ÑLBTKL coù:
p dụng 2: (ĐHQGTP.HCM –1999)
Fe2+: 0,1 mol
Al3+ : 0,2 mol
ddA SO2- : x mol
4
Cl- : y mol
Khi cô cạn ddA, thu được
46,9 gam rắn. Tính x,y ?
Trong dung dịch
Σmion trong dd = Σmchất tan trong dd
m ion =• nion x M ion
M ion=Mnguyên tố tạo ion
Trong hợp chất
Σm nguyên tố = Σm
hợp chất
Trên phản ứng
Σm vế trái = Σmvế phải
p dụng 3: (Trích đề thi ĐHQG – 1999)
Hỗn hợp R: C2H4, C3H6(C3H6 chiếm
71,43% theo thể tích). Hỗn hợp X:R, H2
với số mol R gấp 5 lần số mol H2.
Lấy 9,408 lit X(đkc) đun nóng với Ni,
sau một thời gian; thu được hhZ.
Tính khối lượng hỗn hợp Z
p dụng 4: (Trích ĐHYD – 1998)
Dẫn CO dư qua ống sứ đựng 5,8 gam
FexOy nóng đỏ Sau 1 thời gian thu
được hh X chứa các chất rắn.
Cho hhX phản ứng hết với HNO3 đặc
(dư), thu được 18,15 gam muối sắt.
Tìm công thức oxit trên.
p dụng5:( ĐHYDTP.HCM – 2000)
Cho pứ:
0,1 mol A+H2O →18g C3H6O3+ 4,6 g C2H6O
Tìm CTPT- CTCT A, biết :
số mol A : soá mol H2O = 1:2