ma tran de ktra 10CB trac nghiem ki 2
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (117.25 KB, 4 trang )
<span class='text_page_counter'>(1)</span><div class='page_container' data-page=1>
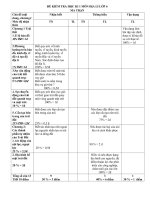
<b>MA TRẬN KIỂM TRA HỌC KÌ 2 LỚP 10CB NĂM HỌC 2011 - 2012</b>
I. Cấu trúc đề:
<b> Tên Chủ đề</b>
<b>Nội dung</b>
<b>Nhận biết</b> <b>Thông hiểu</b> <b>Vận dụng ở</b>
<b>mức độ thấp</b>
<b>Vận dụng ở</b>
<b>mức cao hơn</b>
<b>Cộng</b>
<b>1. Chương </b>
<b>halogen</b>
- Clorua vơi. - Tính axit HF.
- Cấu hình
electron nhóm
VIIA.
- Thành phần
nước Giaven.
- Tính chất hóa
học clo.
- Tính chất hóa
học HCl.
- Ngun nhân
tính sát trùng
của clorua vơi.
- Bài tốn.
- Tính chất hóa
học của clo,
halogen.
- Nhận biết
halogen.
<i><b>Số câu </b></i>
<i><b>Số điểm</b></i>
<i><b>(Tỉ lệ %)</b></i>
<i><b>1</b></i>
<i><b>0.33</b></i>
<i><b>3</b></i>
<i><b>0.99</b></i>
<i><b>4</b></i>
<i><b>1.32</b></i>
<i><b>3</b></i>
<i><b>0.99</b></i>
<i><b>11</b></i>
<i><b>3.63</b></i>
<i><b>36.3%</b></i>
<b>2. Chương oxi –</b>
<b>lưu huỳnh</b>
- Cách pha loãng
H<b>2</b>SO<b>4</b> đặc.
- S + Hg
- KL + H<b>2</b>SO<b>4</b>
loãng.
- Ứng dụng của
O<b>3</b>.
- KL + H<b>2</b>SO<b>4</b>
đặc, nóng.
- Cu + H<b>2</b>SO<b>4</b>
đặc.
- So sánh tính
chất hóa học của
O<b>2</b>, O<b>3</b>, S.
- Glucozo +
H<b>2</b>SO<b>4</b> đặc.
- Tính chất hóa
học của H<b>2</b>S.
- SO2 +NaOH.
- Bài tốn
-Hỗn hợp KL+
H2SO4 lỗng.
- Bình đựng
H2SO4 đặc
trong khơng
khí ẩm.
- Xác định tên
KL.
- Phân biệt:
O2, CO2, O3,
HCl.
<i><b>Số câu </b></i>
<i><b>Số điểm</b></i>
<i><b>(Tỉ lệ %)</b></i>
<i><b>2</b></i>
<i><b>0.66</b></i> <i><b>3</b><b>0.99</b></i> <i><b>4</b><b>1.32</b></i> <i><b>6</b><b>1.98</b></i> <i><b>15</b><b>4.95</b></i>
<i><b>49.5%</b></i>
<b>3. Tốc độ phản</b>
<b>ứng</b> - Tốc độ phản ứng.
- Các yếu tố ảnh
hưởng đến
chuyển dịch cân
bằng.
<i><b>Số câu </b></i>
<i><b>Số điểm</b></i>
<i><b>(Tỉ lệ %)</b></i>
<i><b>4</b></i>
<i><b>1.32</b></i> <i><b>1.32</b><b>4</b></i>
<i><b>13.2%</b></i>
<i><b>Tổng số câu </b></i>
<i><b>Tổng số điểm</b></i>
<i><b>(Tỉ lệ %)</b></i>
</div>
<span class='text_page_counter'>(2)</span><div class='page_container' data-page=2>
<b>II. Đề:</b>
<b>SỞ GD & ĐT KIÊN GIANG KIỂM TRA HỌC KÌ II LỚP 10CB NĂM HỌC 2011-2012 </b>
<b>TRƯỜNG THPT KIÊN HẢI MƠN: HĨA HỌC</b>
<b>1. </b>Clorua vôi là muối của kim loại canxi với 2 loại gốc axit là clorua Cl-<sub> và hipocloric ClO</sub>-<sub>. Vậy, clorua vơi là</sub>
loại muối:
<b>A.</b> Muối trung hịa <b>B.</b> Muối kép <b>C.</b> Muối của 2 axit <b>D.</b> Muối hỗn tạp
<b>2. </b>Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là:
<b>A.</b> Cu, Zn, Na <b>B.</b> K, Mg, Al, Fe, Zn. <b>C.</b> Ag, Ba, Fe, Sn <b>D.</b> Au, Pt, Al
<b>3. </b>Trong các phản ứng sau, phản ứng chứng tỏ nguyên tố clo vừa là chất oxi hóa, vừa là chất khử là:
<b>A.</b> Cl2 + H2O + SO2 2HCl + H2SO4
<b>B.</b> Cl2 + H2O HCl + HClO
<b>C.</b> 2Cl2 + 2H2O 4HCl + O2
<b>D.</b> Cl2 + H2 2HCl
<b>4.</b> Khi cho 0,1 mol Cu tác dụng hết với dung dịch H2SO4 đặc, nóng thì thể tích khí SO2 thu được (đktc) là:
<b>A.</b> 2,24l <b>B.</b> 4,48l <b>C.</b> 0,448l <b>D.</b> 0,224l
<b>5. </b>Để đánh giá mức độ xảy ra nhanh hay chậm của các phản ứng hoá học người ta dùng đại lượng:
<b>A.</b> Nhiệt độ. <b>B.</b> Tốc độ phản ứng. <b>C.</b> Áp suất <b>D.</b> Thể tích khí
<b>6. </b>Cho phản ứng: N2(k) + H2(k) ⇋ 2NH3(k) <sub></sub><i>H</i> = -92KJ
Khi tăng áp suất thì cân bằng chuyển dịch theo chiều:
<b>A.</b> Chiều nghịch <b>B.</b> Không chuyển dịch <b>C.</b> Chiều thuận <b>D.</b> Không xác định
được
<b>7.</b> Tính axit của các axit HX được sắp xếp theo thứ tự giảm dần là:
<b>A.</b> HF, HCl, HBr, HI <b>B.</b> HI, HBr, HCl, HF <b>C.</b> HCl, HBr, HI, HF <b>D.</b> HBr, HCl, HI, HF
<b>8.</b> Cho các mệnh đề dưới đây:
(I) Trong hợp chất với flo, số oxi hóa của oxi là số dương
(II) Flo là chất có tính khử rất mạnh
(III) Brom đẩy được Cl2 ra khỏi dung dịch muối NaCl
(IV) AgBr là chất kết tủa màu vàng nhạt
Các mệnh đề đúng là:
<b>A.</b> I, II, III <b>B.</b> I, III <b>C.</b> I, IV <b>D.</b> I, II, IV
<b>9.</b> Những ngun tố có cấu hình ns2<sub>np</sub>5<sub> thuộc nhóm:</sub>
<b>A.</b> Nhóm oxi – lưu huỳnh <b>B.</b> Nhóm halogen <b>C.</b> Nhóm cacbon <b>D.</b> Nhóm nitơ
<b>10.</b> Nước Giaven là hỗn hợp của các thành phần:
<b>A.</b> HCl, HClO, H2O <b>B.</b> NaCl, NaClO, H2O <b>C.</b> NaCl, NaClO3, H2O <b>D.</b> NaCl, NaClO4, H2O
<b>11. </b>Cho một luồng khí clo vào dung dịch KI, sau đó nhỏ vài giọt dung dịch hồ tinh bột thì hiện tượng xảy ra
là:
<b>A.</b> Màu xanh <b>B.</b> Màu vàng nhạt <b>C.</b> Khơng màu <b>D.</b> Màu đỏ
<b>12.</b> Bình đựng H2SO4 đặc để trong khơng khí ấm sau một thời gian thì khối lượng bình thay đổi:
<b>A.</b> Tăng lên <b>B.</b> Giảm đi <b>C.</b> Khơng thay đổi <b>D.</b> Có thể tăng hoặc giảm
<b>13.</b> Có 4 lọ mất nhãn đựng các dung dịch riêng biệt: NaF, NaCl, NaCl, NaI. Hóa chất dùng để nhận biết 4
dung dịch trên là:
<b>A.</b> Quỳ tím <b>B.</b> AgNO3 <b>C.</b> CuSO4 <b>D.</b> BaCl2
<b>14. </b>Cho các chất: sắt (II) hidroxit, kim loại đồng, kim loại nhôm, đồng (II) oxit tác dụng lần lượt với HCl. Số
phản ứng xảy ra là:
<b>A.</b> 1 <b>B.</b> 2 <b>C.</b> 3 <b>D.</b> 4
<b>15.</b> Tính sát trùng, tẩy màu của clorua vôi là do nguyên nhân:
<b>A.</b> Do clorua vôi dễ phân hủy ra oxi nguyên tử có tính oxi hóa mạnh
<b>B.</b> Do clorua vơi phân hủy ra Cl2 là chất oxi hóa mạnh
<b>C.</b> Do trong phân tử clorua vôi chứa nguyên tử clo với số oxi hóa +1 có tính oxi hóa mạnh.
</div>
<span class='text_page_counter'>(3)</span><div class='page_container' data-page=3>
<b>16.</b> Cho Cl2 tác dụng với Al tạo thành 26,7 gam AlCl3. Khối lượng Cl2 cần dùng là:
<b>A.</b> 23,1 gam <b>B.</b> 21,3 gam <b>C.</b> 12,3 gam <b>D.</b> 13,2 gam
<b>17.</b> Cho hỗn hợp gồm 5,4 gam Al và 3,2 gam Cu tác dụng với dung dịch HCl dư. Thể tích khí thu được (đktc)
là:
<b>A.</b> 4,48l <b>B.</b> 3,36l <b>C.</b> 8,96l <b>D.</b> 6,72l
<b>18.</b> Phát biểu dưới đây không đúng là:
<b>A.</b> H2SO4 đặc là chất hút nước mạnh
<b>B.</b> Khi tiếp xúc với H2SO4 đặc, dễ gây bỏng nặng
<b>C.</b> H2SO4 lỗng có đầy đủ tính chất chung của axit
<b>D.</b> Khi pha loãng H2SO4 đặc, ta phải cho từ từ nước vào axit.
<b>19.</b> Nguyên tử của nguyên tố X có 10 electron p. X là nguyên tố nào trong số các nguyên tố sau :
<b>A.</b> O <b>B.</b> S <b>C.</b> Se <b>D.</b> Te
<b>20.</b> Nguyên nhân làm cho nước ozon có thể bảo quả hoa, quả tươi lâu ngày là:
<b>A.</b> Do ozon là một khí độc
<b>B.</b> Do ozon độc và dễ tan trong nước hơn oxi
<b>C.</b> Do ozon có tính oxi hóa mạnh, khả năng sát trùng cao và dễ tan trong nước hơn oxi
<b>D.</b> Do ozon có tính tẩy màu.
<b>21.</b> So sánh tính oxi hóa của oxi, ozon, lưu huỳnh, ta thấy:
<b>A.</b> S > O2 > O3<b>B.</b> O2 > O3 > S <b>C.</b> S < O2 < O3 <b>D.</b> O2 < O3 < S
<b>22.</b> Các khí sinh ra khi cho sacrarozơ vào dung dịch H2SO4 đặc, nóng, dư, gồm:
<b>A.</b> H2S, CO2 <b>B.</b> H2S, O2 <b>C.</b> SO3, CO2 <b>D.</b> SO2, CO2
<b>23.</b> Sục 6,4 gam khí lưu huỳnh đioxit vào 300 ml dung dịch NaOH 1M thì các muối tạo thành là:
<b>A.</b> Na2SO3, NaHSO3 <b>B.</b> Na2SO3 <b>C.</b> Na2SO4, NaHSO4 <b>D.</b> NaHSO3
<b>24.</b> Khối lượng chất rắn thu được khi cho 3,45 gam kim loại Na tác dụng với 6,4 gam lưu huỳnh là:
<b>A.</b> 10,67 gam <b>B.</b> 9,85 gam <b>C.</b> 5,31 gam <b>D.</b> 11,70 gam
<b>25.</b> Phân tích chất X người ta thấy thành phần khối lượng của nó gồm 50% S, 50% O. Chất X là:
<b>A.</b> SO3 <b>B</b>. SO2 <b>C.</b> S2O7 <b>D.</b> Không xác định được
<b>26.</b> Cho biết cân bằng sau được thực hiện trong bình kín: PCl5(k) ⇋ PCl3(k) + Cl2(k) ; <i>H</i> > 0
Yếu tố làm tănng lượng PCl3 trong cân bằng là:
<b>A.</b> Thêm PCl5 <b>B.</b> Thêm Cl2 <b>C.</b> Giảm nhiệt độ <b>D.</b> Tăng áp suất
<b>27.</b> Hịa tan hồn tồn 2,1 gam hỗn hợp gồm Fe, Mg, Al bằng dung dịch H2SO4 loãng vừa đủ, thu được 1,334
lít H2 (đktc). Khối lượng muối khan thu được sau khi cô cạn là:
<b> </b> <b> A.</b> 7,86g <b>B.</b> 8,25g <b>C.</b> 7,78g <b>D.</b> 7,6g
<b>28.</b> Hơi thủy ngân rất độc, khi làm vỡ nhiệt kế thủy ngân người ta dùng chất bột rắc lên thủy ngân rồi gom lại.
Chất bột đó là:
<b>A.</b> Vôi sống <b>B.</b> Cát <b>C.</b> Lưu huỳnh <b>D.</b> Muối ăn
<b>29.</b> Có 4 lọ khí, khơng màu mất nhãn gồm: O2, CO2, O3, HCl. Để phân biệt các chất khí, người ta dùng:
<b>A.</b> Giấy quỳ tím ẩm, dung dịch nước vơi trong, dung dịch KI có hồ tinh bột
</div>
<span class='text_page_counter'>(4)</span><div class='page_container' data-page=4>
<b>C.</b> Giấy quỳ tím ẩm và dung dịch AgNO3.
<b> </b> <b> D.</b> Dung dịch nước vơi trong và quỳ tím ẩm
<b>30.</b> Cho 5,6 gam một kim loại hóa trị II tác dụng với dung dịch H2SO4 lỗng, dư thu được 2,24 l khí H2 (đktc).
Kim loại đó là:
<b>A.</b> Mg <b>B.</b> Cu <b>C.</b> Zn <b>D.</b> Fe
<b>III. Đáp án:</b>
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
</div>
<!--links-->