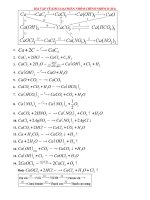Tài liệu BÀI TẬP VỀ KIM LOẠI (Fe – Cu – Cr) doc
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (127.77 KB, 24 trang )
1
BÀI TẬP VỀ KIM LOẠI (Fe – Cu – Cr)
Câu 1: Cho hổn hợp A chứa Fe, Cu, Ag. Ngâm hổn A trong dung dịhc B ( B chỉ
chứa 1 chất ( dư)) . Khi kết thúc phản ứng thấy Fe, Cu trong hổn hợp tan hết và
còn lại 1 lượng Ag đúng bằng lượng Ag có trong A ban đầu. Tìm chất chứa trong
B?
A. AgNO
3
C. Cu(NO
3
)
2
B. CuSO
4
D. Fe
2
(SO
4
)
3
Hướng dẫn giải:
Từ dữ kiện bài toán suy ra B chỉ có thể là muối hoặc axit
+) Nếu B là dung dịch axit:
- Axit chứa gốc có tính oxi hoá: Cả 3 kim loại đều tan
- Axit chứa gốc không có tính oxi hóa : Cu, Ag không tan
Dựa vào bài toán B không phải là đung dịch axit.
+) Vậy B là muối:
- Vì Fe, Cu + B nên B chứa muối có ion kim loại có tính oxi hóa.
- B không phản ứng với Ag nên tính oxi hóa của ion kim loại trong B yếu
hơn Ag
+
- B phản ứng với Cu nên tính oxi hóa của ion kim loại trong B mạnh hơn
Cu
2+
Vậy ion kim loại trong B đứng sau Cu
2+
và đứng trước Ag
+
trong dãy điện
hóa
Ion kim loại có trong B là ion Fe
3+
Đáp án D
Câu 2: Cho lượng dư bột sắt tác dụng với 250 ml HNO
3
4M ( nung nóng ).
Khi phản ứng xảy ra hòan tòan thu được V (lít) khí NO duy nhất. Giá trị của V
(lít) là:
A. 0,56 B. 5,6 C. 11,2 D. 6,5
Hướng dẫn giải:
2
Ta có :
3
HNO
n
= 0,25.4 = 1 (mol)
Vì Fe dư nên muối sắt tạo thành là muối sắt (II) : Fe(NO
2
)
2
Quá trình nhận electron: N
+5
+3e → N
+2
Dựa vào định luật bảo tòan electron ta có :
-
3
NO
n
( tạo muối) = 3. n
NO
Mặt khác ta có:
3
HNO
n
=
-
3
NO
n
(tạo muối) + n
NO
= 4. n
NO
→
3
HNO
NO
n
1
n = = =0,25(mol)
4 4
→V = 0,25.22,4 = 5,6 (lít) → Đáp án B.
Câu 3: Cho 2,13 gam hổn hợp gồm 2 kim loại Fe, Cu ở dạng bột tác dụng hoàn
toàn với Oxi thu được hổn hợp Y gồm các oxit có khối lượng là 3,33(g). Thể tích
dung dịch HCl 2M vừa đủ để hòa tan hết lượng oxit ở hổn hợp Y là :
A. 150 (ml) B. 75(ml) C. 37,5(ml) D. 120(ml)
Hướng dẫn giải :
Ta có các quá trình xảy ra :
2
O HCl
x y 2 n
M M O H O+MCl
2 2
O O(H O) H O HCl
3,33-2,13 1
n = = 0,075(mol) = n = n = n
16 2
→ n
HCl
= 2.
2
H O
n
= 2.0,075 = 75 (ml) → Đáp án B.
Câu 4: Hòa tan a (gam) hổn hợp kim loại Fe và Cu ( trong đó Fe chiếm 30%)
bằng 50 ml dung dịch HNO
3
63% ( d = 1,38 g/ ml ). Khi ph ản ứng xảy ra hoàn
toàn thu được chất rắn A nặng 0,75.a (g); dung dịch B và 3,24 lít hổn hợp NO
2
và
NO ở 54,6
0
C, 1atm. Hỏi khi làm khô dung dịch B thu được bao nhiêu gam muối
khan?
A. 33, 3748 (g) B. 35,676(g) C. 36,37(g) D. 37,566(g)
Hướng dẫn giải :
Theo bài ra ta có : m
Fe
= 0,3.a(g) ; m
Cu
= 0,7.a(g)
3
3 2
HNO NO NO
n =0,69 (mol); n +n =0,2726(mol)
Sau phản ứng m
rắn A
= 0,75.a > m
Cu
= 0,7.a → Chứng tỏ sắt dư và Cu không phản
ứng.
Như vậy, muối sắt thu được là muối sắt (II) : Fe(NO
3
)
2
Theo đinh luật bảo toàn khối lượng ta có :
- -
2
3 3 3
NO NO
NO (trongHNO ) NO (taomuoi)
n = n + n +n
→
-
3 2
3
HNO NO NO
NO (taomuoi)
n = n -(n +n )
→
-
3
NO (taomuoi)
n = 0,69 - 0,2726 = 0,4174(mol)
-
3 2 3 2
3
Fe(NO ) Fe(NO )
NO
1
n = n =0,2087(mol) m =0,2078.180=37,566(g)
2
→ Đáp án D.
Câu 5: Cho hổn hợp Fe và Cu vào dung dịch HNO
3
(l) sau khi phản ứng xảy ra
hòan toàn được dung dịch màu xanh; khí B có màu nâu đỏ và chất rắn C.
a) Dung dịch A chứa:
A. Fe(NO
3
)
2
và Cu(NO
3
)
2
C.Fe(NO
3
)
3
B. Fe(NO
3
)
3
và Cu(NO
3
)
2
D. Cu(NO
3
)
2
b) Cho dung dịch HCl vào dung dịch A có hiện tượng gì xảy ra?
A.Không có hiện tượng gì. C. Xuất hiện kết tủa
B. Có khí thóat ra D. Ý kiến khác
Hướng dẫn biện luận:
a)
- Vì dung dịch thu được có màu xanh chứng tỏ có ion Cu
2+
và Fe hết.
- Thu được chất rắn C chứng tỏ Cu còn dư.
→ HNO
3
hết và muối thu được trong dung dịch là : Fe(NO
3
)
2
và Cu(NO
3
)
2
Đáp án A.
b)
4
- Dung dịch A chứa các ion sau: Fe
2+
, Cu
2+
,
-
3
NO .
- Khi cho dung dịch HCl thì xảy ra phản ứng sau:
2+ + - 3+
3 2
3Fe +4H +NO 3Fe +NO +2H O
Như vậy hiện tượng xảy ra : Có khí thoát ra . Đáp án B
Câu 6: Hòa tan hoàn toàn 1,84 gam hổn hợp Fe và Cu trong đung ịch H
2
SO
4
(
đặc, nóng, dư) thu được 1,568 lít SO
2
(đktc) và dung dịch A. Cô cạn cẩn thận
dung dịch A thu được m gam muối khan. Giá trị của m là?
A. 5,86 (g) B 15,28(g) C. 8,56(g) D. 12, 58(g)
Hướng dẫn giải: Dựa trên phản ứng của kim loại M :
2 4 2 4 n 2 2
2M+2nH SO M (SO ) +n SO +H O
Ta có :
2-
2
4
SO
SO (taomuoi)
1,568
n = n = =0,07(mol)
22,4
Suy ra : m
muối khan
= m
kim loại
+
2-
4
SO
m
= 1,84 + 0,07.96 = 8,56 (g). Đáp án C
Câu 7: Cho hổn hợp gốm 3 kim loại Cr, Fe, Cu có khối lượng là 3,96 gam tác
dụng với dung dịch HCl ( loãng, nóng, dư) thu được 1,344 (lít) H
2
(đktc); 0,64
gam chất rắn và dung dịch B. Cô cạn dung dịch B thu được m gam muối khan.
Giá trị của m là :
A. 5,78(g) B. 7,58(g) C. 7,85(g) D. 8,75(g)
Hướng dẫn giải:
Theo bài ra : m
rắn
= m
Cu
→ m
Cr
+ m
Fe
= 3,96 – 0,64 = 3,32(g)
PTPƯ :
2 2
M+2HCl MCl +H
2
H HCl
1,344 1
n = =0,06(mol)= n
22,4 2
→ n
HCl
= 0,12 (mol) →
-
Cl
n
= 1,12 ( mol)
Vậy m
muối khan
= m
Cr
+ m
Fe
+
-
Cl
m
= 3,32 + 0,12.35,5 = 7,58 (g). Đáp án B
Câu 8: Hòa tan hoàn toàn một lượng bột sắt vào dung dịch HNO
3
loãng thu được
hổn hợp khí gồm 0,015 mol N
2
O và 0,01 mol NO. Khối lượng Fe đã hòa tan là :
A. 2,8(g) B. 8,2(g) C. 1,68(g) D. 6,18 (g)
5
Hướng dẫn giải:
Ta có các QT cho nhận electron:
3+
+5 +1
+5 +2
Fe Fe +3e
N +4e N
N +3e N
Áp dung định luật bảo tòan e ta có :
+ +2
2
Fe
N N
Fe N O NO
3.n =4.n +3.n
3.n =4.2.n +3.n =8.0,015+3.0,01
→ n
Fe
= 0,05 (mol) →m
Fe
= 2,8 (gam). Đáp án A
Câu 9: Để m gam Fe trong không khi 1 thời gian thu đ ược 12 gam hổn hợp X
gồm Fe và các oxit sắt; Cho X tác dụng với dung dịch H
2
SO
4
( đặc, nóng, dư) thu
được 0,15 mol SO
2
. Tính m = ?(g)
A. 9,756 B. 7,695 C. 7,956 D. 6,975
Hướng dẫn giải :
Ta có QT phản ứng:
2 2 4
x y
O H SO (dac,nóng,du)
Fe 3+
Fe O 2
Fe Fe +SO
QT cho và nhận electron
3+
-2
2
+6 +4
Fe Fe +3e
O +4e 2O
S +2e S
Áp dụng định luật bảo toàn electron ta có:
6
2 2
Fe O SO
Fe
Fe
Fe
3.n =4.n +2.n
12-m
3.n = .4 +0,15.2
32
m 12-m
3. = .4 +0,15.2
56 32
m =7,956(g)
Đáp án C
Câu 10: Chia hổn hợp kim loại có hóa tri không đối thành 2 phần bằng nhau:
+) Phần 1: Bị oxi hóa hoàn toàn trong không khí thu được 2,84 gam oxit.
+) Phần 2: Tan hết trong dung dịch HCl tạo ra 1,792 lít H
2
(đktc)
Khối lượng hổn hợp của 2 kim loại :
A. 2,4(g) B. 2,2(g) B. 1,8(g) D. 3,12 (g)
Hướng dẫn giải : Ta có số mol điện tích của 2 kim loại trong hai phần là không
thay đổi, như vậy số mol điện tích âm trong 2 phân là như nhau.
Vì vậy
2- -
1O 2Cl → n
O( trong oxit)
=
-
Cl
1
n
2
( trong muối) =
2
H
n
=
1,792
0,08
22.4
( mol)
→ m
kim loại
= m(oxit) – m(Oxi) = 2.84 -0,08.16 =1,56(g) → m
hh
=3,12(g).
-
Cl
0,71
n = =0,02(mol)
35,5
Đáp án D
Câu 11: Hòa tan hòa toàn 5 (g) h ổn hợp 2 kim loại X và Y bằng dung dịch HCl,
thu được dung dịch A và khí H
2
( đktc). Cô cạn dung dịch A thu được 5,71(g)
muối khan. Thể tích H
2
thú được:
A. 22,4(l) B. 0,224(l) C. 1,112 (l) D. 0,448(l)
Hướng dẫn giải:
Ta có : m
muối
= m
kim loại
+ m
gốc axit
m
gốc axit
= 5,71 – 5 = 0,71 (g)
7
-
H
Cl
0,71
n = =0,02(mol) n =0,02(mol)
35,5
Vậy nH
2
= 0,01 mol
2
H
V =0,01.22,4=0,224(l)
. Đáp án B
Câu 12: Đốt cháy một lượng sắt đã dùng hết 2,24 (l) O
2
(đktc) thu đựơc hổn
hợp A gồm các oxit sắt và sắt dư. Khử hoàn toàn A bằng CO dư, khí đi ra sau
phản ứng dẫn vào bình đựng nước vôi trong. Khối lượng kết tủa thu được:
A. 10(g) B.20(g) C.30(g) D.40(g)
Hướng dẫn giải:
Ta có : n
O
đã dùng = n
CO
=
2 3
CO CaCO ¯
n =n =0,2(mol)
3
CaCO
m =0,2.100=20(g)
. Đáp án B
Câu 13: Hòa tan hoàn toàn 4,2(g) hổn hợp Fe và Zn tác dụng hết với dung dịch
HCl thấy thóat ra 2,24 (l) H
2
(đktc). Khối lượng muối tạo thành:
A. 12(g) B. 12,5(g) C. 11,3(g) D.13,1(g)
Hướng dẫn giải:
Ta có:
2
H HCl HCl
2,24
1
n = =0,1(mol)= .n n =0,2(mol)
2
22,4
- -
Cl Cl
n =0,2(mol) m =0,2.35,5=7,1(g)
Vậy m
muối
= m
kim loại
+ m
gốc axit
= 4,2 + 7,1 = 11,3)g). Đáp án C
Câu 14: Hòa tan hoàn toàn 8 (g) hổn hợp gồm Cr và Fe trong dung dịch HCl thu
được 3,36 (l) H
2
(đktc) và dung dịch D. Để kết tủa hòan tòan các ion trong D cần
300 ml đung dịch NaOH 1M. Thể tích HCl đã dùng :
A. 0,12(l) B. 0,15(l) C. 0,3(l) D.0,2(l)
Hướng dẫn giải :
Ta có : n
NaOH
cho vào = 0,3 mol.
Khi cho 0,3 mol NaOH vào dung d ịch chứa Cr
2+
, Fe
2+
, H
+
( giải sử dư), để tạo kết
tử, khi đó dung dịch mới thu được chứa iopn Cl
-
và Na
+
. NHư vậy muốn trung
hòa hết 0,3 mol Na
+
cần 0,3 mol Cl
-
.
8
Vậy n
HCl
= 0,3 (mol ) V
HCl
= 0,3 : 2 = 0,15 (l) . Đáp án B
Câu 15: Hòa tan hoàn toàn 10,7 (g) h ổn hợp gồm 3 kim loại Al, Fe,, Cr trong
dung dịch HCl thoát ra 6,72 (l) khí H
2
(đktc). Nếu cho 21,4 (g) hổn hợp trên tác
dụng với dung dịch CuSO
4
dư . Lọc lấy toàn bộ chất rắn thu được sau phản ứng
tác dụng với dung dịch HNO
3
nóng, dư thu được V lít khí NO
2
(đktc). Giái trị của
V là:
A. 13,44(l) B. 14,34(l) C.14,43(l) D.0,15(l)
Hướng dẫn giải: Ta có
số mol e mà Al, Cr, Fe nhường = n
Cu
nhường khi tham
gia phản ứng với HNO
3
. Số mol e H
+
nhận = số mol e HNO
3
nhận.
+
2
2H +2e H
6,72
0,6(mol) 0,3(mol)
22,4
10,7(g) hổn hợp 3 kim loại + HCl , có số e mà H
+
nhận = 0,3 (mol)
Vậy: 21,4 (g) hổn hợp 3 kim loại + HCl, có số e mà H
+
nhận = 0,6(mol)
2
+5 +4
2
NO
N +1e N (NO )
0,6(mol) 0,6(mol) V 13,44( )l
. Đáp án A
Câu 16: Hòa tan hoàn toàn 43,2(g) kim loại Cu vào dung dịch HNO
3 loãng
tất cả
các khí NO sinh ra đem oxi hóa thành NO
2
rồi sục vào nước có dòng oxi để
chuyrn hết thành HNO
3
. Thể tích khí Oxi đã tham gia vào quá trình trên :
A. 6,72(l) B. 7,56(l) C. 8,96(l) D. 5,04 (l)
Hướng dẫn giải:
Ta nhận thấy trong quá trình phản ứng : Cu nhường e cho HNO
3
tạo thành NO;
sau đó NO lại nhường e cho O
2
. Vậy trong quá trình phản ứng Cu là chất nhường
e còn O
2
là chất nhận e:
+2
-2
2
Cu Cu +2e
0,675 0,135
O +4e 2O
x 4x
9
Ta có: 4.x = 1,35, vậy x = 0,3375(mol) VO
2
= 7,56(l). Đáp án B
Câu 17 : Cho 2 TN sau :
+) TN1 : Cho 3,84 g Cu phản ứng với 80ml dung dịch HNO
3
1M thóat ra
V
1
lít NO
+) TN2 : Cho Cho 3,84 g Cu phản ứng với 80ml dung dịch HNO
3
1M và
H
2
SO
4
0,5 M thóat ra V
2
(l) NO.
Biết NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điềukiện. Quan hẹ
giữa V
1
và V
2
:
A. V
1
=V
2
B.V
2
=2.V
1
C. V
2
=2,5.V
1
D. V
2
=1,5.V
1
Hướng dẫn giải :
+) Ở TN 1 :
Ta có : n
Cu
= 3,84 : 64 = 0,06 (mol)
+
H
3 -
NO
3
n =0,08(mol)
HNO n =0,08(mol)
n =0,08(mol)
PT ion :
+ - 2+
3 2
3Cu+8H +2NO 3Cu +2NO 4H O
Đầu bài : 0,06 0,08 0,08
Pứ : 0,03 0,08
Số mol H
+
phản ứng hết .
Số mol NO sinh ra =
+
H
1
n =0,02(mol)
4
. Vậy V
1
= 0,02.22,4 = 0,448 (l)
+) Ở TN2:
HNO
3
+
H SO
2 4 H
Cu -
NO
3
Cu
n =0,08(mol)
n =0,08+0,04.2=0,16(mol)
n =0,08(mol)
n = 0,06(mol) n =0,08(mol)
n =0,06(mol)
PT ion :
+ - 2+
3 2
3Cu+8H +2NO 3Cu +2NO 4H O
Đầu bài : 0,06 0,18 0,08 ( Cu và H
+
hết)