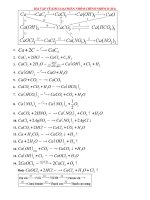Tài liệu Kim loại phân nhóm chính nhóm II docx
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (657.8 KB, 28 trang )
PHẦN I :
KIỂM TRA BÀI CŨ
Câu 1 : Viết phương trình biểu diễn
Na
2
CO
3
→ NaHCO
3
→NaOH
→ NaCl →Na → H
2
→ Cu .
12
345
6
Câu 2 : Phân biệt các dung dòch
sau đây bằng 1 thuốc thử :
a. Na
2
CO
3
, K
3
PO
4
và Na
2
SO
4
b. NaCl , KCl , AgNO
3
,và NH
4
NO
3
Câu 3 : Tại sao các dung dòch
NaHCO
3
và Na
2
CO
3
có phản ứng
kiềm ?
Giải thích, viết phương trình phản ứng
minh họa.
KIM LOAẽI PHAN
NHOM CHNH NHOM
II
PHAN II :
Baứi 10 :
I
I
-
-
Vò
Vò
tr
tr
í
í
–
–
ca
ca
á
á
u
u
ta
ta
ï
ï
o
o
1
1
. Vò
. Vò
tr
tr
í
í
nguyên
nguyên
to
to
á
á
Nguyên
Nguyên
to
to
á
á
Be
Be
Mg
Mg
Ca
Ca
Sr
Sr
Ba
Ba
Ra
Ra
Chu
Chu
k
k
ì
ì
2
2
3
3
4
4
5
5
6
6
7
7
So
So
á
á
th
th
ứ
ứ
t
t
ự
ự
Z
Z
4
4
12
12
20
20
38
38
56
56
88
88
Kho
Kho
á
á
i
i
l
l
ư
ư
ơ
ơ
ï
ï
ng
ng
Nguyên
Nguyên
t
t
ử
ử
9
9
24
24
40
40
88
88
137
137
226
226
- Radi là nguyên tố phóng xạ có hạt nhân không bền
- Ca, Sr Ba gọi là kim loại kiềm thổ
2.Ca
2.Ca
á
á
u
u
ta
ta
ï
ï
o
o
nguyên
nguyên
t
t
ử
ử
Co
Co
ù
ù
2 e
2 e
ơ
ơ
û
û
lơ
lơ
ù
ù
p
p
ngoa
ngoa
ø
ø
i
i
cu
cu
ø
ø
ng
ng
,
,
cũng
cũng
la
la
ø
ø
nguyên
nguyên
to
to
á
á
nho
nho
ù
ù
m
m
s,
s,
đ
đ
u
u
û
û
2e.
2e.
Ba
Ba
ù
ù
n
n
k
k
í
í
nh
nh
nguyên
nguyên
t
t
ử
ử
t
t
ư
ư
ơng
ơng
đ
đ
o
o
á
á
i
i
lơ
lơ
ù
ù
n
n
,
,
ch
ch
ỉ
ỉ
nho
nho
û
û
hơn
hơn
kim
kim
loa
loa
ï
ï
i
i
kie
kie
à
à
m.
m.
L
L
ự
ự
c
c
hu
hu
ù
ù
t
t
gi
gi
ư
ư
õa
õa
ha
ha
ï
ï
t
t
nhân
nhân
vơ
vơ
ù
ù
i
i
e
e
ngoa
ngoa
ø
ø
i
i
cu
cu
ø
ø
ng
ng
ye
ye
á
á
u
u
,
,
hơi
hơi
lơ
lơ
ù
ù
n
n
hơn
hơn
kim
kim
loa
loa
ï
ï
i
i
kie
kie
à
à
m
m
cu
cu
ø
ø
ng
ng
chu
chu
k
k
ì
ì
.
.
Ra
Ra
á
á
t
t
dễ
dễ
nh
nh
ư
ư
ơ
ơ
ø
ø
ng
ng
2e
2e
ngoa
ngoa
ø
ø
i
i
cu
cu
ø
ø
ng
ng
nên
nên
cũng
cũng
co
co
ù
ù
t
t
í
í
nh
nh
kh
kh
ử
ử
ma
ma
ï
ï
nh
nh
,
,
ch
ch
ỉ
ỉ
ke
ke
ù
ù
m
m
kim
kim
loa
loa
ï
ï
i
i
kie
kie
à
à
m
m
cu
cu
ø
ø
ng
ng
chu
chu
k
k
ì
ì
:
:
M
M
-
-
2e
2e
→
→
M
M
2+
2+
3
3
. Ca
. Ca
á
á
u
u
ta
ta
ï
ï
o
o
tinh
tinh
the
the
å
å
:
:
¾
¾
Be
Be
va
va
ø
ø
Mg :
Mg :
laêng
laêng
tru
tru
ï
ï
lu
lu
ï
ï
c
c
gia
gia
ù
ù
c
c
ñ
ñ
e
e
à
à
u.
u.
¾
¾
Ca
Ca
va
va
ø
ø
Sr :
Sr :
la
la
ä
ä
p
p
ph
ph
ö
ö
ông
ông
taâm
taâm
die
die
ä
ä
n.
n.
¾
¾
Ba
Ba
va
va
ø
ø
Ra :
Ra :
la
la
ä
ä
p
p
ph
ph
ö
ö
ông
ông
taâm
taâm
kho
kho
á
á
i.
i.
Tinh thể lậpphương tâm khốiBa, Ra
Có 9 ion dương ở đỉnh và ở tâm củakhối.
Tinh
Tinh
th
th
ể
ể
l
l
ậ
ậ
p
p
phương
phương
tâm
tâm
di
di
ệ
ệ
n :
n :
Ca,
Ca,
Sr
Sr
C
C
ó
ó
14 ion
14 ion
dương
dương
,
,
g
g
ồ
ồ
m
m
8
8
ở
ở
đ
đ
ỉ
ỉ
nh
nh
v
v
à
à
6
6
ở
ở
tâm
tâm
c
c
á
á
c
c
m
m
ặ
ặ
t.
t.
Tinh
Tinh
th
th
ể
ể
lăng
lăng
tr
tr
ụ
ụ
l
l
ụ
ụ
c
c
gi
gi
á
á
c
c
đ
đ
ề
ề
u :
u :
Be, Mg
Be, Mg
c
c
ó
ó
17 ion
17 ion
dương
dương
ở
ở
đ
đ
ỉ
ỉ
nh
nh
,
,
ở
ở
tâm
tâm
v
v
à
à
ở
ở
m
m
ặ
ặ
t
t
trung
trung
tr
tr
ự
ự
c
c
II
II
-
-
L
L
ớ
ớ
t
t
ớ
ớ
nh :
nh :
Nguyeõn
Nguyeõn
to
to
ỏ
ỏ
Be
Be
Mg
Mg
Ca
Ca
Sr
Sr
Ba
Ba
Gia
Gia
ỷ
ỷ
i
i
th
th
ớ
ớ
ch
ch
t
t
0
0
no
no
ự
ự
ng
ng
cha
cha
ỷ
ỷ
y
y
128
128
650
650
838
838
768
768
7.4
7.4
t
t
0
0
soõi
soõi
2770
2770
1110
1110
114
114
0
0
1380
1380
1640
1640
Kho
Kho
ỏ
ỏ
i
i
l
l
ử
ử
ụ
ụ
ù
ù
ng
ng
rieõng
rieõng
1.85
1.85
1.74
1.74
2,5
2,5
2.6
2.6
3.5
3.5
ẹ
ẹ
o
o
ọ
ọ
c
c
ửự
ửự
ng
ng
2
2
1
1
1.8
1.8
Lieõn
Lieõn
ke
ke
ỏ
ỏ
t
t
kim
kim
loa
loa
ù
ù
i
i
ye
ye
ỏ
ỏ
u
u
Ma
Ma
ứ
ứ
u
u
ngo
ngo
ù
ù
n
n
l
l
ửỷ
ửỷ
a
a
Khoõng
Khoõng
theo
theo
qui
qui
lua
lua
ọ
ọ
t
t
v
v
ỡ
ỡ
ma
ma
ù
ù
ng
ng
tinh
tinh
the
the
ồ
ồ
kha
kha
ự
ự
c
c
nhau
nhau
III
III
-
-
Ho
Ho
ự
ự
a
a
t
t
ớ
ớ
nh :
nh :
1
1
.Ta
.Ta
ự
ự
c
c
du
du
ù
ù
ng
ng
vụ
vụ
ự
ự
i
i
ủ
ủ
ụn
ụn
cha
cha
ỏ
ỏ
t
t
a.Vụựi Oxi taùo oõxớt
M + O
2
=
MO
1/2
t
0
Mg + O
2
=
Th
ớ d :
MgO
ẵ
t
o
* ụỷ t
0
600
0
C taùo Peoxit
Ba + O
2
=
BaO
2
600
0
C
b.Vô
b.Vô
ù
ù
i
i
Halogen :
Halogen :
Ta
Ta
ï
ï
o
o
muo
muo
á
á
i
i
halogenua
halogenua
M + X
2
=
MX
2
t
0
Thídụ :
Ca + Cl
2
=CaCl
2
t
0
c.Vụựi lửu huyứnh :
Taùo muoỏi sunfua
Thớd :
Ba + S = Ba S
t
0
M + S =
MS
t
0
2.Ta
2.Ta
ù
ù
c
c
du
du
ï
ï
ng
ng
vơ
vơ
ù
ù
i
i
hơ
hơ
ï
ï
p
p
cha
cha
á
á
t :
t :
a.Vơ
a.Vơ
ù
ù
i
i
H
H
2
2
O :
O :
α .Be và Mg :
Chỉ phản ứng ở nhiệt độ cao
Mg + H
2
O =
MgO + H
2
600
0
C
↑
Th
ídụ
:
β. Ca, Sr, Ba ( ôû t
0
thöôøng)
M + H
2
O =
M(OH)
2
+ H
2
2
↑
Ba+ H
2
O = 2
Ba(OH)
2
+ H
2
↑
Th
ídụ :
b.Vô
b.Vô
ù
ù
i
i
ax
ax
í
í
t
t
:
:
α
α
.
.
ax
ax
í
í
t
t
HCl,H
HCl,H
2
2
SO
SO
4
4
loaõng
loaõng
,
,
co
co
ù
ù
kh
kh
í
í
H
H
2
2
↑
↑
bay
bay
ra
ra
:
:
M + H
+
=
2
M
2+
+ H
2
↑
Mg + HCl =
MgCl
2
+ H
2
↑
2
Th
ídụ
:
β
β
.
.
HNO
HNO
3
3
, H
, H
2
2
SO
SO
4
4
ññ
ññ
* HNO
3
, ññ: có khí NO
2
bay ra
Be(NO
3
)
2
+ NO
2
+ H
2
O
Be + HNO
3
ññ =
422
↑
Th
ídụ :
*
*
H
H
2
2
SO
SO
4
4
ññ
ññ
:
:
ta
ta
ï
ï
o
o
tha
tha
ø
ø
nh
nh
kh
kh
í
í
SO
SO
2
2
hoa
hoa
ë
ë
c
c
S
S
hoa
hoa
ë
ë
c
c
H
H
2
2
S
S
Ca + H
2
SO
4
ññ = CaSO
4
+SO
2
+ H
2
O
2
↑
2
Th
ídụ :
* HNO
* HNO
3
3
l
l
oaõng :
oaõng :
c
c
ó
ó
kh
kh
í
í
NO bay
NO bay
ra
ra
Mg+ HNO
3
loaõng =
Mg(NO
3
)
2
+ NO + H
2
O
3
2
4
K
3
8
Th
ídụ :
c.Vô
c.Vô
ù
ù
i
i
Bazô :
Bazô :
Ch
Ch
æ
æ
co
co
ù
ù
Beri
Beri
co
co
ù
ù
t
t
í
í
nh
nh
l
l
ö
ö
ôõng
ôõng
t
t
í
í
nh
nh
mô
mô
ù
ù
i
i
ta
ta
ù
ù
c
c
du
du
ï
ï
ng
ng
vô
vô
ù
ù
i
i
Bazô
Bazô
NaOH + Be =
Na
2
BeO
2
+ H
2
↑
2
Natri berilat
d.Với dung dòch muối
α. Be và Mg tạo ra kim loại
Mg + CuSO
4
=
MgSO
4
+Cu
β.Ca, Sr, Ba: tạo ra khí H
2
và hidrôxít
kim loại
Ca + FeCl
2
+ H
2
O =2 Fe(OH)
2
+ CaCl
2
+H
2
↓
↑
Mg+ NH
4
Cl → không phản ứng
Th
ídụ :
Th
ídụ :
IV- Ñieàu cheá :
MX
2
=
M + X
2
ñpnc
ñpnc
Th
ídụ :
CaCl
2
=
Ca + Cl
2
PHAN III :
I. Về TR
I. Về TR
CA
CA
U TA
U TA
ẽ
ẽ
O :
O :
1
1
.
.
V
V
tr
tr
ớ
ớ
Nguyeõn
Nguyeõn
t
t
.
.
2.
2.
Ca
Ca
ỏ
ỏ
u
u
ta
ta
ù
ù
o
o
nguyeõn
nguyeõn
t
t
ửỷ
ửỷ
.
.
3.
3.
Ca
Ca
ỏ
ỏ
u
u
ta
ta
ù
ù
o
o
tinh
tinh
the
the
ồ
ồ
.
.
CUNG C BI
V - Ứng dụng
9 Beri tạo ra hợp kim cứng, đàn hồi,
làm vỏ máy bay, tàu biển.
9 Mg tạo ra hợp kim nhẹ, bền, chế tạo
máy bay, tên lửa.
9 Cr làm chất khử để tách kim loại, tách
oxi, S.