ứng dụng phương pháp phân tích nhanh rapid'l.mono để phát hiện listeria monocytogenes trong thực phẩm thủy sản
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.28 MB, 50 trang )
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 1
Phần 1: ĐẶT VẤN ĐỀ
1.1. Giới thiệu
Listeria monocytogenes có khả năng gây bệnh listeriosis với các triệu
chứng như sảy thai, thai chết lưu và đẻ non, gây nhiễm trùng máu và viêm
màng não đối với trẻ em và những người có hệ miễn dịch kém. Vì vậy Listeria
monocytogenes là một chỉ tiêu được kiểm soát trong quản lý chất lượng thực
phẩm.
Các phương pháp truyền thống ví dụ như ISO 11290-1:2004 hay BAM
– FDA (chương 10) phát hiện Listeria monocytogenes trong thực phẩm bao
gồm các bước tăng sinh, phân lập trên môi trường chọn lọc và thử nghiệm hóa
sinh để định danh. Quá trình này thường kéo dài từ bốn ngày cho trường hợp
âm tính và trên bảy ngày cho các trường hợp dương tính. Đây thật sự là một
trở ngại cho việc đánh giá chất lượng nói chung và phân tích vi khuẩn gây
bệnh trong sản phẩm thực phẩm vì thời gian chờ trả kết quả quá dài.
Trong những năm qua, nhiều phương pháp phát hiện Listeria
monocytogenes dựa trên nguyên tắc sinh học phân tử và miễn dịch học như
phương pháp lai phân tử, PCR, ELISA, … đã được triển khai. Trong đó nhiều
phương pháp đã được thiết kế theo hướng cho kết quả phân tích nhanh. Vì vậy
việc ứng dụng phương pháp phân tích nhanh vào kiểm nghiệm thực phẩm là
vấn đề được nhiều phòng thí nghiệm quan tâm. RAPID’L.mono là phương
pháp mới khắc phục được các nhược điểm của phương pháp truyền thống nhờ
khả năng phát hiện nhanh, dễ thực hiện, đọc kết quả phân tích dễ dàng, cho kết
quả cùng lúc về Listeria monocytogenes và các loài khác thuộc Listeria spp
trên cùng một đĩa môi trường chọn lọc. Vì những lý do đó chúng tôi tiến hành
nghiên cứu “ứng dụng phương pháp phân tích nhanh RAPID’L.mono để
phát hiện Listeria monocytogenes trong thực phẩm thủy sản”.
1.2. Mục tiêu của đề tài
Xác định độ tương đồng của phương pháp phân tích nhanh RAPID’L.
mono so với phương pháp phân tích Listeria monocytogenes theo tiêu chuẩn
ISO 11290-1:2004 thông qua các chỉ tiêu thí nghiệm:
- Độ đặc hiệu
- Độ nhạy
- Độ lặp lại
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 2
1.3. Nội dung nghiên cứu
Để thực hiện đề tài chúng tôi dự kiến các nội dung nghiên cứu sau:
1. Xác định độ đặc hiệu của phương pháp phân tích nhanh
RAPID’L.mono bằng cách thử nghiệm trên mẫu gây nhiễm Listeria
monocytogenes và mẫu gây nhiễm vi sinh vật khác. Trên cơ sở xác định
khuẩn lạc điển hình, thử nghiệm sinh hóa điển hình (nếu có) của
Listeria monocytogenes.
2. Xác định độ nhạy (giới hạn pháp hiện – LOD) của phương pháp thông
qua phân tích dãy nồng độ pha loãng chủng Listeria monocytogenes để
tìm nồng độ thấp nhất mà phương pháp có khả năng phát hiện.
3. Xác định độ lặp lại của phương pháp bằng cách phân tích mẫu thực
phẩm thủy sản nhiễm Listeria monocytogenes hay mẫu thực phẩm gây
nhiễm Listeria monocytogenes nhằm đánh giá sự ổn định của phương
pháp phân tích trong cùng điều kiện thí nghiệm.
4. Phân tích song song mẫu sản phẩm thủy sản nhiễm Listeria
monocytogenes bằng cả hai phương pháp: RAPID’L.mono và ISO
11290-1:2004. Kết hợp kết quả thu được từ Mục 1 – 3 để đánh giá mức
độ tương đồng của phương pháp RAPID’L.mono so với phương pháp
chuẩn ISO 11290-1:2004.
1.4. Thời gian thực hiện đề tài
Tháng 01/2009 đến 05/2009
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 3
Phần 2: TỔNG QUAN TÀI LIỆU
2.1. Giới thiệu về Listeria monocytogenes
2.1.1. Phân loại học
Theo khóa phân loại của Bergey’s (tái bản lần thứ 7), giống Listeria
được xếp vào họ Corynebacteriaceae. Tuy nhiên theo nghiên cứu của
Stackebrandt và cộng sự (1983) về rRNA 16S, ông đã chứng minh rằng
Listeria monocytogenes hoàn toàn khác biệt trong nhánh Lactobacillus-
Bacillus thuộc cây phát sinh loại vi khuẩn do Woese xây dựng năm 1981. Năm
2001, Họ listeriaceae đã được tạo ra, bao gồm cả Staphylococcaceae,
Bacillaceae và các họ khác. Trong phạm vi cây phát sinh loại này có sáu loại
thuộc loại Listeria: L. monocytogenes, L. seeligeri, L. welshimeri, L. ivanovii
L.innocua và L. grayi. Loại L. grayi có hai loài phụ là L.grayigrayi và L.
grayimurrayi.
2.1.2. Hình thái học
Listeria monocytogenes là vi khuẩn hình que, gram dương, di động nhờ
tiêm mao, không sinh bào tử và đôi khi chúng tạo thành hình chuỗi ngắn. Khi
kiểm tra kính phết, vi khuẩn này có dạng hình cầu, vì vậy thường lầm tưởng
chúng là vi khuẩn Streptococci. Đôi khi xuất hiện những tế bào dài hơn có thể
trông giống corynebacteria. Ở nhiệt độ phòng (không lớn 37
0
C) vi khuẩn này
có khả năng tạo tiêm mao (flagella), di động theo thể thức lộn nhào và tạo hình
tán dù trong môi trường motility agar. Hoạt tính tiêu huyết (heamolysis) trên
môi trường thạch máu được dùng làm chỉ dấu để phân biệt Listeria
monocytogenes trong số các loài khác thuộc giống Listeria, nhưng đây không
phải là tiêu chí để xác định loài này.
Để phân biệt các loại thuộc Listeria cần thêm các đặc tính sinh hóa
được thể hiện ở Bảng 2.1.
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 4
Bảng 2.1: Đặc điểm khác nhau của các loài thuộc giống Listeria
Ghi chú: Cata: catalase, Henry: Henry illumination, Man: manitol,
Rham: Rhamnose, Xyl: Xylose.
2.1.3. Đặc điểm sinh lý
2.1.3.1. Thông số phát triển
Bảng 2.2: Một số thông số cơ bản của Listeria
Thế nước
(a
w
) cực đại
pH tối
thiểu
pH cực
đại
NaCl(%)
cực đại
T
0
C tối
thiểu
T
0
C cực
đại
Nhu cầu oxy
0,92-0,95 4,6 9,6 8-12 0-2 45 Kỵ khí tùy nghi
2.1.3.2. Trong thực phẩm
Listeria monocytogenes có khả năng sống trong nhiều loại thực phẩm
đông lạnh, trong các sản phẩm chưa được gia nhiệt tốt, bề mặt sản phẩm đã bị
tách nước. Sự phát triển của chúng phụ thuộc nhiều vào các yếu tố như nhiệt
độ, pH và các loại thịt cũng như sự hiện diện của quần thể vi sinh vật.
2.1.4. Khả năng chịu đựng
Listeria monocytogenes là vi khuẩn gây bệnh ưa lạnh và có khả năng
phát triển ở nhiệt độ 2 - 8
0
C (nhiệt độ của tủ lạnh), pH tối thiểu là 4,6; chúng
có khả năng sống trong điều kiện kỵ khí, hiếu khí ngay cả môi trường hút chân
không hoặc có sự hiện diện của vi khuẩn lactic.
Loài vi khuẩn này cũng có khả năng sống từ 10 đến 30 ngày trong
nguồn nước công cộng ở nhiệt độ 28- 30
0
C và từ 7 đến 110 ngày ở nhiệt độ 5
đến 10
0
C. Ở nước ao chúng có khả năng sống đến 8 tuần với nhiệt độ không
Các phản ứng phân biệt Listeria spp.
CAMP test
TÊN LOÀI
Cata Gram Di
động
Henry
Man
(a)
Rham Xyl Tan
huyết
S.aureus R.equi
L. monocytogens + + + Xanh - + - + + -
L. innocua + + + Xanh - V - - - -
L. ivanovii + + + Xanh - - + + - +
L. seeligeri + + + Xanh - - + (+) (+) -
L. welshimeri + + + Xanh - V + - - -
L. grayi loài phụ
grayi
+ + + Xanh + - - - - -
L. grayi loài phụ
murrayi
+ + + Xanh + V - - - -
V : phản ứng có thể xảy ra
(+): phản ứng yếu
+ : >90% phản ứng dương tính
-: phản ứng không xảy ra
(a) tham khảo theo USFDA/CFSAN BAM- chương 10.
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 5
khí từ -26
0
C đến 9
0
C. Ở nước biển Listeria monocytogenes có thể sống đến 3
tuần hoặc lâu hơn nữa. Việc tồn tại trong nước biển thì tùy thuộc vào nhiệt độ
và chủng vi khuẩn này.
Trong môi trường chế biến thực phẩm với độ ẩm là 75% và ở 15
0
C, hỗn
hợp vi khuẩn Listeria monocytogenes và Flavobacteria spp. Có thể tồn tại hơn
75 ngày trên bề mặt thép không gỉ. Thời gian để giết chết 90% các tế bào này
là 18,5 ngày.
Vi khuẩn này có khả năng tồn tại trong các sản phẩm thủy sản xông
khói đóng gói chân không được bảo quản ở nhiệt độ từ 4 – 10
0
C, trong nhiều
trường hợp chúng còn gia tăng số lượng tế bào. Ví dụ: trong tôm, thịt cua,
surimi và cá được bảo quản ở nhiệt độ 7
0
C trong vòng 14 ngày, Listeria
monocytogenes gia tăng đến 10.000 tế bào trên một gam sản phẩm. (Nguồn:
Baron’s Medical Microbiology, Miscellaneous Pathogenic Bacteria (H Hof)).
Khả năng chịu nhiệt của Listeria monocytogenes cũng là một yếu tố khá
quan trọng để đánh giá mức độ nguy hiểm của vi sinh vật này đối với an toàn
thực phẩm. Theo cơ quan quản lý thực phẩm và dược phẩm Hoa Kỳ
(USFDA), khả năng kháng nhiệt của loài vi khuẩn này trên các sản phẩm thủy
sản khác nhau thì không giống nhau.
Listeria monocytogenes là điển hình cho vi khuẩn không sinh bào tử có
khả năng kháng khá tốt các tác động có hại như đông lạnh, làm khô và gia
nhiệt.
2.1.5. Phân bố, nguồn lây nhiễm
Mãi đến năm 1960, người ta vẫn còn nghĩ rằng Listeria monocytogenes
hầu như không liên quan đến các bệnh truyền nhiễm ở động vật và ít khi xuất
hiện ở người. Tuy nhiên, trong những năm sau đó, người ta bắt đầu phân lập
được nhiều loài thuộc giống Listeria bao gồm cả các loài gây bệnh như
Listeria monocytogenes và L. ivanovii từ nhiều nguồn khác nhau. Đến nay vi
khuẩn này được công nhận là phân bố rộng rãi trong tự nhiên. Ít nhất có 42
loài động vật có vú hoang dã và thuần dưỡng, 17 loài chim bao gồm thuần
dưỡng và gà chọi là nơi ẩn náo của Listeria. Có khoảng từ 5 – 10% trong số
chúng ta có Listeria monocytogenes hiện diện trong đường ruột nhưng không
biểu hiện bất cứ triệu chứng nào về bệnh do listeria. Listeria cũng được phân
lập từ giáp xác, cá, sò, ve ký sinh và ruồi. Ngoài ra có thể phân lập vi khuẩn
này từ đất, thức ăn động vật và các nguồn khác từ môi trường.
2.1.6. Đặc điểm gây bệnh
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 6
Hiện nay theo quan điểm của Rocourt, L. ivanovii và L. monocytogenes
là đối tượng gây bệnh cho chuột và các động vật khác. Tuy nhiên chỉ có loài L.
monocytogenes là đối tượng gây bệnh cho người. Bệnh do L. ivanovii, và L.
seeligeri thì rất hiếm khi xảy ra ở người.
Thuật ngữ bệnh do listeria (listeriosis) bao gồm nhiều triệu chứng bệnh
giống nhau ở người và động vật. Listeria monocytogenes gây bệnh ở người và
động vật; L.ivanovii chỉ gây bênh ở động vật, chủ yếu ở cừu. Bệnh viêm màng
não là hình thức bệnh thường gặp nhất ở động vật nhai lại. Ở những động vật
còn nhỏ, thường xuất hiện nhiễm trùng nội tạng hoặc nhiễm trùng máu. Nhiễm
trùng cổ tử cung ở bào thai qua đường nhau thường làm cừu và gia súc đẻ non.
Tác động thật sự bệnh do Listeria ở người đến nay vẫn còn chưa sáng
tỏa, vì bình thường đối với người trưởng thành khỏe mạnh, các bệnh truyền
nhiễm thường ít có triệu chứng hoặc có chăng chỉ là triệu chứng cảm nhẹ.
Biểu hiện lâm sàng dao động từ triệu chứng trông giống như là bệnh cảm cúm
nhẹ và/hoặc viêm não và màng não. Bệnh do Listeria hầu hết chỉ xuất hiện ở
phụ nữ mang thai, trẻ sơ sinh, người già và người suy giảm hệ miễm dịch,
nhưng đối với những người khỏe mạnh cũng có thể bị ảnh hưởng. Hình thức
bệnh nghiêm trọng thể hiện rõ ràng nhất là ở bệnh viêm màng não và thường
đi kèm theo nhiễm trùng máu. Tuy nhiên ở phụ nữ mang thai, mặc dù triệu
chứng thường xuất hiện là bệnh giống như cúm nhẹ không bị viêm màng não,
nhưng dễ có khả năng thai nhi bị bệnh và dẫn đến phải phá bỏ hoặc sinh non.
Ở người bệnh do listeria biểu hiện rõ ràng nhất là do L. monocytogenes
thường ít xảy ra, nhưng đã xuất hiện những đợt bùng phát thành dịch. Vào
năm 1981, xuất hiện đợt bùng phát liên quan đến 100 người ở Canada. Ba
phần tư những trường hợp bị nhiễm bệnh là phụ nữ mang thai, trong trường
hợp này có 9 thai nhi bị chết, 23 trẻ sơ sinh bị nhiễm trùng và 2 trẻ còn sống
khỏe mạnh. Trong số 77 người trưởng thành không mang bầu bị nhiễm khuẩn
đã biểu hiện bệnh do listeria một cách rõ ràng, tỷ lệ chết gần 30%. Nguồn
bùng phát là từ xà lách trộn được sản xuất tại một nhà máy tại địa phương.
Các biểu hiện bệnh do Listeria bao gồm nhiễm trùng máu, viêm màng
não, viêm não và nhiễm trùng tử cung hoặc cổ tử cung ở phụ nữ mang thai dẫn
đến khả năng xẩy thai hoặc phá bỏ thai nhi. Khởi đầu các biểu hiện này
thường xuất hiện các triệu chứng tương tự như các bệnh cúm bao gồm sốt kéo
dài. Có thể xuất hiện các triệu chứng rối loạn tiêu hóa như buồn nôn, nôn mữa
và tiêu chảy là những triệu chứng biểu hiện sớm bệnh nghiêm trọng do
Listeria gây ra hoặc có thể là những triệu chứng thoáng qua. Các triệu chứng
này có thể kéo dài hơn 12 giờ.
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 7
2.2. Phương pháp định tính chỉ tiêu Listeria monocytogens trong thực
phẩm
2.2.1. Theo ISO 11290 -1:2004
Phương pháp này (tham chiếu theo ISO 11290-1:2004) được áp dụng
để định tính Listeria monocytogenes trong thực phẩm dành cho người và thức
ăn gia súc.
2.2.1.1. Nguyên lý
Phương pháp này thực hiện qua các giai đoạn:
· Tăng sinh: giai đoạn này là cần thiết vì Listeria monocytogenes thường
có mặt trong mẫu với số lượng nhỏ và dễ bị tổn thương trong quá trình
chế biến cùng sự tồn tại một số lượng các loại vi sinh vật khác, do đó
bước tăng sinh đầu tiên rất quan trọng làm tăng sự phát triển của vi
khuẩn.
· Phân lập: Mục đích của giai đoạn này nhằm phân biệt vi khuẩn Listeria
spp và các vi khuẩn không phải là Listeria spp. Thông qua các đặc
điểm của khuẩn lạc. Do đó, môi trường phân lập có chứa các thành
phần sao cho Listeia spp. có thể sinh trưởng tạo thành các khuẩn lạc rời
rạc đồng thời ức chế sinh trưởng của các vi khuẩn không phải là
Listeria spp. tồn tại được trong giai đoạn tăng sinh. Phân lập trên hai
môi trường chọn lọc ALOA, Oxford (hoặc Palcam).
· Khẳng định: cấy chuyển khuẩn lạc Listeria monocytogenes nghi ngờ
sang thạch không chọn lọc để làm thuần vi khuẩn và thực hiện các thử
nghiệm sinh lý, sinh hóa để định danh. Khẳng định là Listeria spp. bằng
các thử nghiệm Henry-illumination, catalase, nhuộm Gram, khả năng di
động phương pháp giọt treo. Sau khi các thử nghiệm trên đều nghiệm
đúng Listeria spp., kế tiếp khẳng định Listeria monocytogenes qua các
thử nghiệm bổ sung sau: khả năng tan huyết, khả năng biến dưỡng
đường, thử nghiệm CAMP, di động trong ống nghiệm tạo hình tán dù.
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 8
2.2.1.2. Sơ đồ quy trình phân tích theo ISO 11290-1:2004
(II) (I)
Quy trình (I) và (II) thực hiện song song nhau. Nếu quy trình (I) cho kết
quả dương tính thì ngưng không tiếp tục thực hiện quy trình (II), nếu quy trình
(I) cho âm tính thì phải tiếp tục quy trình (II).
Thời gian cho kết quả của phương pháp từ 4- trên 7 ngày.
2.2.1.3. Thuyết minh quy trình phân tích
A. Tăng sinh lần 1: Cân 25gam mẫu cho vào bao PE vô trùng. Thêm
vào 225ml Half Fraser. Đồng nhất mẫu trong khoảng 30-60 giây tùy theo đặc
điểm của mẫu. Ủ dịch mẫu trong tủ ủ ở 30
±
1
0
C trong 24
±
2giờ. Sau bước
tăng sinh lần 1 thực hiện hai quy trình (I), (II).
Ủ 25
0
C, 8-24 giờ (TSYEB)
Ủ 37
0
C, 24 giờ (TSYEA)
A.Tăng sinh lần 1
25 g mẫu + 225ml Half Fraser
B.Tăng sinh lần 2
0,1ml dịch tăng sinh lần 1
+ 10ml Fraser
C. Cấy ria trên ALOA +
Palcam hoặc Oxford
Đồng nhất (30-60 giây)
Ủ 30
0
C, 24 giờ
D. Đọc kết quả trên ALOA, Oxford
E. Chọn khuẩn lạc điển hình cấy sang
TSYEA, TSYEB
C. Cấy ria trên ALOA +
Palcam hoặc Oxford
Ủ 37
0
C, 48 giờ
Ủ 37
0
C, 24-48 giờ
Ủ 37
0
C, 24-48 giờ
F. Khẳng định:
- Henry illumination
- Catalase
- Gram
- Tan huyết
- Khả năng sử dụng đường
Xylose, Rhamnose
- Thử nghiệm CAMP
- Di động
D. Đọc kết quả trên ALOA, Oxford
E. Chọn khuẩn lạc điển hình cấy sang
TSYEA, TSYEB
Ủ 25
0
C, 8-24 giờ (TSYEB)
Ủ 37
0
C, 24 giờ (TSYEA)
F. Khẳng định
G. Đọc kết quả
G. Đọc kết quả
Hình 2.2.1.2: Sơ đồ phân tích Listeria monocytogenes theo ISO 11290-1:2004
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 9
B. Tăng sinh lần 2: Chuyển 0.1ml từ dịch tăng sinh lần 1 sang ống
nghiệm chứa 10ml môi trường Fraser để tăng sinh lần 2. Ủ ống nghiệm trong
tủ ủ ở 37
±
1
0
C trong 24 giờ.
C. Cấy ria trên ALOA, Oxford hoặc Palcam: Dùng que cấy kim loại
hoặc que cấy nhựa vô trùng cấy ria dịch mẫu tăng sinh lần 1 theo quy trình (I)
và dịch mẫu tăng sinh lần 2 theo quy trình (II) sang môi trường thạch ALOA
và Oxford hoặc Palcam sao cho khuẩn lạc mọc rời, ủ trong tủ ủ ở 37
±
1
0
C
trong 24 giờ.
D. Đọc kết quả trên ALOA, Oxford hoặc Palcam. Thường sau 24 giờ ủ
phải kiểm tra. Nếu khuẩn lạc mọc yếu hoặc không có khuẩn lạc nào thì phải ủ
tiếp 48 giờ. Sau khi ủ ghi nhận các khuẩn lạc điển hình trên các loại môi
trường thạch.
E. Chọn khuẩn lạc điển hình cấy sang TSYEA, TSYEB: Chọn khuẩn
lạc nghi ngờ Listeria monocytogenes trên mỗi loại môi trường phân lập dùng
que cấy lấy ½ khuẩn lạc cấy ria trên môi trường TSYEA (ủ ở 37
±
1
0
C trong
18-24
±
2 giờ) và ½ khuẩn lạc còn lại cấy vào TSYEB (ủ ở 25
±
1
0
C trong 18-
24
±
2 giờ).
F. Khẳng định
- Thử nghiệm Henry-illumination
Kiểm tra khuẩn lạc Listeria spp bằng nguồn sáng trắng, kiểm tra khuẩn
lạc theo hướng vuông gốc với đĩa thạch hoặc trực tiếp bằng mắt thường hoặc
qua kính hiển vi phân tích (có gương riêng) hoặc kính hiển vi có độ phân giải
thấp. Nguồn sáng chiếu vào đĩa thạch với góc nghiêng 45
0
, quan sát theo
hướng vuông góc với đĩa thạch.
Trên môi trường TSYEA khuẩn lạc Listeria spp. điển hình qua nguồn
ánh sáng trắng có màu xanh óng ánh (xanh xám đến xanh).
- Thử nghiệm Catalase
+ Thực hiện: Lấy sinh khối ở tâm khuẩn lạc trên môi trường thạch dinh
dưỡng sau 18-24 giờ ủ. Chuyển sinh khối lên miếng lam. Nhỏ lên sinh khối
một giọt H
2
O
2
3% (dùng ống nhỏ giọt hoặc pipette Pasteur). Quan sát nhanh
sự hình thành bọt khí và ghi nhận kết quả. Bỏ miếng lam vào dung dịch khử
trùng.
+ Kết quả: Dương tính khi có hình thành bọt khí (O
2
). Âm tính khi
không có hình thành bọt khí.
- Nhuộm Gram (thử nghiệm KOH)
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 10
Thử nghiệm KOH dùng để phân biệt vi khuẩn gram dương và gram âm:
nhỏ 1-2 giọt KOH 3% lên lam kính, sau đó lấy khuẩn lạc đã được làm thuần từ
TSYEA trộn vào thuốc thử KOH trên lam. Sau khi trộn nếu gặp hiện tượng
đặc quánh kéo thành dây thì dùng khuyên cấy nhích lên là phản ứng dương
tính và ngược lại là phản ứng âm tính.
Vi khuẩn gram (-): thử nghiệm KOH dương tính
Vi khuẩn gram (+): thử nghiệm KOH âm tính
Listeria spp cho phản ứng gram (+)
- Thử tính di động
ü Khả năng di động phương pháp giọt treo: Lấy một khuyên dịch từ
TSYEB đặt lên lamem và quan sát dưới kính hiển vi. Listeria spp là
những tế bào hình que, mảnh, ngắn và thể hiện những chuyển động
xoay quanh trục thân thành từng đợt (luân phiên nghĩ và động) rất đặc
trưng.
ü Thử tính di động trong ống nghiệm: Lấy vi khuẩn đã được làm thuần từ
TSYEA đâm sâu vào thạch của ống nghiệm chứa môi trường Motility
agar. Ủ ở 25
0
C
±
1
0
C trong 48 giờ. Kiểm tra sự phát triển xung quanh
đường cấy đâm sâu. Thử nghiệm là dương tính khi vi sinh vật mọc lan
khỏi đường cấy làm môi trường có màu đỏ cam và tạo hình tán dù.
- Thử nghiệm tan huyết
Dùng que cấy ria lấy sinh khối từ khuẩn lạc trên môi trường làm thuần
TSYEA cấy ria lên đĩa thạch Blood Agar. Ủ đĩa trong tủ ở 37
±
1
0
C trong
24
±
2 giờ.
Kết quả: Listeria monocytogenes cho thấy vùng sáng, trong và hẹp
(dung huyết beta)
- Thử nghiệm sử sụng đường
Dùng que cấy vòng, lấy sinh khối từ môi trường TSYEB cấy lần lược
sang các ống nghiệm chứa khoảng 5ml dung dịch đường Xylose và sang các
ống nghiệm chứa khoảng 5ml dung dịch đường Rhamnose. Ủ các ống trong tủ
ủ ở 37
±
1
0
C trong 24 – 48 giờ.
Kết quả: Dương tính khi dung dịch đường có màu vàng. Âm tính khi
dung dịch đường không đổi màu. Listeria monocytogenes Xylose (-),
Rhamnose (+).
- Thử nghiệm CAMP
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 11
Cấy ria 2 đường chủng vi khuẩn S.aureus và Rhodococcus equi theo
các đường thẳng đứng song song, cách nhau 4 cm trên mặt thạch máu cừu. Sau
đó cấy ria thẳng góc ở giữa các chủng nghi ngờ Listeria monocytogenes đã
được làm thuần từ TSYEA lên thạch máu, gần như không chạm vào 2 đường
cấy S.aureus và Rhodococcus equi khoảng 1-2mm. Cấy đồng thời các chủng
chứng L.monogenes, L.innocua, L.ivanovi để kiểm tra trên cùng một đĩa. Ủ ở
37
0
C
±
1
0
C trong 18- 24h.
Phản ứng dương tính khi xuất hiện vùng cộng hưởng tan huyết phát
triển ngay tại ranh giới giữa chủng cần thử với các chủng R.equi và S.aureus.
Phản ứng CAMP (+) với R.equi sẽ tạo vùng tan huyết rộng 5-10mm và
có hình dạng đầu mũi tên, phản ứng (-) vùng tan huyết yếu và nhỏ (khoảng
1mm). Phản ứng (+) với S.aureus thường tạo vùng tan huyết hẹp (khoảng
2mm) có dạng hình tròn.
Listeria monocytogenes cho phản ứng CAMP (+) với S.aureus và
CAMP (-) với R.equi.
G. Đọc kết quả: Phát hiện hay không phát hiện Listeria monocytogenes
trong 25 gam mẫu.
2.2.2. Phương pháp phân tích nhanh trên RAPID’L.mono theo AOAC
Môi trường RAPID
’
L.mono sản xuất bởi phòng thí nghiệm Bio-Rad
2000 Alfred Nobel Drive Hercules, Ca 94547.
RAPID’L.mono là môi trường được thiết kế đặc hiệu nhằm phát hiện
enjyme phospholipase trong Listeria monocytogense và Listeria monocytogens
không sử dụng Xylose. Sau 24 giờ nuôi cấy, Listeria monocytogenes thể hiện
khuẩn lạc có màu xanh dương không có quầng màu vàng xung quanh. Khuẩn
lạc được thể hiện ở những chủng loài khác của Listeria spp. là màu trắng có
hoặc không có quầng màu vàng xung quanh. Khuẩn lạc của Listeria ivanovii
có màu xanh dương - xanh lá cây có quầng màu vàng xung quanh (Xylose (+))
Các chất hòa tan có tuyển chọn trong môi trường RAPID’L.mono cho phép ức
chế hầu hết các loại vi sinh vật khác.
2.2.2.1. Nguyên lý
RAPID’L.mono là môi trường nuôi cấy cơ bản dựa trên phản ứng chất
tạo sắc.
- Hoạt động của một enzyme đặc hiệu cho phép dò tìm ra Listeria
monocytogenes, chất nền tạo sắc là phospholipase tạo khuẩn lạc có màu xanh.
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 12
- Sự lên men đường cho phép phân biệt các loài Listeria spp. Listeria
monocytogenes âm tính với phản ứng Xylose nên không tạo quầng sáng màu
vàng xung quanh khuẩn lạc.
2.2.2.2. Sơ đồ quy trình phân tích nhanh trên RAPID
’
L.mono theo
AOAC.
2.2.2.3. Thuyết minh quy trình phân tích
A. Tăng sinh: giống như tăng sinh lần 1 của phương pháp định tính chỉ
tiêu Listeria monocytogenes theo ISO 11290-1:2004. Ủ ở 30
0
C trong 24 giờ.
B. Phân lập trên RAPID’L.mono: dùng que cấy nhựa hoặc que cấy kim
loại vô trùng cấy ria dịch mẫu tăng sinh lên môi trường RAPID’L.mono. Ủ ở
37
0
C trong 24-48 giờ.
C. Đọc kết quả trên RAPID’L.mono. Thường sau 24 giờ ủ phải kiểm
tra. Nếu khuẩn lạc mọc yếu hoặc không có khuẩn lạc nào thì phải ủ tiếp 48
giờ. Sau khi ủ ghi nhận các khuẩn lạc điển hình trên RAPID’L.mono.
D. Khẳng định: chọn khuẩn lạc điển hình của Listeria monocytogenes
trên RAPID’L.mono cấy ria lên ALOA, ủ ở 37
0
C trong 24 giờ, hoặc khẳng
định theo phương pháp ISO 11290-1:2004.
E. Đọc kết quả trên ALOA dựa vào màu sắc điển hình của khuẩn lạc.
Kết luận có hay không có Listeria monocytogenes trong 25 gam mẫu.
C. Đọc kết quả trên RAPID’L.mono
D. Chọn khuẩn lạc điển hình khẳng định bằng cách cấy
ria lên ALOA.
37
0
C trong 24h
A. Tăng sinh
25g mẫu + 225ml Half Fraser
B. Phân lập trên RAPID
’
L.mono
Đồng nhất
30
0
C trong 24h
Hình 2.2.2: Sơ đồ quy trình phân tích nhanh trên RAPID
’
L.mono theo AOAC.
E. Đọc kết quả
37
0
C trong 24h
C. Đọc kết quả trên RAPID’L.mono
D. Chọn khuẩn lạc điển hình khẳng định bằng cách cấy
ria lên ALOA.
Ủ 37
0
C, 24 giờ
A. Tăng sinh
25g mẫu + 225ml Half Fraser
B. Phân lập trên RAPID
’
L.mono
Đồng nhất (30-60 giây)
Ủ 30
0
C, 24 giờ
Hình 2.2.2: Sơ đồ phân tích nhanh Listeria monocytogenes trên RAPID
’
L.mono
E. Đọc kết quả
Ủ 37
0
C, 24 giờ
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 13
2.3. Một số môi trường chính.
2.3.1. Môi trường Half Fraser Broth (HF)
a) Fraser Listeria Base Broth (Merck, 1.10398.0500)
Thành phần môi trường (gam/lít)
- Proteose peptone 5,0
- Peptone from casein 5,0
- Yeast extract 5,0
- Meat extract 5,0
- Sodium chloride 20,0
- Di-Sodium hydrogen phosphate 9,6
- Potassium dihydrogen phosphate 1,35
- Esculin 1,0
- Lithium chlorite 3,0
b) Supplement selective ( Merck, 1.10399/2)
Thành phần môi trường
- Sodium salt of nalidixic acid
- Sodium hydroxide
- Acriflavine hydrochloride solution
c) Ammonium Iron (III) citrate (Merck,1.10399/1)
Cách pha chế môi trường Half Fraser (HF)
Cân 55gam Fraser Listeria Base Broth cho 1000ml nước cất. Khuấy
đảo cho môi trường tan đều. Sau đó hấp thanh trùng ở 121
0
C trong 15 phút.
Trong lúc chờ thanh trùng môi trường tiến hành tan rã thành phần của một lọ
nhỏ ammonium iron (III) citrate và một lọ nhỏ supplement selective trong 1ml
nước vô trùng, cho hai lọ nhỏ trên vào môi trường Fraser Listeria Base Broth
vừa thanh trùng sau khi đã được làm nguội dưới 50
0
C.
2.3.2. Môi trường Fraser Borth
Môi trường Fraser chứa các thành phần chọn lọc như ở tăng sinh lần 1
nhưng với hàm lượng cao hơn.
Thành phần môi trường: Half Fraser Broth cộng thêm một lọ nhỏ
Supplement selective (b)
2.3.3. Thạch ALOA
a) Listeria selective Agar Base acc OTTAVIANI and AGOSTI
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 14
Thành phần môi trường (gam/lít)
- Peptone from meat 18.0
- Peptone from Casein 6.0
- Yeast extract 10.0
- Sodium pyruvate 2.0
- Glucose 2.0
- Magnesium Glycerophosphate 1.0
- Magnesium sulphate 0.5
- Sodium chloride 5.0
- Lithium chloride 10.0
- Disodium hydrogen phosphate 25
- 5-bromo-4chlo-3-Inolyl-B-D-glycopyranosid 0,05
- Agar-Agar 13,0
b) A.L. Supplement 1 (Bio-Rad,356-4039)
Thành phần môi trường
- Polymixin B
- Caftazidime
c) A.L. Supplement 2 (Bio-Rad, 356-4040)
Thành phần môi trường
- Nalidixic acid
- Cychloheximide
- Phosphatidylinositol
Cách pha chế thạch ALOA
Cân 35 gam Listeria selective Agar Base acc OTTAVIANI and
AGOSTI vào 476 ml nước cất vô trùng sau đó làm tan bằng Microwave. Sau
đó ủ ở bể điều nhiệt ở nhiệt độ 45-50
0
C. Bổ sung thêm 1 chai A.L. supplement
1 và 1 chai A.L. supplement 2. Lắc nhẹ và tiến hành đổ đĩa ngay. Sau đó sấy
khô bề mặt đĩa ở nhiệt độ (37-44
0
C)
A.L. Supplement 1: dạng chai nhỏ dạng bột: hút 4ml dung dịch
cồn/nước = 1:1 vào Supplement 1 hòa tan.
A.L. Supplement 2 dạng trai lớn dung dịch chứa 20ml.
2.3.4. Thạch Oxford
a) Oxford Listeria selective Agar (base) (Merck,1.07004.0500)
Thành phần môi trường (gam/lít)
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 15
- Peptone 23.0
- Starch 1.0
- Sodium chloride 5.0
- Agar-agar 13.0
- Aesculin 1.0
- Ammonium-iron (III) citrate 0.5
- Lithium chloride 15.0
b) Oxford Listeria Selective Supplement (Merck, 1.07006)
Thành phần môi trường
- Cycloheximide
- Colistin sulfate
- Acriflavine hydrochloride
- Cefotetan
- Fosfomycin
- Ethanol
- Pha thạch Oxford
Cân 29,25 gam Oxford Listeria selective Agar (base) cho vào 500ml
nước cất, hòa tan sau đó đem thanh trùng ở 121
0
C trong 15 phút. Ủ ở bể điều
nhiệt ở nhiệt độ 45-50
0
C. Sau đó bổ sung 5 ml Oxford Listeria Selective
Supplement vào môi trường. Lắc đều và tiến hành đổ đĩa khoảng 15-20ml/đĩa.
Oxford Listeria Selective Supplement: chứa trong chai nhỏ dạng bột
phải hòa tan bằng dung dịch cồn/nước= 1:1.
2.3.5. Môi trường không chọn lọc TSYEA, TSYEB
a) Trytone soya broth (Merck, 1.5459.0500)
Thành phần (gam/lít)
- Peptone from casein 17.0
- Peptone from Soymeal 3.0
- D(+) Glucose 2.5
- Sodium chloride 5.0
- Di- potasodium hydrogen phosphate 2.5
b) Yeast extract (Merck, 1.03753.0500)
c) Agar (Merck, 1.01614.1000)
Cách pha chế
- TSYEA: Cân 30gam/lít Trytone soya broth, 6gam/lít Yeast extract,
15gam/lít Agar, 1000ml nước. Hòa tan hỗn hộp trên. Chỉnh pH hỗn hợp
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 16
dung dịch 7,3
±
0,2. Sau đó hấp thanh trùng ở 121
0
C trong 15 phút, sau
thanh trùng làm nguội ở bể điều nhiệt (45-50
0
C). Đỗ đĩa. Chú ý đổ một
lớp thật mỏng để xem Henry illumination.
- TSYEB: Cân 30gam/lít Trytone soya broth, 6gam/lít Yeast extract,
1000ml nước. Hòa tan hỗn hộp trên. Chỉnh pH hỗn hợp dung dịch
7,3
±
0,2, sau đó tiến hành đỗ vào ống nghiệm khoảng 3ml/ống. Hấp
thanh trùng ở 121
0
C trong 15 phút.
2.3.6. Rhramnose, Xylose.
Môi trường sử dụng Purple Broth làm nền. Sau đó bổ sung đường
Rhramnose, Xylose.
a) Purple Broth Base (BBL
TM
, 211558)
Thành phần môi trường
- Pancreactic Digest of Gelatin 10.0gam
- Sodium chloride 5.0gam
- Bromcresol purple 0.02gam
b) Đường D(+)(-) Xylose (Merck, 1.08689.0100)
c) Đường L(+)- Rhramnose monohydrate (Merck, 1.07361.0025)
Cách Pha chế môi trường
Cân 15gam/lít Purple Broth Base thêm vào 1000ml nước cất, khuấy tan
dung dịch, chỉnh pH 6,8
±
0,2. Sau đó đem thanh trùng ở nhiệt độ 118
0
C trong
15 phút. Làm nguội ta có chất nền purple Broth. Sau đó bổ sung đường
Rhramnoes hoặc xylose bằng cách dùng nền purple broth hòa tan đường sau
đó lọc qua màng lọc và cho vào nền purple broth. Phân ống 5ml/ống.
2.3.7. Môi trường thạch máu (Blood agar)
Tryptic Soy Agar (TSA) (Merck, 1.05458.0500)
Thành phần môi trường
- Casein peptone
- Soymeal pepton
- Agar
Pha môi trường thạch máu: Cân 40gam/lít TSA, làm tan đều và chỉnh
pH 7,3
±
0,2. Thanh trùng ở 121
0
C trong 15 phút, làm nguội ở bể điều nhiệt
45-47
0
C. Sau đó bổ sung 5->7ml máu thỏ hoặc bò vào 100ml chai TSA đã làm
nguội ở bể điều nhiệt. Đổ đĩa 10-15ml/đĩa.
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 17
2.3.8. Motility Agar
Thành phần môi trường
- Casein peptone
- Meat peptone
- Agar
- Nước
Pha môi trường Motility agar: Cân 22gam/lít motility agar, bổ sung
0.05gam TTC (2,3,5-Triphenyl Tetrazodium Chloride) chỉnh pH 7,3
±
0,2.
Làm tan dung dich bằng Microwave. Phân ống (5-7ml/ống). Sau đó hấp thanh
trùng ở nhiệt độ 121
0
C trong 15 phút.
2.3.9. Môi trường lỏng BHI (Brain Heart Infusion)
Cân 37gam/lít Brain Heart Infusion hòa tan chỉnh pH 7,4
±
0,2. Phân
ống (5ml/ống). Sau đó hấp thanh trùng ở 121
0
C trong 15 phút.
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 18
Phần 3: VẬT LIỆU VÀ PHƯƠNG PHÁP THÍ NGHIỆM
3.1. Vật liệu
3.1.1. Mẫu thực phẩm
Mẫu thực phẩm sử dụng trong nghiên cứu được lấy từ các công đoạn
trong quy trình chế cá tra fillet đông lạnh tại nhà máy chế biến thủy sản.
3.1.2. Môi trường, hóa chất
-Canh thang Fraser Listeria selection Enrichment Broth (Merck 1.
10398.500)
-Canh thang Fraser Listeria selection Enrichment Supplement (Merck
1. 10399.0001/2)
-Thạch ALOA (Agar Listeria according to Ottaisani and Agosti (Biorad
356-4038)
-AL supplement 1 (Biorad 356-4039)
-AL supplement 1 (Biorad 356-4040)
-Palcam Listeria selection agar (Merck VM 1.07004)
-Palcam Listeria selection supplement (Merck VM 1.12122)
-Oxford Listeria selective agar (Merck 1.07004)
-Oxford Listeria selective supplement (Merck 1.07006)
-Purple carbonhydrate Broth (Difco 217510 hoặc Merck 1.07361)
-Xylose (BDH 305905B)
-Tripptose Soya Broth (Merck 1.05459)
-Yeast extract (Difco 212750)
-Agar (Difco 214010)
-Motility agar
-Thuốc thử H
2
O
2
30%
-Thuốc thử KOH 3% hoặc bộ thuốc nhuộm gram
-Thạch Blood Agar (Merck 1.10328)
-Máu cừu, máu bò.
-Đĩa thạch RAPID’L.mono
3.1.3. Thiết bị và vật dụng
-Bể điều nhiệt 45,0
±
1,0
0
C
-Tủ ấm: 25,0
±
1,0
0
C, 30,0
±
1,0
0
C 37,0
±
1,0
0
C
-Thiết bị đồng nhất mẫu
- Kính hiển vi
Và một số vật dụng khác dùng trong phòng thí nghiệm vi sinh
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 19
3.1.4. Lấy mẫu
Mẫu phải đại diện cho sản phẩm không bị hư hỏng và không bị thay đổi
trong suốt quá trình vận chuyển và bảo quản.
3.2. Phương pháp thí nghiệm
3.2.1. Thí nghiệm 1: Xác định độ đặc hiệu của phương pháp phân tích
nhanh định tính chỉ tiêu Listeria monocytogenes trên RAPID’L.mono.
a) Mục đích
Xác định độ đặc hiệu của phương pháp phân tích nhanh
RAPID’L.mono với vi khuẩn Listeria monocytogenes và các chủng vi sinh vật
khác không phải Listeria monocytogenes bằng phương pháp phân tích nhanh
RAPID’L.mono. Phân tích trên nền mẫu cá tra nhiễm Listeria monocytogenes
và các chủng vi sinh vật khác để khẳng định tính đặc hiệu của môi trường
RAPID’L.mono.
b) Sơ đồ thí nghiệm
Thí nghiệm được bố trí một cách ngẫu nhiên, nhân tố thay đổi là các
chủng loại vi sinh vật. Thí nghiệm được lặp lại 10 lần. Thí nghiệm được tiến
hành theo sơ đồ sau đây:
A
1
A
2
A
3
A
4
A
5
A
6
A.
Tăng sinh trong BHI
Ủ 37
0
C, 8 giờ
C. Đọc kết quả trên RAPID’L.mono
D. Chọn khuẩn lạc điển hình khẳng định bằng cách cấy ria lên ALOA.
Ủ 37
0
C, 24 giờ
B. Phân lập trên RAPID
’
L.mono
E. Đọc kết quả
Ủ 37
0
C, 24 giờ
Hình 3.2.1: Sơ đồ thí nghiệm 1
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 20
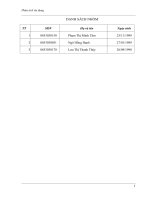
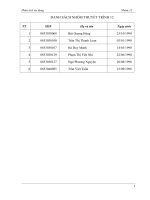
Bảng 3.2.1. Danh mục các chủng vi sinh vật thử nghiệm
Mẫu Tên chủng
A
1
Listeria monocytogenes
A
2
Listeria ivanovii
A
3
Salmonella spp.
A
4
Staphylococcus aureus
A
5
Coliform
A
6
Mẫu đối chứng không chứa vi sinh vật
c) Tiến hành thí nghiệm
Chuẩn bị các chủng vi sinh vật chuẩn như Bảng 3.2.1. Các chủng vi
sinh vật chuẩn được lấy từ phòng thí nghiệm của Nafiquad 6 - Cần Thơ, được
bảo quản cẩn thận ở nhiệt độ 4
0
C có nhãn ghi đầy đủ các thông tin như: tên, ký
hiệu chủng, ngày, số lần cấy chuyển. Các ống môi trường lỏng BHI đã được
chuẩn bị sẵn, đánh ký hiệu lên các ống BHI tương ứng. Cấy chuyển từ ống
chủng vi sinh vật chuẩn sang các ống BHI. Ủ ở 37
0
C trong 8 giờ.
Cấy ria từng chủng vi sinh vật chuẩn trong ống BHI tương ứng lên từng
đĩa RAPID’L.mono tương ứng. Các bước sau thực hiện theo quy trình phân
tích nhanh định tính chỉ tiêu Listeria monocytogenes trên RAPID’L.mono như
mô tả ở Trang 12 Mục 2.2.2.3.
d) Phương pháp thu thập số liệu
Quan sát khuẩn lạc trên môi trường RAPID’L.monno ở các đĩa cấy các
vi sinh vật khác nhau. Có hình thành hay không hình thành khuẩn lạc, hình
dạng và màu sắc khuẩn lạc.
3.2.2. Thí nghiệm 2: Xác định độ nhạy của phương pháp phân tích định
tính chỉ tiêu Listeria monocytogenes trên RAPID’L.mono
a) Mục đích thí nghiệm
Xác định độ nhạy (giới hạn pháp hiện – LOD
50
) của phương pháp
thông qua phân tích dãy nồng độ pha loãng chủng Listeria monocytogenes để
tìm nồng độ thấp nhất mà phương pháp có khả năng phát hiện.
.
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 21
b) Sơ đồ bố trí thí nghiệm:
c) Cách tiến hành
-Xác định hàm lượng tế bào từ 10-100 tế bào/ml dựa vào độ đục
McFarland
Độ đục chuẩn McFarland 0.5 có thể mua từ nhà sản xuất. Nếu tự pha thì
theo công thức sau: thêm 0.5ml dung dịch BaCl
2
.2H
2
0 1,175% vào 99,5ml
dung dịch H
2
SO
4
1%. Sau đó, độ đục chuẩn này được chia thành các thể tích
nhỏ chuyển sang các ống nghiệm giống nhau. Các ống này được dùng để so
sánh dịch vi khuẩn. Trước khi sử dụng, lắc đều để dung dịch đồng nhất.
- Thực hiện dãy pha loãng nhị phân
So sánh độ đục của dịch khuẩn chuẩn có độ đục gần giống độ đục của
ống McFarland khi đó ống dung dịch khuẩn chuẩn có mật độ tế bào khoảng
10
8
tế bào/ml. Pha loãng dịch khuẩn đến mật độ từ 10-100 tế bào/ml. Từ dịch
pha loãng dự đoán có mật độ từ 10-100 tế bào/ml (xem đây là nồng độ 2
0
) pha
Dựa vào độ đục chuẩn McFarland để xác định hàm lượng tế
bào Listeria monocytogenes có từ 10-100 tế bào/ml
Pha loãng dịch tế bào có mật độ 10-100 thành dãy nhị phân
(2
0
, 2
-1
, 2
-2
, 2
-3
,….)
Mỗi nồng độ hút 1ml cho vào bao PE chứa 25 gam mẫu
trắng (mẫu không có Listeria monocytogenes), mỗi nồng độ
lặp lại 10 lần)
Mỗi bao PE chứa 25 gam mẫu đã spike chủng được phân
tích định tính chỉ tiêu Listeria monocytogenes bằng phương
pháp phân tích nhanh RAPID’L.mono
Dựa vào các số liệu phân tích và áp dụng công thức tính
LOD
50
để xác định giới hạn phát hiện của phương pháp.
Hình 3.2.2: Sơ đồ thí nghiệm 2
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 22
loãng nhị phân (bằng cách hút 15ml ở nồng độ 2
0
cho vào chai nước muối sinh
lý 15ml) tương tự pha loãng 2
-1
, 2
-2
, 2
-3
, 2
-4
.
- Cho chủng vào mẫu
Tại mỗi nồng độ pha loãng 2
0
, 2
-1
, 2
-2
, 2
-3
, 2
-4
hút 1ml vào bao PE chứa
25gam mẫu trắng + 225ml dung dịch Half Fraser (lặp lại 10 lần), và 1ml vào
đĩa petri (hai đĩa petri), cho vào các đĩa petri 15-20ml PCA lắc đều và ủ ở
37
0
C trong 24 giờ, còn các bọc PE đã cho chủng ủ ở 30
0
C trong 24 giờ.
- Phân tích trên RAPID’L.mono.
Mỗi bao PE chứa 25 gam mẫu đã cho chủng được phân tích định tính chỉ
tiêu Listeria monocytogenes bằng phương pháp phân tích nhanh
RAPID’L.mono được mô tả ở Mục 2.2.2.3 Trang 12.
d) Thu thập số liệu
· Đếm số khuẩn lạc trên PCA
· Chọn tất cả các kết quả có cùng số lượng chủng cho vào thấp nhất mà
tại đó các kết quả đều dương tính.
· Chọn tất cả các kết quả có cùng số lượng chủng cho vào mà tại đó
>50% kết quả dương tính.
· Chọn tất cả các kết quả có cùng số lượng chủng cho vào mà tại đó các
kết quả đều dương tính.
Cách tính toán LOD
50
· Xác định giá trị L: log của số lượng tế bào được cho vào thấp nhất mà
tại đó 100% phép thử cho kết quả dương tính.
· Xác định d: log của nồng độ pha loãng (VD sử dụng dãy pha loãng thập
phân d=log10, sử dụng dãy pha loãng nhị phân d=log2)
· Xác định p
i
: tỉ lệ phản ứng dương tính
³
50% và 100% đối với nồng độ
pha loãng thứ i
Sau khi xác định các giá trị trên tính LOD
50
như sau:
Giới hạn phát hiện được tính toán theo LOD
50
– phương pháp Speaman-
Karber.
Log(LOD)= L – d(
å
P
i
– 0.5)= m
Với độ tin cậy 95% LOD
50
nằm trong khoảng
(10
m-2SQRT(U
m
)
; 10
m-2SQRT(U
m
)
)
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 23
Trong đó
· LOD
50
: giới hạn phát hiện của phương pháp mà tại đó 50% phép thử
cho kết quả dương tính.
· U
m
: ước lượng sai số của m
·
U
m
= d
2
å
P
i
(1-P
i
)/(n-1)
· n: số lần lặp lại đối với nồng độ pha loãng thứ i.
3.2.3. Thí nghiệm 3: Xác định độ lặp lại của phương pháp phân tích định
tính chỉ tiêu Listeria monocytogenes trên RAPID’L.mono
a) Mục đích
Xác định độ lặp lại của phương pháp phân tích định tính chỉ tiêu
Listeria monocytogenes trên RAPID’L.mono trên cùng một mẫu thử.
b) Bố trí thí nghiệm
Thí nghiệm được thực hiện với mẫu trắng (không nhiễm Listeria
monocytogenes) thêm chủng Listeria monocytogenes tại giá trị số lượng tế bào
được cho vào thấp nhất mà tại đó 100% phép thử cho kết quả dương tính từ thí
nghiệm 2. Cách tiến hành được thực hiện theo sơ đồ sau:
A. Tăng sinh
25g mẫu + 225ml Half Fraser
Đồng nhất, gây nhiễm
Ủ 30
0
C trong 24 giờ
C. Đọc kết quả trên RAPID’L.mono
D. Chọn khuẩn lạc điển hình khẳng định bằng cách cấy
ria lên ALOA.
Ủ 37
0
C trong 24 giờ
B. Phân lập trên RAPID
’
L.mono
E. Đọc kết quả
Ủ 37
0
C trong 24 giờ
Hình 3.2.3: Sơ đồ thí nghiệm 3
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 24
c) Cách tiến hành thí nghiệm
Sử dụng nồng độ dịch pha loãng ở thí nghiệm 2, gây nhiễm ở mật độ tế
bào nói trên vào 25gam mẫu + 225ml Half Fraser tiến hành phân tích định tính
chỉ tiêu Listeria monocytogenes theo phương pháp phân tích nhanh trên
RAPID’L.mono. Thí nghiệm được lặp lại 10 lần trên cùng mẫu thử. Thực hiện
song song mẫu trắng không gây nhiễm Listeria monocytogenes.
d) Thu thập số liệu
Tống số cho kết quả dương tính.
3.2.4. Thí nghiệm 4: Kiểm tra độ tương đồng của phương pháp phân tích
nhanh RAPID’L.mono so với phương pháp phân tích Listeria
monocytogenes theo ISO 11290-1:2004
a) Mục đích
Kiểm tra độ tương đồng của phương pháp phân tích nhanh
RAPID’L.mono so với phương pháp phân tích Listeria monocytogenes theo
tiêu chuẩn ISO 11290-1: 2004 trên các mẫu nhiễm được lấy từ công đoạn sản
xuất cá tra phi lê đông lạnh.
b) Bố trí thí nghiệm
Thí nghiệm được tiến hành theo sơ đồ sau:
Luận văn tốt nghiệp Đại Học Cần Thơ
Chuyên ngành: Chế Biến Thủy Sản Khoa Thủy Sản
SVTH: Hồ Linh Phương GVHD: Th.s Phạm Văn Hùng
MSSV: 2052056
Trang 25
Thí nghiệm được lặp lại 3 lần trên mẫu cá tra phi lê đông lạnh.
Phân tích song song mẫu bằng hai phương pháp định tính chỉ tiêu
Listeria monocytogenes trên RAPID’L.mono và theo ISO 11290-1:2004.
c) Thu thập số liệu
· Tổng hợp kết quả từ thí nghiệm 1, 2, 3.
· Tổng số cho kết quả dương tính sau khẳng định bằng phương pháp
RAPID’L.mono.
· Tổng số cho kết quả dương tính sau khẳng định bằng phương pháp ISO
11290-1: 2004.
F. Khẳng định
trên ALOA
D. Đọc kết quả trên ALOA, Oxford
E. Chọn khuẩn lạc điển hình cấy sang
TSYEA, TSYEB
F. Khẳng định
G. Đọc kết quả
A.Tăng sinh lần 1
25 g mẫu + 225ml HF
B.Tăng sinh lần 2
0,1ml dịch tăng sinh lần 1
+ 10ml FB
C. Cấy ria trên ALOA +
Palcam hoặc Oxford
30
0
C, 24 giờ
D. Đọc kết quả trên ALOA, Oxford
E. Chọn khuẩn lạc điển hình cấy sang
TSYEA, TSYEB
C. Cấy ria trên ALOA +
Palcam hoặc Oxford
37
0
C,48 giờ
37
0
C, 48 giờ
37
0
C, 48 giờ
25
0
C, 8-24 giờ (TSYEB)
37
0
C, 24 giờ (TSYEA)
F. Khẳng định:
- Henry illumination
- Catalase
- Gram
- Tan huyết
- Khả năng sử dụng đường
Xylose, Rhamnose
- Thử nghiệm CAMP
- Di động
25
0
C, 8-24 giờ (TSYEB)
37
0
C, 24 giờ (TSYEA)
G. Đọc kết quả
Hình 3.2.4.
Sơ đ
ồ
thí nghi
ệm 4
J. Cấy ria lên
RAPID’L.mono
37
0
C, 24giờ