Ma trận và đáp án khảo sát năng lực THPT quốc gia năm 2018 2019
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (146.12 KB, 9 trang )
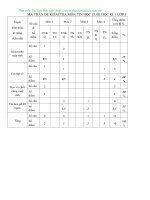
MA TRẬN THI KHẢO SÁT NĂNG LỰC THPT QUỐC GIA
NĂM HỌC 2018 -2019
Dạng câu hỏi
Độ khó
Nội dung
Tổng
Lý
Bài
Nhận
Thống
Vận
số câu thuyết
tập
biết
hiểu
dụng
HĨA HỌC 10 ( 4 Câu )
Bảng tuần hoàn các nguyê tố hóa
học và định luật tuần hồn
Nhóm halogen
Nhóm oxy
Tốc độ phản ứng và cân bằng hóa
học
Tổng lớp 11
Sự điện li
Nitơ -Photpho và hợp chất của
chúng
Cacbon -Silic và hợp chất của chúng
Đại cương về hóa học hữu cơ
Hiđrocacbon
Tổng hợp hiđrocacbon, ancol, axit
cacboxylic
Tổng lớp 11
Nội dung
1
1
1
1
1
Câu 1
1
Câu 4
1
1
Câu 2
Câu 3
4
3
1
HÓA HỌC 11 ( 8 Câu )
1
2
1
1
2
1
1
1
1
1
1
2
1
1
Câu 22
1
1
Câu 23
Câu 25
Câu 5
Câu 24
Câu 26
Câu 6
1
Câu 7
8
5
3
3
HÓA HỌC 12 ( 28Câu )
Tổng
số câu
4
Lý
thuyết
3
Bài
tập
1
Cacbohiđrat
Amin -aminoaxit-Peptit
1
4
1
1
3
Polime
Đại cương kim loại
Kim loại kiềm -Kiềm thổ -Nhôm và
hợp chất của chúng
Sắt -Crom -Cu và hợp chất của
chúng
Nhận biết
Hóa học và các vấn đề phát triển
kinh tế -Xã hội -Môi trường
Tổng hợp hữu cơ
1
3
3
1
2
1
1
2
Câu 8
Câu 28
Câu 29
4
3
1
Câu 32
1
1
1
1
3
2
1
Tổng hợp vô cơ
3
1
2
Tổng lớp 12
Tổng
28
40
16
24
12
16
Este -Lipit
Vận
dụng cao
Nhận
biết
Câu 9
3
2
Thống
hiểu
Câu 10,
câu 12
Vận
dụng
Câu 11
Câu 17
Câu 16
Câu 18,
câu 20
Câu 27
Câu 33,
câu 34
Câu 15
Câu 35
11
15
Câu 21
Câu 38
Câu 30,
câu 31
Câu 37
Câu 13,
câu 14
Câu 36
5
10
Vận
dụng cao
Câu 19
7
9
Câu 39
Câu 40
5
6
1
SỞ GD VÀ ĐT PHÚ YÊN
ĐÁP ÁN KHẢO SÁT NĂNG LỰC THPT QUỐC GIA NĂM 2019
TRƯỜNG THPT NGÔ GIA TỰ
Bài thi: KHOA HỌC TỰ NHIÊN
Mơn thi thành phần: HĨA HỌC
(Đề thi có 05 trang)
Thời gian làm bài: 50 phút, khơng kể thời gian phát đề
Họ, tên thí sinh: .........................................................................
Số báo danh: .............................................................................
Mã đề thi 102
Cho biết nguyên tử khối của các nguyên tố:
H = 1; C = 12; N = 14; O = 16; P = 31; S = 32; Cl = 35,5; Br = 80; Na = 23; K = 39; Mg = 24; Al = 27;
Ca = 40; Fe = 56; Cu = 64; Ag = 108; Ba = 137; Mn = 55.
Câu 1: Cấu hình electron của nguyên tử X là [Ar]3d64s2. Vị trí của X trong bảng tuần hồn:
A. chu kỳ 4, nhóm VIIIB.
B. chu kỳ 4, nhóm IIA.
C. chu kỳ 4, nhóm VIB.
D. chu kỳ 4, nhóm IIB.
Câu 2. Trường hợp khơng xảy ra phản ứng hóa học là
A. 3O2 + 2H2S
2H2O + 2SO2
B. FeCl2 + H2S → FeS + 2HCl
t
→
C. O3 + 2KI + H2O → 2KOH + I2 + O2
D. Cl2 + 2NaOH → NaCl + NaClO + H2O
→
Câu 3: Cho cân bằng hóa học : 2SO2 (k) + O2 (k) ¬
2SO3 (k) ; ∆H < 0. Với các biện pháp sau:
(1) tăng nhiệt độ
(2) tăng áp suất chung của hệ phản ứng
(3) hạ nhiệt độ
(4) dùng thêm chất xúc tác V2O5
(5) giảm nồng độ SO3
(6) giảm áp suất chung của hệ phản ứng.
Những biện pháp nào làm cân bằng trên chuyển dịch theo chiều thuận?
A. (1), (2), (4).
B. (2), (3), (4), (6).
C. (1), (2), (4), (5).
D. (2), (3), (5).
Câu 4: Trộn KMnO4 và KClO3 với một lượng bột MnO2 trong bình kính thu được hỗn hợp X. Lấy
52,550 gam X đem nung nóng , sau một thời gian thu được hỗn hợp chất rắn Y và V lít khí O2. Biết
KClO3 bị nhiệt phân hoàn toàn tạo 14,9 gam KCl chiếm 36,315% khối lượng Y. Sau đó cho tồn bộ Y tác
dụng hồn tồn với axit HCl đặc du đung nóng , sau phản ứng cô cạn dung dịch thu được 51,275 gam
muối khan. Hiệu suất của quá trình nhiệt phân muối KMnO4 trong X là :
A. 62,5%
B. 91,5%
C. 75%
D. 80%
o
Hướng dẫn giải
nKCl = 0,2 → nKClO3 = 0,2
mY =
14,9
= 41,03
0,36315
52,550 − 41,03
= 0,36
32
Vì cho X hoặc Y tác dụng với HCl thì khối lượng muối như nhau nên.Ta có ngay :
KMnO4 : a
KCl : a + 0,2
HCl
mX = 52,55 KClO3 : 0,2 →
MnCl 2 : a + b
MnO : b
2
74,5(a + 0,2) + 126(a + b) = 51,275
BTKL
→
158a + 87b = 52,55 − 24,5
a = 0,15
t0
→
2KMnO4
→ K 2MnO4 + MnO2 + O2
b = 0,05
0,36 − 0,3
→ H% =
= 80%
0,075
BTKL
→ n↑O2 =
2
Câu 5: Hợp chất hữu cơ nhất thiết phải chứa nguyên tố
A. hidro.
B. cacbon.
C. oxi.
Câu 6. Quan sát thí nghiệm ở hình vẽ:
Khi cho nước vào bình tam giác chứa rắn X thì thấy có khí Y tạo
thành đồng thời màu của dung dịch Br2 nhạt dần rồi mất hẳn.
Chất rắn X trong thí nghiệm là
A. Al4C3
B. CH3COONa
C. CaO
D. CaC2
D. nitơ.
Câu 7: Hỗn hợp X gồm hiđro, propen, axit acrylic, ancol anlylic (C3H5OH). Đốt cháy hoàn toàn
1,0 mol X thu được 39,6 gam CO2. Đun nóng X với Ni một thời gian, thu được hỗn hợp Y. Tỉ khối của
Y so với X bằng 1,25. Cho 0,32mol Y phản ứng vừa đủ với V lít dung dịch Br2 0,1M. Giá trị của V là
A. 0,5.
B. 0,6.
C. 0,4.
D. 0,3.
Hướng dẫn giải
X gồm hidro, C3H6, C3H4O2,C3H6O. Ta thấy ngồi hidro thì các chất cịn lại đều có 3 C và đều phản ứng
với hidro theo tỉ lệ mol 1 : 1.
n CO2 = 0,9 mol
=> n chất hữu cơ trong X = 0,3 mol => nH2 = 0,7 mol
Có dY/X = 1,25.
M
1
M X * n X = M Y * nY ⇒ n X = Y nY ⇒ nY =
= 0,8mol
MX
1,25
n H 2 pu = n X − nY = 0,2mol
=> số mol liên kết pi có thể phản ứng với hidro trong Y = 0,3 – 0,2 = 0,1 mol
=> 0,8 mol Y phản ứng với Br2 thì nBr2 = 0,1 mol
Với 0,32 mol Y thì nBr2 = 0,04mol
=> V = 0,4 lít
Câu 8: Thủy tinh hữu cơ Plexiglas là một chất dẻo, cứng, trong suốt, bền với nhiệt, với nước, axit, bazơ
nhưng bị hòa tan trong benzen, ete. Thủy tinh hữu cơ được dùng để làm kính máy bay, ơ tơ, kính bảo
hiểm, đồ dùng gia đình… Thủy tinh hữu cơ có thành phần hóa học chính là polime nào sau đây?
A. Poli(phenol fomandehit).
B. Poli(vinyl axetat).
C. Poli(vinyl clorua).
D. Poli(metyl metacrylat).
Câu 9: Trong công nghiệp thực phẩm, để tạo hương dứa cho bánh kẹo người ta dùng este X có cơng thức
cấu tạo CH3CH2COOC2H5.Tên gọi của X là
A. propyl axetat
B. metyl propionat.
C. metyl axetat.
D. etyl propionat.
Câu 10: Có các phát biểu sau:
(1) Thủy phân chất béo trong môi trường kiềm luôn thu được glixerol.
(2) Triolein làm mất màu nước brom.
(3) Chất béo không tan trong nước và nhẹ hơn nước.
(4) Benzyl axetat là este có mùi chuối chín.
(5) Đốt cháy etyl axetat thu được số mol nước bằng số mol khí cacbonic.
Số phát biểu đúng là:
A. 4.
B. 5.
C. 2.
D. 3.
Câu 11: Thuỷ phân hoàn toàn 11,44 gam este no, đơn chức, mạch hở X với 100ml dung dịch NaOH 1,3M
(vừa đủ) thu được 5,98 gam một ancol Y. Tên gọi của X là
A. Etyl fomat
B. Etyl propionat
C. Etyl axetat
D. Propyl axetat
t°
X + NaOH
→ CH 3CHO + ( COONa ) 2 + C2 H 5OH
Câu 12: Cho phản ứng hóa học sau:
Kết luận nào dưới đây về X là không đúng?
A. X tác dụng với NaOH theo tỷ lệ 1 : 2 về số mol.
B. X có khả năng làm mất màu dung dịch Br2.
C. X có khả năng tham gia phản ứng tráng gương.
3
D. Không thể điều chế X từ axit cacboxylic và ancol tương ứng.
Câu 13: Cho dãy các chất:metan, etilen, axetilen, etan, ancol anlylic,axit acrylic, glixerol, triolein. Số
chất trong dãy có khả năng làm mất màu dung dịch nước brom là
A. 6
B. 3
C. 5
D. 4
Câu 14: Cho các chất sau: etyl axetat, tripanmitin, saccarozo, etyl amin, Gly-Ala, tơ nilon-6. Số chất
tham gia phản ứng thủy phân trong môi trường kiềm là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 15: Kết quả thí nghiệm của các hợp chất hữu cơ A, B, C, D, E như sau:
Mẫu thử
Thuốc thử
Hiện tượng
A
Dung dịch AgNO3 trong môi trường NH3 đun nóng
Kết tủa Ag trắng sáng
B
Cu(OH)2 trong mơi trường kiềm, đun nóng
Kết tủa Cu2O đỏ gạch
C
Cu(OH)2 ở nhiệt độ thường
Dung dịch xanh lam
D
Nước Br2
Mất màu dung dịch Br2
E
Qùy tím
Hóa xanh
Các chất A, B, C, D, E lần lượt là:
A. Metanal, glucozơ, axit metanoic, fructozơ, metyl amin.
B. Metanal, metyl fomat, axit metanoic, metyl amin, glucozơ.
C. Metyl fomat, etanal, axit metanoic, glucozơ, metyl amin.
D. Etanal, axit etanoic, metyl axetat, phenol, etyl amin.
Câu 16: Thực hiện hai thí nghiệm sau:
· Thí nghiệm 1: Cho m1 gam fructozơ phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, đun
nóng, thu được a gam Ag.
· Thí nghiệm 2: Thủy phân m2 gam saccarozơ trong dung dịch H2SO4 lỗng, đun nóng (hiệu suất phản
ứng thủy phân là 80%) một thời gian thu được dung dịch X. Trung hòa dung dịch X bằng dung dịch
NaOH vừa đủ, thu được dung dịch Y. Cho toàn bộ Y tác dụng với lượng dư dung dịch AgNO3 trong NH3,
đun nóng. Sau khi phản ứng xảy ra hồn toàn thu được a gam Ag. Biểu thức liên hệ giữa m1 và m2 là
A. 19m1 = 16m2.
B. 19m1 = 15m2.
C. 38m1 = 20m2.
D. 19m1 = 20m2.
Câu 17: Cho các phát biểu sau:
(a) Tất cả các peptit đều có phản ứng màu biure.
(b) Muối phenylamoni clorua không tan trong nước.
(c) Ở điều kiện thường, metylamin và đimetylamin là những chất khí.
(d) Trong phân tử peptit mạch hở Gly-Ala-Gly có 4 nguyên tử oxi.
(e) Ở điều kiện thường, amino axit là những chất lỏng.
Số phát biểu đúng là
A. 5.
B. 3.
C. 4.
D. 2.
Câu 18. Đốt cháy hoàn toàn m gam một amin no, đơn chức, mạch hở X cần 0,1575 mol O2. Sản phẩm
cháy thu được có chứa 2,43 gam nước. Giá trị của m là?
A. 2,32
B. 1,77
C. 1,92
D. 2,08
Câu 19: X, Y là hai hữu cơ axit mạch hở. Z là ancol no, T là este hai chức mạch hở không nhánh tạo bởi
X, Y, Z. Đun 29,145 gam hỗn hợp E chứa X, Y, Z, T với 300 ml dung dịch NaOH 1M vừa đủ thu được
ancol Z và hỗn hợp F chứa hai muối có số mol bằng nhau. Cho Z vào bình chứa Na dư thấy bình tăng
14,43 gam và thu được 4,368 lít H2 (ở đktc). Đốt hồn tồn hỗn hợp F cần 11,76 lít O 2 (đktc) thu được khí
CO2, Na2CO3 và 5,4 gam H2O. Phần trăm khối lượng của T trong E là
A. 13,9
B. 26,4
C. 50,82
D. 8,88
Hướng dẫn giải
B1 : Xác định chất Z
Z + Na : nH2 = 0,195 mol
Giả sử Z có n nhóm OH
mbình tăng = mancol – mH2 => mancol = 14,82g
=> nancol = nH2.2/n => Mancol = 38n
Với n = 2 thì M = 76 => ancol C3H8O2 và nancol = 0,195 mol
B2 : Xác định CT và lượng chất của 2 muối hữu cơ
Vì este 2 chức mạch hở => 2 axit phải là axit đơn chức.
=> nX = nY (vì sau phản ứng với NaOH tạo số mol 2 muối bằng nhau)
4
Bảo tồn Na : nNa2CO3 = ½ nNaOH = 0,15 mol
Có : nCOONa = nNaOH pứ = 0,3 mol => mmỗi muối = 0,15 mol ; nO2 = 0,525 ; nH2O = 0,3 mol
Bảo toàn O : 2nF + 2nO2 = 2nCO2 + 3nNa2CO3 + nH2O
=> nCO2 = 0,45 mol
Bảo toàn khối lượng : mF + mO2 = mCO2 + mNa2CO3 + mH2O
=> mF = 24,3g
=> Mmuối 1 + Mmuối 2 = 162g
=> 2 muối thỏa mãn là : HCOONa và CH2=CHCOONa
B3 : Xác định T và %mT(E)
Gọi số mol este T là x
=> nC3H8O2 = 0,195 – x ; nHCOOH = nC2H3COOH = 0,15 – x
=> mE = 29,145 = 76(0,195 – x) + (46 + 72)(0,15 – x) + 158x
=> x = 0,09375 mol
=> %mT = 50,82%
Câu 20: Hỗn hợp X chứa hai amin kế tiếp thuộc dãy đồng đẳng của metylamin. Hỗn hợp Y chứa glyxin
và lysin. Đốt cháy hoàn toàn 0,4 mol hỗn hợp Z (gồm X và Y) cần vừa đủ 2,055 mol O2, thu được 32,22
gam H2O, 35,616 lít (đktc) hỗn hợp CO2 và N2. Phần trăm khối lượng của amin có khối lượng phân tử
nhỏ hơn trong Z là
A. 14,42%.
B. 16,05%.
C. 13,04%.
D. 26,76%.
Hướng dẫn giải
Z bao gồm:
CnH2n+3N: a mol
C2H5NO2: b mol
C6H14N2O2 : c mol
=> nCO2 = na + 2b + 6c và nN2 = a/2 + b/2 + c
= > nCO2 + nN2 = na + a/2 + 5b/2 + 7c = 0,81 (1 )
nH20= a(2n + 3)/2 + 5b/2 + 7c = 0,91 (2)
=> a = 0,1
nz = 0,2 => b + c = 0,1 (3)
Bảo toàn O:
2(b + c) + 2no2 - 2nco2 + 11H20 —> nco2 = 0,68 => nN2 = a/2 + b/2 + c = 0,81 - 0,68 (4)
(2)
(4) =>b = 0,04 và c = 0,06
nco2 = na + 2b + 6c = 0,68 => n = 2,4
=> X chứa C2H7N (0,06) và C3H9N (0,04) (Tính dựa vào c trung bình 2,4 và tổng số mol a = 0,1 )
Vậy Z chứa C2H7N (0,06); C3H9N (0,04); C2H5NO2 (0,04) và C6H14N2O2 (0,06)
=> %C2H7N = 14,42%
5
Câu 21: X là este của a-aminoaxit có cơng thức phân tử C5H11O2N; Y và Z là hai peptit mạch hở được tạo
bởi glyxin và alanin có tổng số liên kết peptit là 7. Đun nóng 63,5 gam hỗn hợp E chứa X, Y, Z với dung
dịch NaOH vừa đủ, thu được hỗn hợp chứa 2 muối và 13,8 gam ancol T. Đốt cháy toàn bộ hỗn hợp muối
cần dùng 2,22 mol O2, thu được Na2CO3, CO2, H2O và 7,84 lít khí N2 (đktc). Phần trăm khối lượng của
peptit có khối lượng phân tử lớn trong hỗn hợp E là
A. 7,45%
B. 42,37%
C. 7,23 %
D. 50,39%
Hướng dẫn giải
(*)Thủy phân trong H2O ( H+ , OH- ) → a - aa ban đầu
Ax + (x – 1) H2O → x. A
- Số pt H2O = số lk peptit
- BTKL : mpeptit + mH2O = maa ban đầu
(*) Thủy phân trong MT axit ( HCl )
Ax + (x – 1)H2O + xHCl → muối clorua
- số pt HCl = số nguyên tử N/ peptit = x
- BTKL : mpeptit + mH2O + mHCl = mmuối
(*) Thủy phân trong MT bazo : NaOH
Ax + xNaOH → muối natri + H2O
- số pt H2O = số Haxit / Ax
- BTKL : mpeptit + mNaOH = mmuối Natri + mH2O
=> nNaOH pứ = x.nH2O
B1 : Xác định lượng các muối natri của Gly và Ala
Đặt a , b là số mol muối GlyNa và AlaNa
Bảo toàn N : nN = a + b = 2nN2 = 0,7 mol
Có : nO2 = 2,25a + 3,75b = 2,22
=> a = 0,27 ; b = 0,43 mol
B2 : Xác định số mol Y và Z , biện luận số liên kết peptit trong Y và Z
=> mmuối = 73,92g và nNaOH = 0,7 mol
Bảo toàn khối lượng : nH2O = 0,21 mol
=> nY + nZ = 0,21 (1)
X là este của Gly hoặc Ala và ancol T.
Nếu X là H2N-CH(CH3)-COOC2H5 => nX = nC2H5OH = 0,3 mol( loại)
X là H2NCH2COOC3H7 => nX = nC3H7OH = 0,23 mol
=> Y, Z tạo ra từ 0,27 mol Gly và 0,43 – 0,3 = 0,13 mol Ala
=> Số N trung bình của Y, Z = (0,04 + 0,43) : 0,21 = 2,24
=>Y là dipeptit và Z là heptapeptit ( tổng số liên kết peptit bằng 7)
Có : nN = 2nY + 7nZ = 0,04 + 0,43 (2)
Từ (1), (2) => nY = 0,2 ; nZ = 0,01 mol
B3 : Biện luận thành phần Gly và Ala của Y và Z => %mY
Y là (Gly)u(Ala)2 – u
Z là (Gly)v(Ala)7 – v
=> nGly = 0,2u + 0,01v = 0,04
=> 20u + v = 4
=> u = 0 và v = 4 là cặp nghiệm duy nhất.
Vậy Y là (Ala)2 (0,2 mol)
Z là (Gly)4(Ala)3 (0,01 mol)
=> %mY = 50,39%
%mZ = 7,23%; %mX = 55,28
Câu 22: Dãy chất nào sau đây đều là chất điện li mạnh?
A. HCl, NaOH, BaSO4.
B. HCl, NaOH, HCOOH.
C. KOH, NaCl, HgCl2.
D. NaNO3, NaNO2, H2S.
Câu 23: Kem đánh răng chứa một lượng muối của flo, như CaF2 , SnF2, có tác dụng bảo vệ lớp men răng
vì nó thay thế một phần hợp chất có trong men răng là Ca5(PO4)3OH thành Ca5(PO4)3F . Điều này có ý
nghĩa quan trọng trong bảo vệ răng vì :
+
A. lớp Ca5(PO4)3F có thể phản ứng với H còn lại trong khoang miệng sau khi ăn
B. lớp Ca5(PO4)3F không bị môi trường axit trong miệng sau khi ăn bào mòn
C. lớp Ca5(PO4)3F là hợp chất trơ, bám chặt và bao phủ hết bề mặt của răng
6
D. lớp Ca5(PO4)3F có màu trắng sáng, tạo vẻ đẹp cho răng
Câu 24: Cho hỗn hợp X gồm 0,15 mol P2O5, 0,15 mol K2O, 0,1 mol Na2O vào nước dư thu được dung
dịch Y chứa m (gam) muối. Giá trị của m là :
A. 45,2
B. 43,5
C. 34,5
D. 35,4
−
+
Chú ý : Với bài tốn axit nhiều nấc mình hay dùng kỹ thuật OH cướp H do đó dễ thấy.
HPO 24− : 0, 2
H3 PO 4 : 0,3
−
H PO : 0,1
BTNT
OH − :0,5
→ KOH : 0,3
→ 2 4
→ m = 45, 2(gam)
+
NaOH : 0, 2
K : 0,3
+
Na : 0, 2
Ta có :
Câu 25. Trong các phản ứng nào sau đây, phản ứng nào sai
t
→ COCl 2
→ 3CO2 + 2Fe
A. 3CO + Fe2O3
B. CO + Cl 2
0
0
t
t
→ 3CO2 + 2Al
→ 2CO2
C. 3CO + Al 2O3
D. 2CO + O2
Câu 26. Cho m gam hổn hợp muối cacbonat tác dụng hết với dd HCl thu được 6,72 lít khí CO2(đkc) và
32,3g muối clorua.Giá trị của m là:
A. 27g
B. 28g
C. 29g
D. 30g
Câu 27: Dãy nào sau đây chỉ gồm các chất vừa tác dụng được với dung dịch HCl loãng, vừa tác dụng
được với dung dịch AgNO3?
A. Fe, Ni, Sn
B. Zn, Cu, Mg
C. Hg, Na, Ca
D. Al, Fe, P b
Câu 28: Trong số 5 kim loại: Cu, Fe, Al, Ag, Cr. Nhận định nào sau đây đúng?
A. Kim loại có tính khử mạnh nhất là Cr.
B. Kim loại dẫn điện tốt nhất là Cu.
C. Kim loại không phản ứng với oxi là Fe.
D. Kim loại có độ cứng cao nhất là Cr.
Câu 29: Nước cứng là nước có chứa nhiều các ion nào sau đây ?
A. Mg2+; Ca2+
B. Cu2+ ; K+
C. Fe 2+; Na+
D. Fe2+; K+
Câu 30. Hấp thụ hồn tồn 2,688 lít khí CO2(đkc) vào 2,5 lít dd Ba(OH)2 nồng độ a mol/lít,thu được
15,76g kết tủa .Giá trị của a là
A. 0,032
B. 0,048
C. 0,06
D. 0,04
Câu 31: Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hịa tan hồn tồn 21,9 gam X vào nước, thu được
1,12 lít khí H2 (đktc) và dung dịch Y chứa 20,52 gam Ba(OH)2. Cho Y tác dụng với 100 ml
dung dịch Al2(SO4)3 0,5M, thu được m gam kết tủa. Giá trị của m là
A. 27,96.
B. 29,52.
C. 36,51.
D. 1,50.
Câu 32: Nhận xét nào sau đây không đúng
A. Cr(OH)2 là một hidroxit lưỡng tính
B. CrO là một oxit bazơ
C. CrO3 là một oxit axit
D. Cr2O3 là một oxit lưỡng tính
Câu 33: Tiến hành các thí nghiệm sau:
(a) Cho Cu dư vào dung dịch Fe(NO3)3.
(b) Sục khí CO2 dư vào dung dịch NaOH.
(c) Cho Na2CO3 dư vào dung dịch Ca(HCO3)2.
(d) Cho bột Fe vào dung dịch FeCl3 dư.
(e) Cho HCl dư vào dung dịch NaCrO2.
Số thí nghiệm cuối cùng cịn lại dung dịch chứa 1 muối tan là:
A. 2
B. 1
C. 4
D. 3
Câu 34: Hịa tan hồn tồn Fe3O4 trong dung dịch HCl (loãng, dư), thu được dung dịch X. Cho dãy gồm
các chất: Cu, FeSO4, KMnO4, BaCl2, Cl2, Ca(NO3)2 , NaCl. Số chất trong dãy phản ứng được với dung
dịch X là:
A. 5.
B. 4.
C. 3.
D. 6.
Câu 35: Khí biogas sản xuất từ chất thải chăn nuôi đuợc sử dụng làm nguồn nhiên liệu trong sinh họat ở
nông thôn. Tác dụng của việc sử dụng khí biogas là:
A. Phát triển chăn nuôi.
B. Đốt để lấy nhiệt và giảm thiểu ô nhiễm môi trường.
C. Giải quyết công ăn việc làm ở khu vực nơng thơn.
D. Giảm giá thành sản xuất dầu, khí.
Câu 36. Cho các phát biểu sau :
0
7
(a) CO khử được FeO ở nhiệt độ cao.
(b) Có thể dùng Na2CO3 để làm mềm tất cả các loại nước cứng.
(c) Thành phần hóa học chính của supephotphat kép là Ca(H2PO4)2 và CaSO4.
(d) Mg có thể cháy trong khí CO2.
(e) Khi nhỏ vài giọt dung dịch axit vào muối cromat màu da cam ta được một dung dịch mới
màu vàng.
(f) Các kim loại Na, Ba, Be đều tác dụng với nước ở nhiệt độ thường.
(g) Tất cả các phản ứng của lưu huỳnh với kim loại đều cần đun nóng.
(h) Độ dinh dưỡng trong phân lân được đánh giá bằng hàm lượng nguyên tố photpho.
Số phát biểu đúng là
A. 3
B. 4
C. 6
D. 5
Câu 37: Hỗn hợp X gồm Fe2O3 và Cu . Cho m gam hỗn hợp X tan hết trong dung dịch HCl vừa đủ thu
được dung dịch Y chứa 122,76 gam chất tan. Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 loãng
vừa đủ thu được dung dịch Z chứa 3 chất tan với tỉ lệ số mol 1:2:3. Dung dịch Y làm mất màu tối đa bao
nhiêu gam KMnO4 trong môi trường H2SO4?
A. 5,688
B. 8,848
C. 73,944
D. 115,024
Hướng dẫn giải
Fe2O3 + 3 H2SO4 → Fe2(SO4)3 + 3 H2O
Cu + Fe2(SO4)3 → CuSO4 + 2 FeSO4
Dung dịch Z gồm CuSO4, FeSO4, Fe2(SO4)3.
n
= x; n FeSO4 = 2 x; n Fe2 ( SO4 )3 = 3 x
Đặt CuSO4
Dung dịch Y gồm FeCl2 2x mol, CuCl2 x mol, FeCl3 6x mol
mY = 135x + 127 * 2 x + 162,5 * 6 x = 122,76
⇒ x = 0,09 mol
n 2 + + nCl − 2 * 0,09 + 24 * 0,09
n KMnO4 = Fe
=
= 0,468mol
5
5
m KMnO4 = 0,468 *158 = 73,944g
Câu 38: Dưới đây là đồ thị biểu diễn mối quan hệ giữa thời gian điện phân và pH của dung dịch khi điện
phân 400ml (xem thể tích khơng đổi) dung dịch gồm KCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn
xốp) với cường độ dòng điện bằng I = 1,93A.
Giá trị của t trên đồ thị là
A. 3000.
B. 1200.
C. 1800.
D. 3600.
Hướng dẫn giải
• đoạn thằng y = 2 ứng với quá trình điện phân CuCl2 → Cu + Cl2, pH của dung dịch không đổi.
và từ pH = 2 → CM (HCl) = 0,01 mol → có 0,004 mol HCl trong dung dịch ban đầu.
• đoạn thằng tiếp theo (2 → 7) là quá trình điện phân HCl → H2 + Cl2, nồng độ H+ giảm dần nên pH từ 2
→ 7.
tại pH = 7 là ứng với thời điểm mà HCl điện phân hết, bắt đầu quá trình tiếp theo, dung dịch lúc này chỉ
còn KCl.
8
• tiếp đó là q q trình: KCl + H2O → KOH + H2 + Cl2; pH = 13 → CM (KOH) = 0,1 M
→ có 0,04 mol KOH → ứng với 0,04 mol KCl. sau quá trình này, chỉ có H2O bị điện phân,
pH ổn đinh = 13 và không đổi (trừ khi nước bị điện phân nhiều và tính sự thay đổi của H2O).
Tóm lại, ứng tại thời điểm t, ∑nCl2 ra bên anot = 0,008 + 0,004 ÷ 2 + 0,04 ÷ 2 = 0,03 mol.
→ ne trao đổi = 0,06 mol → t = Ans × 96500 ÷ 1,93 = 3000 giây.
Câu 39: Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được
hỗn hợp rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất khơng tan Z và 0,672 lít khí
H2. Sục khí CO2 dư vào Y, thu được 46,8 gam kết tủa. Cho Z tan hết vào dung dịch HNO 3 , thu được dung
dịch chứa 146,52 gam muối nitrat và 12,992 lít NO (là sản phẩm khử duy nhất của HNO 3). Biết các phản
ứng xảy ra hoàn tồn, các thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị của m là
A. 56,48.
B. 50,96.
C. 54,16.
D. 52,56.
Hướng dẫn giải
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2
=> X chứa Al dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02
←
0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29
← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)
Câu 40: Hòa tan hết 17,92 gam hỗn hợp X gồm Fe3O4 , FeO, Fe, CuO, Cu , Al và Al2O3 ( trong đó oxi
chiếm 25,446% về khối lượng ) vào dung dịch HNO3 loãng dư, kết thúc các phản ứng thu được dung dịch
Y và 1,736 lít (đktc) hỗn hợp khí Z gồm N2 và N2O, tỉ khối Z so với H2 là 15,29. Cho dung dịch NaOH tới
dư vào Y rồi đun nóng , khơng có khí thốt ra. Số mol HNO3 đã phản ứng có giá trị gần nhất với
A. 0,75
B. 1,35
C. 1,25
D. 1,45
Hướng dẫn giải
Coi hỗn hợp X gồm Fe, Cu, Al và O. Gọi số mol của N2 và N2O lần lượt là x, y mol.
=> nO = 0,285
Ta có:
x+y=0,0775
28x+44y=15,29×2×0,0775
=>x=0,065 và y=0,0125
Khi cho NaOH tới dư khơng thấy có khí thốt ra → khơng hình thành NH4NO3
=>nHNO3=2nO+12nN2+10nN2O =1,475
9