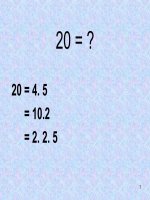Bài giảng phân tích thực phẩm
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.52 MB, 118 trang )
3
TRƯỜNG ĐẠI HỌC CÔNG NGHIỆP THỰC PHẨM TP.HCM
PHÂN TÍCH THỰC PHẨM
(Hệ Đại học)
THÁNG 09/2013
4
1
1.2.
nào
qui
kdùng.
1.3. Pphân tích trong
l
g/kg,
1.4. phân tích
Phân tích phân tích t
Phân tích phân tích phân tích phân tích
1.5. phân tích
phân tích d
ính
nêu trên.
(Association of Officical Analytical Chemists), TCVN)
5
phân tích.
1.6.
, nó
Lkhông
1.6.1.
:
:
qui
.
:
: là
1.6.2. Các qui
6
qui
qui
,
.
nguyên bao bì.
qui
giao ngay
7
1.6.3.
1.6.3.1.
ng 1.1).
(trích)
1.6.3.2.
8
10m tra
= 10000 / 200 = 50.
1.6.3.3.
M
M
M
9
1.6.4. Gu
1.6.4.1. G
qui
Trong i
dung sau:
gói k
.
1.6.4.2.
10
1.6.5.
phân tích.
-
quá trình phân tích.
1.6.5.1.
acid base
sulfate
Dùng acid phân tích
1.6.5.2. Nhóm tách pha
cá pha
Cách thu
11
tích
n
Etanol
2
,
Etanol
thêm
NaOH
NH
3
acid H
3
BO
3
trong quá
sulfit
Acid hóa
SO
2
SO
2
+
NaOH
(metanol, etanol, acetonitril)
-hexcan, aceton.
C
: Mt
.
:
+
+
: tán
:
+
+
+
12
1.7
1.7.1.
Trung bình () (mean, arithmetic mean, average):
1
, x
2
, x
n
1.7.2.
(
2
và s
2
)
:
30) thì:
kém.
1.7.3. (standard deviation)
l
13
30, f=n-
1.7.4.
Khong tin cy c thc biu th khong tn ti giá tr
trung bình hay còn gi là khong bt n ca s liu thc nghim trung bình.
:
n
s hay SD:
t
P;f
-
student ng kê
95% -1 )
student
f=n-1
50%
80%
90%
95%
99%
1
1,000
3,078
6,314
12,706
63,657
2
0,816
1,886
2,920
4,303
9,925
3
0,765
1,638
2,353
3,182
5,841
4
0,741
1,533
2,132
2,776
4,604
5
0,727
1,476
2,015
2,571
4,032
6
0,718
1,440
1,943
2,447
3,707
7
0,711
1,415
1,895
2,365
3,500
8
0,706
1,397
1,860
2,306
3,355
14
9
0,703
1,383
1,833
2,262
3,250
10
0,700
1,372
1,812
2,228
3,169
1.7.5
Ví d ng % cacbonh là
12,6; 11,9; 13,0; 12,7 và 12,5. Tính giá tr lêch chun và
hãy i xác sut là 95%.
Xtb = (12,6+11,9+13+12,7+12,5) : 5 = 12,54%
s
2
= 0,1296
s = 0,36
Nu ly vi xác su ng thc ca cacbohydrat nm trong
khong tin
12,54% - 0,50% < M < 12,54% + 0,50%
hay k
4 %. Tính giá tr lêch chun,
i xác sut là 95%. (Sinh viên t gii)
.
0,36
2,776 0,5
5
pf
tS
n
15
C 2
2.1. Phân tích
3+
3
4
o
2
O
3
3+
.
:
2.1.2. Các
Có
.
2.1.2
trên cân phân tích.
3
2
O
2
, ion Au
3+
2+
2Au
3+
+ 6H
2
O
2
2Au + 6H
+
+ 3O
2
x
Ch
16
2.1.2.2.
cân.
.
SO
4
2-
2+
SO
4
2-
+ Ba
2+
= BaSO
4
ân
2Fe
3+
+ OH
-
3
2
O
3
2.1.2.
vào
Xác chè, cafe Trong
17
2.2.
S
l
t
E
t
= |V
eq
- V
fin
|
V
eq
V
fin
2.2.1.3.
-
2.2.1.4. Các
chia các
d
3
2
CrO
4
18
. N
= V
tc
. N
tc
r
+
dung d
hai.
, chó nó tác
3
3
nhôm.
+
2+
4
2
Cr
2
O
7
Na
2
S
2
O
3
rtrand. Nhóm
--CO-
4
sau: cho vào dung d
2
3+
2+
.
2+
4
. N
= V
tc
. N
tc
+
chu
2+
b
ocalat. Cho ion Ca
2+
4
)
2
C
2
O
4
4
Ca
2+
+ (NH
4
)
2
C
2
O
= CaC
2
O
4
+ 2NH
4
+
19
5(NH
4
)
2
C
2
O
4
+ 2KMnO
4
+ 16H
+
= 10CO
2
+ 2Mn
2+
+ 2K
+
+ 10NH
4
+
+ 8H
2
O
2+
2
O
4
2-
, 1
ion C
2
O
4
2-
2+
Ca
2+
= M
Ca
2+
2.2.1.5
B
(ml)
B
A
(ml)
A
qui
A
.N
A
= V
B
.N
B
: P(g/l) = N
A
.
A
A
2.2.2.
2.2.2.1. acid base
a.
base là
base
+
OH
-
:
H
+
+ OH
-
H
2
O
o
K
w
= [H
+
][OH
-
] = 10
-14
và pH + pOH = 14
+
và OH
-
20
- base,
b. base:
base
base
base
base
base
base
c. acid base
acid base
base
ba
Hind + H
2
O H
3
O
+
+ Ind
-
Ind
-
+ H
2
O Hind + OH
-
-
Ind
-
base
pH
Màu
Metyl da cam
3,1 4,4
Vàng
Phenolphtalein
Không màu
8,2 - 10
5 - 8
Xanh
Tashiro
Tím
5,5
4,4 -6,2
Vàng
Alizarin vàng
Vàng
10,1 - 12
Tím
21
i,
c
nguyên nhân gây
d. acid base:
,
2
Kjeldahl
2.2.2.2.
Ox
1
+ Kh
2
Kh
1
+ Ox
2
Trong ph
electron; c
Ox
1
+ ne Kh
1
Kh
2
ne Ox
2
P
Ví MnO
4
-
+ 8H
+
+Fe
2+
Mn
2+
+ Fe
3+
+ 4H
2
O
MnO
4
-
+ 8H
+
+ 5e
-
Mn
2+
+ 4H
2
O
MnO
4
-
Fe
2+
- e
-
3+
(quá trình oxy hóa)
Fe
3+
:
kim l.
22
là 1 mol/l,
o
.
Ox/Kh
2+
và Fe
3+
o
.
[Ox] và [Kh] tính theo mol/l
o
K, F=9650
c.
T
4
)
icromat (K
2
Cr
2
O
7
)
d.
Mohr Fe
2+
3+
23
. Ion
ng p iod peroxide
ein trong cafe
2.2.2.3.
P chung
do
trí.
+
+ CN
-
2
]
-
Al
3+
+ 6F
-
6
]
3-
C
2
Ind
-
24
11,6 nê
2-
có màu xanh. HInd
2-
xanh.
2+
, Zn
2+
, Cd
2+
d.
2.2.2.4.
c
-
, Br
-
, CN
-
, SCN
-
,
CrO
4
2-
, PO
4
3-
b.
3
+
2
Cl
2
, Hg
2
Br
2
, Hg
2
I
2
.
2
, Hg(SCN)
2
, Hg(CN)
2
25
c. :
pháp Mohr.
26
3.1. Phân tích
m ca phân tích n th
Pn th nh n các ion (các cht) da
vào s i th n cc khi nhúng vào dung dch phân tích.
s ph thung ca th n cc E
vào ho các cu t ca mt bán phn ng oxy hóa kh:
Ox + ne Kh (3.1)
ln
(3.2)
E
o
:
n th oxy hóa kh tiêu chun ca cp Ox- Kh (V)
R: hng s ng (8,314 J
o
K
-1
mol
-1
T: Nhi tuyi (
o
K)
F: S Faraday (96485 Coulomb)
n: S electron tham gia trong cp Ox Kh
a
ox
, a
kh
: Ho dng oxy hóa và dng kh
f
ox,
f
kh
: H s ho dng oxy hóa và dng kh
ox, kh: N cân bng dng oxy hóa và dng kh (mol/l)
Thay giá tr các hng s R, F, nhi 25
o
C (T = 298,15
o
i logarit neper
thành logarit thp phân (lna = 2,303. Loga) chp nhn h s ho f
ox
= f
kh
= 1, ta có
dng cân bng:
(3.3)
Vn cc là thanh kim loi M (ví d Ag,
dch mui ca nó thì:
(3.4)
Vi dung dch cha 2 dng ion có m oxy hóa khác nhau ca cùng mt kim
loi M, ví d M
m+
và M
n+
ng:
(3.5)
Th n cc t liu cho phân tích
.
3.1.2. Th n cc
Vi n cn th c thc hin bng
ng ca mn cc:
27
n cc ch th n cn th ca nó trc tip hoc gián tip ph thuc
n cht nghiên cu.
n cc n cc th n th t giá tr
n thn c n cc cn cc ch th.
n cc ch th
Yêu cu cn cc ch th: Th n cc phi lp li và thit l nhanh khi
i n cn phân tíchi vn cc ch th thì thanh kim loi nhúng vào
dung dch mui ca kim loi thun nghn cc ph bn hóa
h n cc không tác dng vi cu t khác trong dung dch nghiên cu.
Tn th n cn cc kim
lon cc ch th.
n cc kim loi loi 1 là lon cc ch to t bn hoc dây kim loi, nhúng
vào dung dch mui tan ca kim lo: Ag/AgNO
3
; Cd/Cd(NO
3
)
2
. Tuy nhiên
ch n cc kim loi ch t bc, th km, chì to
n cc long yêu cu thun nghch và cho kt qu lp li.Vi mt s
kim loi ta dùng hn hp kim loi thay cho kim lo ch tn cc n
cc hn hp cho kt qu lp li tn cc lo nh n
kim loi trong dung dch.
n cc kim loi loi 2 c ch to t các bn hoc dây kim loi có ph bên
ngoài mt lp mui ít tan ca kim loc nhúng vào mui cha anion cùng
tên trong lp phn cn cc bn cc kim loi loi hai.
n cc kim loi lon cc so sánh.
Ví d vn cc bc cloric:
AgCl (r) + e Ag (r) +Cl
-
ng trên:
E
i
= E
o
AgCl
0,0592lg Cl
-
3.1.2.2. n cc màng
n cc màng là mn cc này, hiu s n th trên
ma các pha ca vt liu ch tn cc chn li ph thuc nng
nh trong dung dch. Vt liu ch to là
màng cht rn hoc là màng cht lng có chnh. Khi vt liu màng tip
xúc vi dung dc các ion có th chuyn vào dung dch, hoc các ion cn xác
nh có th chuyn t dung d mt cn
tích trái du vn tích các ion có trong dung dch và trên m
xut hin mt hi n th mà giá tr ca hin th ph thuc ho các ion
trong dung dn cc màng làm vic không phi do phn n hóa
vn chuyn ion mà là do hiu s n th xut hin trên b m
s i cân bng dung dch nghiên cu vi dung dch ph bên trong màng.
Mt s n cc ng gp trong thc t phân tích.