bài giảng hóa học môi trường chương 3 hóa học thủy quyển
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (5.04 MB, 118 trang )
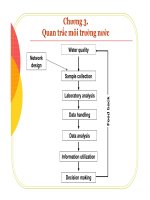
CHƯƠNG 3: HÓA HỌC THỦY QUYỂN
3.1. Sự cung ứng nước
Nước là nguồn tài nguyên vô cùng quan trọng cho tất cả các
sinh vật trên quả đất. Nếu không có nước thì chắc chắn không có
sự sống xuất hiện trên quả đất, thiếu nước thì cả nền văn minh
hiện nay cũng không tồn tại được. Từ xưa, con người đã biết đến
vai trò quan trọng của nước; các nhà khoa học cổ đại đã coi nước
là thành phần cơ bản của vật chất và trong quá trình phát triển của
xã hội loài người thì các nền văn minh lớn của nhân loại đều xuất
hiện và phát triển trên lưu vực của các con sông lớn như: nền văn
minh Lưỡng hà ở Tây Á nằm ở lưu vực hai con sông lớn là Tigre
và Euphrate (thuộc Irak hiện nay); nền văn minh Ai Cập ở hạ lưu
sông Nil; nền văn minh sông Hằng ở Ấn Ðộ; nền văn minh Hoàng
hà ở Trung Quốc; nền văn minh sông Hồng ở Việt Nam
• Nước là nguồn cung cấp thực phẩm và
nguyên liệu công nghiệp dồi dào, nước rất
quan trọng trong nông nghiệp, công
nghiệp, trong sinh hoạt, thể thao, giải trí và
cho rất nhiều hoạt động khác của con
người. Ngoài ra nước còn được coi là một
khoáng sản đặc biệt vì nó tàng trữ một
nguồn năng lượng lớn và lại hòa tan nhiều
vật chất có thể khai thác phục vụ cho nhu
cầu nhiều mặt của con người.
• Tài nguyên này không đến nỗi quá hiếm
hoi và trong chu trình tự nhiên lại có khả
năng tái tạo, nếu sử dụng khôn khéo và
quy hoạch thận trọng thì nó mãi mãi tồn tại
và phục vụ lợi ích cho con người. Nhưng
hiện nay vấn đề nước ngọt trở nên bức
bách, sự tái sinh nước ngọt không kịp đáp
ứng nhu cầu của con người ở nhiều nơi
trên thế giới nhất là ở vùng đông dân cư
và các đô thị lớn. Ðây là vấn đề hết sức
quan trọng và cấp bách đang đe dọa cuộc
sống của con người cũng như các sinh vật
3.1.1. Sự cung ứng nước trên tòan cầu
Nước bao phủ 71% diện tích của quả đất
trong đó có 97% là nước mặn, còn lại là nước
ngọt. Nước giữ cho khí hậu tương đối ổn định và
pha loãng các yếu tố gây ô nhiễm môi trường, nó
còn là thành phần cấu tạo chính yếu trong cơ thể
sinh vật, chiếm từ 50%-97% trọng lượng của cơ
thể, chẳng hạn như ở người nước chiếm 70%
trọng lượng cơ thể và ở Sứa biển nước chiếm tới
97%.
Trong 3% lượng nước ngọt có trên quả đất
thì có khoảng hơn 3/4 lượng nước mà con người
không sử dụng được vì nó nằm quá sâu trong
lòng đất, bị đóng băng, ở dạng hơi trong khí
quyển và ở dạng tuyết trên lục địa.
.
The
hydrologic
cycle
The hydrologic cycle is a conceptual model that
describes the storage and movement of water between
the biosphere, atmosphere, lithosphere, and the
hydrosphere (see Figure 8b-1). Water on this planet
can be stored in any one of the following reservoirs:
atmosphere, oceans, lakes, rivers, soils, glaciers,
snowfields, and groundwater.
Figure
8b-1:
Hydrolog
ic Cycle
Table 8b-1: Inventory of water at the Earth's surface.
Reservoir
Volume (cubic km x
1,000,000)
Percent of Total
Oceans 1370 97.25
Ice Caps and Glaciers 29 2.05
Groundwater 9.5 0.68
Lakes 0.125 0.01
Soil Moisture 0.065 0.005
Atmosphere 0.013 0.001
Streams and Rivers 0.0017 0.0001
Biosphere 0.0006 0.00004
Table 8b-2: Typical residence times of water found in various reserviors.
Reservoir Average Residence Time
Glaciers 20 to 100 years
Seasonal Snow Cover 2 to 6 months
Soil Moisture 1 to 2 months
Groundwater: Shallow 100 to 200 years
Groundwater: Deep 10,000 years
Lakes 50 to 100 years
Rivers 2 to 6 months
• On average water is renewed in rivers once every 16
days. Water in the atmosphere is completely replaced
once every 8 days. Slower rates of replacement occur
in large lakes, glaciers, ocean bodies and
groundwater. Replacement in these reservoirs can
take from hundreds to thousands of years. Some of
these resources (especially groundwater) are being
used by humans at rates that far exceed their renewal
times. This type of resource use is making this type of
water effectively nonrenewable.
c. Atmospheric Humidity
The term humidity describes the fact that the atmosphere can
contain water vapor. The amount of humidity found in air varies
because of a number of factors. Two important factors are
evaporation and condensation. At the water/atmosphere
interface over our planet's oceans large amounts of liquid water
are evaporated into atmospheric water vapor. This process is
mainly caused by absorption of solar radiation and the
subsequent generation of heat at the ocean's surface. In our
atmosphere, water vapor is converted back into liquid form
when air masses lose heat energy and cool. This process is
responsible for the development of most clouds and also
produces the rain that falls to the Earth's surface
Temperature Degrees Celsius
Vapor (g) per Kilogram of
Dry Air
50 88.12
40 49.81
30 27.69
20 14.85
10 7.76
0 3.84
Table 8c-1: Saturation mixing ratio (at 1000 mb).
• The most commonly used measure of humidity is
relative humidity (độ ẩm tương đối). Relative humidity
can be simply defined as the amount of water in the air
relative to the saturation amount the air can hold at a
given temperature multiplied by 100. Air with a relative
humidity of 50% contains a half of the water vapor it
could hold at a particular temperature. Figure 8c-1
illustrates the concept of relative humidity.
• We have learned that water is available on the Earth in the
following three forms: vapor; liquid; and solid. The process of
water moving from one of these forms to another is called a
phase or state change. In the atmosphere, three processes
act to create water droplets or ice crystals. These three
processes are:
• Condensation - water moving from a vapor to a liquid state.
• Freezing - water moving from a liquid to a solid state.
• Deposition - water moving from a vapor to a solid state
(d). Condensation, Freezing, and Deposition
Mưa acid
Figure 8h-3: Lake acidification begins with the deposition of the
byproducts acid precipitation (SO4 and H ions) in terrestrial areas
located adjacent to the water body.
In less buffered soils, vegetation is effected by acid deposition because:
• Increasing acidity results in the leaching of several important plant nutrients,
including calcium, potassium, and magnesium. Reductions in the availability
of these nutrients cause a decline in plant growth rates.
• The heavy metal aluminum becomes more mobile in acidified soils.
Aluminum can damage roots and interfere with plant uptake of other
nutrients such as magnesium and potassium.
• Reductions in soil pH can cause germination of seeds and the growth of
young seedlings to be inhibited.
• Many important soil organisms cannot survive is soils below a pH of about
6.0. The death of these organisms can inhibit decomposition and nutrient
cycling.
• High concentrations of nitric acid can increase the availability of nitrogen and
reduce the availability of other nutrients necessary for plant growth. As a
result, the plants become over-fertilized by nitrogen (a condition known as
nitrogen saturation).
• Acid precipitation can cause direct damage to the foliage on plants
especially when the precipitation is in the form of fog or cloud water which is
up to ten times more acidic than rainfall.
• Dry deposition of SO2 and NOx has been found to affect the ability of leaves
to retain water when they are under water stress.
• Acidic deposition can leach nutrients from the plant tissues weakening their
structure.
The effects of acidic deposition on humans can be divided into
three main categories. Acid deposition can influence human health
through the following methods:
• Toxic metals, such as mercury and aluminum, can be released into
the environment through the acidification of soils. The toxic metals
can then end up in the drinking water, crops, and fish, and are then
ingested by humans through consumption. If ingested in great
quantities, these metals can have toxic effects on human health. One
metal, aluminum, is believed to be related to the occurrence of
Alzheimer's disease.
• Increased concentrations of sulfur dioxide and oxides of nitrogen
have been correlated to increased hospital admissions for respiratory
illness.
• Research on children from communities that receive a high amount of
acidic pollution show increased frequencies of chest colds, allergies,
and coughs.
(m). Throughflow and Groundwater Storage
Figure 8m-1: Hydrologic movement of water beneath the Earth's surface. Water usually
enters the surface sediments as precipitation. This water then percolates into the soil
layer. Some of this water flows horizontally as throughflow. Water continuing to flow
downward eventually reaches a permanent store of water known as the groundwater.
The movement of groundwater horizontally is called groundwater flow
(o). Introduction to the Oceans
Surface
Percent of Earth’s
Total Surface Area
Area Square
Kilometers
Area Square Miles
Earth’s
Surface
Area
Covered
by Land
29.2% 148,940,000 57,491,000
Earth’s
Surface
Area
Covered
by Water
70.8% 361,132,000 139,397,000
Pacific Ocean 30.5% 155,557,000 60,045,000
Atlantic Ocean 20.8% 76,762,000 29,630,000
Indian Ocean 14.4% 68,556,000 26,463,000
Southern
Ocean
4.0% 20,327,000 7,846,000
Arctic Ocean 2.8% 14,056,000 5,426,000
Figure 8o-1: Atlantic Ocean region – Đại Tây Dương
Figure 8o
-2: Arctic Ocean region- Bắc Băng Dương(Image Source: CIA World Factbook
).
Figure 8o-3: Indian Ocean region (Image Source: CIA World Factbook).
Figure 8o-4: Pacific Ocean region (Image Source: CIA World Factbook).
(p). Physical and Chemical Characteristics of Seawater
• Seawater is a mixture of various salts and water. Most of
the water in the ocean basins is believed to originate from
the condensation of water found in the early atmosphere
as the Earth cooled after its formation. This water was
released from the lithosphere as the Earth's crust
solidified. Additional water has also been added to the
oceans over geologic time from periodic volcanic action.
Some scientists have recently speculated that comets
entering the Earth's atmosphere may be another important
source of water for the oceans
• Only six elements and compounds comprise about 99%
of sea salts: chlorine (Cl-), sodium (Na+), sulfur (SO4-2),
magnesium (Mg+2), calcium (Ca+2), and potassium (K+)
(Figure 8p-1).
Figure 8p-1: Relative proportions of dissolved salts in seawater.