Sự biến đổi tuần hoàn cấu hình e nguyên tử
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.83 MB, 18 trang )
Chào mừng quý thầy
cô tham dự tiết thao
giảng
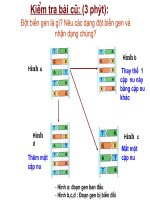
Nhiê êm vụ 1
Phân công: 8 bàn đầu tiên của hai dãy tổ chức
thành 8 nhóm. Mỗi nhóm viết cấu hình electron
nguyên tử dạng thu gọn cho các nguyên tố thuôôc
cùng môôt nhóm A và ở các chu kỳ 1,2,3,4. Đại
diêôn của các nhóm lên hoàn thành bằng phấn vào
bảng. Bốn bàn cuối hai dãy sử dụng bảng HTTH
và đối chiếu với kết quả các tổ khác để nhâôn xét.
Kết quả về số e lớp ngoài cùng trong
nguyên tử các nguyên tố nhóm A
Nhóm
Chu ky
1
2
3
4
IA
1
3
IIA IIIA IVA VA VIA
Sô e lơp ngoai cung
trong nguyên tư
1
4 cac nguyên tô nhóm A
5
6
7
8
1
2
3
4
5
có môi quan hê gi? 6
11
12
1
19
13
2
20
1
14
3
31
2
15
4
32
3
16
5
33
4
2
2
9
10
7
17
6
34
5
VIIA VIIIA
18
7
35
6
8
8
36
7
8
Nhiêêm vụ 2: suy nghĩ trả lời câu hỏi
Vì sao các nguyên tố trong cùng môôt nhóm
có tính chất hóa học gần giống nhau?
Các nguyên tố nhóm A thuôôc loại nguyên tố
nào (s,p,d,f)?
Tìm mối liên quan giữa số e hóa trị, số e lớp
ngoài cùng trong nguyên tử môôt nguyên tố
nhóm A với STT của nhóm.
Trả lời
Các nguyên tố trong cùng môôt nhóm có tính chất
hóa học gần giống nhau vì chúng có số electron
hóa trị bằng nhau.
Các nguyên tố s và p là các nguyên tố thuôôc nhóm
A trong bảng tuần hoàn, khi đó: số e hóa trị = số e
lớp ngoài cùng = STT của nhóm (trừ nguyên tố He)
Nhiêêm vụ 3: suy nghĩ trả lời câu hỏi
Hãy nêu tính chất hóa học của các nguyên tố ở chu
kỳ 2, 3, 4 theo chiều tăng dần của Z. Nhâôn xét về
sự biến đổi tính chất các nguyên tố.
Tai trên bảng.
Hoàn thành đồ thị sao tinh chât
cac nguyên tô lai biên đôi
tuân hoan khi Z tăng dân?
Khi Z vê ư
Kêt luântăng sdân,
s n thiên sô ơp ngoai p
biêô electron lelectron lơcung
trong nguyên tưccac nguyên ttư nhóm A
ngoai cung ua nguyên ô
biên đnguyên thoan, đây chinh la
cac ôi tuân ô nhóm A
nguyên nhân khiên tinh chât cac
nguyên tô biên đôi tuân hoan
Bài tâ p
ê
Nguyên tố X thuôôc nhóm IIA, chu kỳ 3 trong
bảng tuần hoàn, đâu là cấu hình electron lớp
ngoài cùng đúng của X?
A. 3s23p2
B. 3s2
C. 2s2
D. 3d2
Bài tâ êp tự luâ ên (phiếu học tâ êp)
Cho nguyên tố R có số hiêôu nguyên tử là 35.
Hãy cho biết trong nguyên tử R:
-Cấu hình e nguyên tử:
-Loại nguyên tố của R.
-Số lớp electron:
-Số electron lớp ngoài cùng là. . ., số electron
hóa trị là . . .
-Vị trí của R trong bảng tuần hoàn: ô thứ: . . .
Chu kỳ . . . Nhóm . . . .
Bài giải đúng
Nguyên tố R có số hiêôu nguyên tử là 35, trong
nguyên tử R:
-Cấu hình e nguyên tử: [Ar] 3d104s24p5
-Loại nguyên tố của R: nguyên tố p
-Số Loại nguyên tố d và f thì sao?
lớp electron: 4
-Số electron lớp ngoài cùng là 7, số electron hóa
trị là 7
-Vị trí của R trong bảng tuần hoàn: ô thứ: 35 Chu
kỳ 4 Nhóm VIIA
Nhiê êm vụ 4: suy nghĩ trả lời
Các nguyên tố d và nguyên tố f đều thuôôc nhóm
B trong bảng tuần hoàn. Hãy viết cấu hình
electron chung cho các nguyên tử các nguyên tố
d thuôôc chu kỳ 4 và chu kỳ 5.
Tại sao có thể kết luâôn các nguyên tố nhóm B
đều là kim loại?
Nêu cách xác định số electron hóa trị của các
nguyên tử nguyên tố d và f, nêu mối liên hêô với
STT của nhóm.
Câu trả lời đúng
Nguyên tố d thuôôc chu kỳ n={4,5} có cấu hình e:
[Khí hiếm] (n-1)dansb với a nhâôn từ 1 đến 10 còn
b nhâôn giá trị 1 hoăôc 2 (trừ Pd là 0)
Các nguyên tố nhóm B đều là kim loại vì số
electron lớp ngoài cùng đều bằng 1 hoăôc 2 (cá
biêôt bằng 0).
Đối với các nguyên tố d thuôôc chu kỳ n={4,5}, ta
lấy cấu hình e nguyên tử, bỏ đi phần cấu hình e
của khí hiếm đứng trước gần nó nhất ta được
phần dư. Nếu tổng số electron trong phần dư là
x:
+ x ≤ 7: số e hóa trị = x = stt nhóm
+ x={8,9,10} thì nguyên tố thuôôc nhóm VIIIB
+ x>10 thì số e hóa trị = số e lnc = stt nhóm.
Bài tâ p
ê
Nguyên tố M có cấu hình electron: [Ar] 3d54s1. Vị
trí trong bảng tuần hoàn của M là:
A. Chu kỳ 4, nhóm IB
B. Chu kỳ 4, nhóm VB
C. Chu kỳ 4, nhóm VIB
D. Chu kỳ 3, nhóm VIB
Bài tâ p tự luâ n
ê
ê
Trong nguyên tử nguyên tố Y có 4 lớp electron
và có 6 e đôôc thân. Viết cấu hình electron của Y
và xác định tên, vị trí của Y trong bảng tuần
hoàn.
Giải
Trong nguyên tử nguyên tố Y có 4 lớp electron
nên cấu hình electron của Y có dạng:
[Ar] 3da4sb4pc.
Do Y có 6 e đôôc thân nên chỉ có thể là trên 3d có
5 e đôôc thân, trên 4s có 1 e đôôc thân và như vâôy
trên 4p chưa có e.
Cấu hình electron của Y là: [Ar] 3d54s1. Ta có
ZY=EY= 24 nên Y là nguyên tố Crom. Y có Z=24,
có 4 lớp e, loại nguyên tố d, có 6 e hóa trị nên
thuôôc ô thứ 24, chu kỳ 4 và nhóm VIB trong
bảng tuần hoàn.
Giải
Trong nguyên tử nguyên tố Y có 4 lớp electron
nên cấu hình electron của Y có dạng: [Ar]
3da4sb4pc. Do Y có 6 e đôôc thân nên chỉ có thể là
trên 3d có 5 e đôôc thân, trên 4s có 1 e đôôc thân
và như vâôy trên 4p chưa có e. Cấu hình electron
của Y là: [Ar] 3d54s1. ZY=EY= 24 nên Y là nguyên
tố Crom. Y thuôôc ô thứ 24, chu kỳ 4 và nhóm
VIB trong bảng tuần hoàn.
Về nhà
Hoàn thành các bài tâôp SGK trang 44
Học thuôôc bài
Xem trước bài 11: Sự biến đổi môôt số đại lượng
vâôt lý.
Bài giảng đến đây là kết
thúc, cảm ơn sự tham dự
lắng nghe của quý Thầy cô
giáo. Kính mong có được sự
đóng góp ý kiến về bài giảng
Nghèn, tháng 10/2009
Gv: Trần Anh Sơn