Bài giảng chế biến khí : QUÁ TRÌNH HALOGEN HÓA part 6 docx
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (786.89 KB, 5 trang )
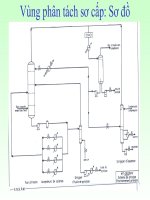
Hình 5: Sơ đồ công nghệ clo hóa Etylen sản xuất VCM
Một vài thông số:
+ Thiết bị phản ứng: t = 40 ÷ 50
o
C, p = 5 bars, xúc tác là FeCl
3
+ Độ tinh khiết của 1,2-DCE sau thiết bị phản ứng là 99% và đạt đến 99,97%
sau khi tinh chế
+ Hiệu suất quá trình rất cao: 98% so với C
2
H
4
cũng như Cl
2
.
Công nghệ mới: (sơ đồ HTC) công nghệ phổ biến nhất hiện nay là công
nghệ clo hóa nhiệt độ cao (HTC). Thiết bị phản ứng làm việc ở nhiệt độ 100
o
C và
không có sự giải nhiệt mà kết hợp nhiệt phản ứng dùng để bốc hơi DCE và chưng
tách hỗn hợp phản ứng. Tháp phản ứng được gọi là tháp CD (distillation and
catalisation).
+ Phản ứng (2): có thể tiến hành bằng 2 phương pháp
- dùng xúc tác: Al
2
O
3
có bổ sung NH
4
Cl trên than hoạt tính ở nhiệt độ 200 ÷ 300
o
C
- không dùng xúc tác: phản ứng xảy ra ở nhiệt độ 400 ÷ 500
o
C → phổ biến hơn
TBPƯ nhiệt là loại lò ống; p = 2 ÷ 3MPa; τ
lưu
= 10 ÷ 20 giây; %C = 50 ÷
60%; η
VCM
= 95 ÷ 99%
Dây chuyền này có giai đoạn tái sinh Cl
2
từ HCl theo phản ứng Deacon:
26
2 HCl + 0,5 O
2
→ Cl
2
+ H
2
O∆H
298
= - 13,7 kcal/mol
- xúc tác : CuCl
2
có bổ sung các clorua kim loại đất hiếm
- nhiệt độ : 350 ÷ 400
o
C
- áp suất : 1 ÷ 2 bars
- %C khoảng 75%
- TBPƯ loại tầng sôi
Sơ đồ Công nghệ Clo hóa hiện đại HTC
Hình6: Sơ đồ công nghệ Clo hóa Etylen HTC
2.3.3. Quá trình kết hợp hydroclo hóa và clo hóa
Để tránh sản phẩm phụ là HCl từ quá trình clo hóa C
2
H
4
, một phương pháp
cải tiến kết hợp giữa C
2
H
4
và C
2
H
2
theo một tỷ lệ hợp lý.
Các phản ứng của quá trình bao gồm:
- clo hóa etylen: CH
2
= CH
2
+ Cl
2
→ CH
2
Cl - CH
2
Cl ∆H
298
=-52 kcal/mol
- crackinh DCE: CH
2
Cl - CH
2
Cl → CH
2
= CHCl + HCl ∆H
298
=16 kcal/mol
- hydroclo hóa acetylen: CH ≡ CH + HCl → CH
2
= CHCl ∆H
298
=-24,6 kcal/mol
27
4
2
khí thải
phần nặng
1
6
5
3
C
2
H
4
Cl
2
DCE
VC
DCE chưa chuyển hóa
từ quá trình sản xuất
DCE
1. tháp phản ứng CD (xúc tác và
chưng cất)
2. thiết bị ngưng tụ
3. thiết bị phân ly
4. thiết bị làm lạnh sâu
5 tháp chưng tách VC
6. tháp tách phần nặng thu hồi DCE
Công nghệ mới cho phương pháp này dùng trực tiếp một phân đoạn dầu nhẹ
để sản xuất hỗn hợp C
2
H
4
và C
2
H
2
có thành phần thích hợp để thực hiện các phản
ứng trên mà không qua giai đoạn tách và tinh chế C
2
H
4
và C
2
H
2
mà thay thế bằng
các giai đoạn dễ dàng hơn là tách và tinh chế VC và DCE.
Quá trình Kureha sử dụng nguyên liệu là phân đoạn Naphta có sơ đồ như
trên hình vẽ sau:
Hình 7 : Quá trình Kureha sản xuất VCM từ etylen và acetylen
Quá trình này sử dụng nguyên liệu là phân đoạn Naphta, gồm các giai đoạn:
1/ Nhiệt phân bằng O
2
trong lò đốt:
Lò đốt gồm 2 phòng đặt chồng lên nhau (kiểu Wulf).
Hiệu suất nhận hỗn hợp (C
2
H
4
+ C
2
H
2
) từ 50 ÷ 53% mol
Hàm lượng của hỗn hợp (C
2
H
4
+ C
2
H
2
) trong khí sản phẩm khoảng 20%V
Thành phần của khí nhiệt phân tiêu biểu như sau:
% mol % mol
28
N
2
O
2
H
2
CO
CH
4
2,7
1,0
28,8
13,3
11,0
CO
2
C
2
H
2
C
2
H
4
C
2
+
Aromatic
21,2
9,1
10,8
1,0
1,1
2/ Nén và tinh chế (không có trong sơ đồ)
3/ Thực hiện phản ứng hydroclo hóa C
2
H
2
Tại đầu vào của thiết bị phản ứng hydroclo hóa acetylen có lắp đặt hệ thống
đo lưu lượng C
2
H
2
để điều chỉnh tỷ lệ HCl thích hợp.
Điều kiện vận hành giống phương pháp đầu tiên.
Hiệu suất VC đạt được 95 ÷ 98% theo acetylen.
4/ Thực hiện phản ứng clo hóa C
2
H
4
Phản ứng được thực hiện trong dung môi (DCE) với xúc tác FeCl
3
Lượng Cl
2
đưa vào sẽ tỷ lượng với lượng C
2
H
4
có trong hỗn hợp khí.
Nhiệt độ của thiết bị phản ứng được duy trì ở 50 ÷ 70
o
C , p = 4 ÷ 5 bars.
Hiệu suất DCE đạt được 95 ÷ 98% theo etylen.
5/ Thực hiện phản ứng crackinh DCE
Phản ứng crackinh không xúc tác được thực hiện dưới áp suất 7 bars ở
450÷550
o
C, độ chuyển hóa khoảng 60%, hiệu suất VCM khoảng 96%.
2.3.4. Quá trình oxyclo hóa etylen
Quá trình này tận dụng HCl từ nhiều quá trình sản xuất clo hóa (phản ứng
thế), quá trình nhiệt phân clorolyse có sự tách HCl để tổng hợp DCE sau đó sẽ
crackinh DCE.
Phản ứng :
CH
2
= CH
2
+ 2 HCl + 0,5 O
2
→ CH
2
Cl - CH
2
Cl + H
2
O ∆H
298
= - 65.7kcal/mol
- đây là một phản ứng tỏa nhiệt rất mạnh
- xúc tác : halogenua kim loại có hóa trị thay đổi, phổ biến nhất là CuCl
2
có
thêm một số halogenua kim loại kiềm khác trên chất mang là Al
2
O
3
.
29
- Yêu cầu nguyên liệu: C
2
H
4
sạch C
2
H
2
vì nó dễ tạo hợp chất polyclo; còn Cl
2
thì yêu cầu sạch Br
2
và các hợp chất lưu huỳnh, photpho.
- Cơ chế: phản ứng xảy ra qua 2 giai đoạn
+ giai đoạn 1: CH
2
= CH
2
+ 2 CuCl
2
→ CH
2
Cl - CH
2
Cl + Cu
2
Cl
2
+ giai đoạn 2: Cu
2
Cl
2
+ 0,5 O
2
→ CuO.CuCl
2
CuO.CuCl
2
+ 2 HCl → 2 CuCl
2
+ H
2
O
- mức độ chuyển hóa: %C
C2H2, HCl
= 93 ÷ 97%
- độ chọn lọc : %S = 91 ÷ 96%
- thiết bị phản ứng : loại ống chùm
Sơ đồ công nghệ:
30
khí thải
C
2
H
4
kk
(O
2
)
HCl
dầu
làm
lạnh
NaOH
H
2
O
2 3
6
7
8
9
4
4
phân đoạn
nhẹ (thu
hồi DCE
hoặc đốt)
DCE
nước thải (thu hồi
DCE hoặc xử lý)
dd HCl
1. thiết bị gia nhiệt 5. Thiết bị tách khí lỏng
2. thiết bị phản ứng 6. Thiết bị phân ly 2 pha lỏng
3. tháp khử HCl 7. Thiết bị rửa DCE
4. thiết bị làm lạnh ngưng tụ 8. Tháp chưng tách
9. thiết bị phân ly khí - lỏng