Bài giảng chế biến khí : QUÁ TRÌNH ALKYL HÓA part 2 pps
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (180.78 KB, 5 trang )
AlCl
3
ở trạng thái rắn hầu như không tan trong hydrocacbon và xúc tác rất
yếu cho phản ứng. Tuy nhiên theo mức độ hình thành HCl, AlCl
3
bắt đầu chuyển
qua trạng thái lỏng có màu sậm. Chất lỏng này mặc dù không tan trong
hydrocacbon nhưng có hoạt tính rất lớn và do đó tốc độ phản ứng sẽ tăng lên. Trạng
thái hoạt động của AlCl
3
có thể chuẩn bị bằng cách sục khí HCl qua hệ huyền phù
của AlCl
3
trong hydrocacbon, khi đó sẽ hình thành phức của AlCl
3
và HCl với 1 đến
6 phân tử hydrocacbon thơm, trong đó một phân tử này nằm ở trạng thái cấu trúc
đặc biệt mang điện tích dương (phức σ) còn các phân tử còn lại hình thành lớp
solvat:
Nhằm đạt được vận tốc alkyl hóa cao ngay từ thời điểm bắt đầu phản ứng,
phức này thường được chuẩn bị trước rồi sau đó đưa vào hệ phản ứng.
1.2. Cơ chế phản ứng
1.2.1. Khi tác nhân là dẫn xuất Clo RCl: xúc tác AlCl
3
sẽ hoạt hóa Cl tạo ra
phức phân cực mạnh (phức σ) và hình thành cacbocation
RCl + AlCl
3
↔ R
δ
+
→ Cl →
δ
-
AlCl
3
↔ R
+
+ AlCl
4
-
1.2.2. Khi tác nhân là olefin: xúc tác AlCl
3
sẽ kết hợp với chất đồng xúc tác là
HCl để tạo ra cacbocation
RCH = CH
2
+ HCl + AlCl
3
→ RC
+
H - CH
3
+ AlCl
4
-
Trong trường hợp này cấu tạo của nhóm alkyl trong sản phẩm được xác định
theo nguyên tắc về sự tạo thành cacbocation bền vững nhất ở giai đoạn trung gian
(bậc III > bậc II > bậc I).
1.3. Các phản ứng phụ
Các phản ứng phụ có thể xảy ra trong quá trình alkyl hóa hydrocacbon thơm:
R
R
+
H
R
+ R
+
+ H
+
. (n-1) ArH
H
H
Al
2
Cl
7
-
Alkyl hóa nối tiếp
Nhựa hóa
Phân hủy các nhóm alkyl
Polyme hóa olefin
• Phản ứng alkyl hóa nối tiếp:
Khi alkyl hóa các hợp chất thơm với sự có mặt của xúc tác bất kỳ sẽ xảy ra
sự thế nối tiếp các nguyên tử H và tạo thành hỗn hợp sản phẩm với mức độ alkyl
hóa khác nhau.
Ví dụ khi etyl hóa C
6
H
6
sẽ xảy ra đến khi tạo thành hexa etylbenzen:
Mỗi phản ứng trong dãy này đều là các phản ứng bất thuận nghịch. Tuy
nhiên khi dùng xúc tác Aluminosilicat hoặc Zeolit ở điều kiện tương đối khắc
nghiệt hoặc khi dùng xúc tác AlCl
3
thì sẽ xảy ra phản ứng thuận nghịch với sự dịch
chuyển vị trí của các nhóm alkyl:
Khả năng dịch chuyển vị trí của các nhóm alkyl được sắp xếp theo dãy:
(CH
3
)
3
C- > (CH
3
)
2
CH- > CH
3
- CH
2
- >> CH
3
-
Các khả năng hình thành sản phẩm nối tiếp:
C
6
H
6
C
6
H
5
- C
2
H
5
+ C
2
H
4
+ C
2
H
4
C
6
H
4
- (C
2
H
5
)
2
+ C
2
H
4
C
6
H
3
- (C
2
H
5
)
3
v.v.
C
6
H
4
R
2
+ C
6
H
6
2 C
6
H
5
R
C
6
H
3
R
3
+ C
6
H
6
C
6
H
5
R + C
6
H
4
R
2
+ R
+
+ R
+
R
R
+ R
+
R
R R
R
+ R
+
R
R
R
RR
R
R
RR
• Phản ứng nhựa hóa
Nguyên nhân là do các vòng thơm ngưng tụ ở nhiệt độ cao tạo thành các sản
phẩm như diarylalkan, triarylalkan, diarylolefin Nhiệt độ càng tăng phản ứng
nhựa hóa hình thành hợp chất đa vòng sẽ càng tăng.
• Phản ứng phân hủy các nhóm alkyl
Nguyên nhân là do khi điều kiện phản ứng khắc nghiệt sẽ thúc đẩy sự phân
huỷ các nhóm alkyl và tạo ra các sản phẩm phụ có mạch alkyl ngắn.
Ví dụ: + Khi C
3
H
6
phản ứng với C
6
H
6
có hình thành sản phẩm C
6
H
5
-C
2
H
5
+ Khi C
2
H
4
phản ứng với C
6
H
6
có hình thành sản phẩm C
6
H
5
-CH
3
.
Mạch alkyl càng dài càng dễ bị phân hủy. Sự phân huỷ có khả năng xảy ra ở
giai đoạn tách cacbocation.
• Phản ứng polyme hóa olefin
Nguyên nhân là do sự kết hợp nối tiếp của cacbocation với olefin (trùng hợp
cation)
Polyme sinh ra có khối lượng phân tử không lớn và có thể hạn chế bằng lượng
dư hydrocacbon thơm và giảm nồng độ olefin trong pha lỏng.
2. Thiết bị phản ứng
Hiện nay có 3 loai thiết bị phản ứng liên tục để alkyl hóa các hydrocacbon
thơm với xúc tác AlCl
3
.
H
+ 2 C
6
H
6
- H
+
RC
+
H - CH
2
R RCH = CH
2
+ R
+
C
6
H
5
- CH - CH
3
+ C
6
H
5
R
+ C
2
H
4
CH
3
- C
+
H
2
CH
3
- (CH
2
)
2
- C
+
H
2
+ C
2
H
4
CH
3
- (CH
2
)
4
- C
+
H
2
Hình 1. Các loại thiết bị phản ứng alkyl hóa hydrocacbon thơm với xúc tác AlCl
3
a. Thiết bị ống chùm - b. Hệ thiết bị nối tiếp - c. Thiết bị dạng ống
3. Công nghệ alkyl hóa các hydrocacbon thơm
Có hai hợp chất alkyl vòng thơm tiêu biểu được sản xuất với sản lượng lớn
nhất là etylbenzen và iso propylbenzen.
2.1. Tổng hợp Etylbenzen
2.1.1. Tính chất của etylbenzen
Ở điều kiện thường, etylbenzen là một chất lỏng sáng không màu, có mùi
thơm đặc trưng, có nhiệt độ sôi 136,186
o
C.
Etylbenzen gây bỏng da và mắt, trong một giới hạn nào đó cũng gây độc qua
đường hô hấp và ăn uống, đồng thời hấp phụ qua da.
Hầu hết etylbenzen (>99%) được sử dụng để sản xuất monome Styren (C
6
H
5
-
CH=CH
2
) vì nó là hợp chất chủ đạo đảm bảo điều kiện kỹ thuật cũng như thương
mại cho quá trình sản xuất styren. Đây là một monome rất quan trọng trong lĩnh vực
sản xuất chất dẻo và cao su tổng hợp. Chỉ có khoảng 1% etylbenzen được sử dụng
làm dung môi pha sơn hay làm hợp chất trung gian để sản xuất dietylbenzen và
acetophenol.
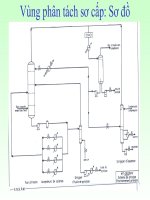
Alkylat
khí
olefin
C
6
H
6
Alkylat
C
6
H
6
tác nhân
alkyl hóa
Xúc tác
H
2
O
H
2
O
Alkylat
C
6
H
6
+ olefin (hay RCl)
+ xúc tác
a
H
2
O
b c
2.1.2. Công nghệ
Hiện nay hầu hết etylbenzen sản xuất trong thương mại đều từ quá trình alkyl
hóa benzen bằng etylen. Sự sản xuất etylbenzen tiêu thụ 50% lượng benzen trên thế
giới. Quá trình alkyl hóa này được tiến hành chủ yếu theo 2 phương pháp:
- Tiến hành trong pha lỏng với xúc tác AlCl
3
- Tiến hành trong pha hơi với xúc tác rắn tầng cố định
Phản ứng : đây là phản ứng tỏa nhiệt mạnh
C
6
H
6
+ C
2
H
4
⇔ C
6
H
5
- C
2
H
5
-∆H
0
298
= 114 kJ/mol
a. Quá trình pha lỏng
Từ những năm 1930, công nghệ alkyl hóa pha lỏng với xúc tác AlCl
3
đã
được đưa vào sử dụng với những đặc tính ưu việt. Nhiều công nghệ đã phát triển
dựa trên sự cải tiến qui trình công nghệ ban đầu này, tuy nhiên đến hiện nay qui
trình của Monsanto sử dụng xúc tác AlCl
3
là qui trình thương mại hiện đại nhất.
Quá trình alkyl hóa benzen bằng etylen trên xúc tác AlCl
3
là một phản ứng
tỏa nhiệt xảy ra rất nhanh và phần lớn tạo thành etylbenzen. Ngoài xúc tác AlCl
3
còn có nhiều xúc tác acid Lewis khác được sử dụng như AlBr
3
, FeCl
3
, BF
3
. Ngoài ra
người ta còn đưa vào những chất kích động halogen như etylclorua hay hidroclorua
có tính chất kích động xúc tác, làm giảm lượng AlCl
3
cần thiết. Cơ chế hoạt động
của hệ xúc tác AlCl
3
- HCl như sau:
C
2
H
4
+ HCl + AlCl
3
→ C
2
H
5
+
+ AlCl
4
-
C
6
H
6
+ C
2
H
5
+
+ AlCl
4
-
→ C
6
H
6
- C
2
H
5
+
- AlCl
4
-
C
6
H
6
- C
2
H
5
+
- AlCl
4
-
→ C
6
H
5
- C
2
H
5
+ AlCl
3
+ HCl
* Điều kiện vận hành phân xưởng:
• Nguyên liệu benzen phải sấy khô trước khi sử dụng (< 30 ppm H
2
O)
• Nhiệt độ t = 160 ÷ 180
o
C tương ứng với áp suất tuyệt đối p = 1.10
6
Pa
• Điều chỉnh tỷ số ε = benzen/nhóm etyl = 2 ÷ 2,5 để hiệu suất thu sản phẩm
tối đa