Axit nitric và muối nitrat(tiết 2)
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (328.72 KB, 7 trang )
`
Bài 12 AXIT NITRIC VÀ MUỐI NITRAT
Lớp 11
Tiết 1 A AXIT NITRIC
Người soạn: Đặng Thị Nhành
I. Chuẩn kiến thức và kĩ năng
1. Kiến thức
a. Học sinh biết:
+Cấu tạo phân tử, tính chất vật lí và tính chất hóa học của axit nitric.
+Biết phương pháp điều chế axit nitric trong phòng thí nghiệm và trong công nghiệp.
b. Học sinh hiểu:
+Vì sao axit nitric phản ứng với hầu hết các kim loại và đưa chúng lên mức oxi hóa cao
nhất.
+Cách xác định số oxi và phương pháp cân bằng phản ứng ion-electron.
2. Kỹ năng
+Rèn luyện kỹ năng viết phương trình của phản ứng oxi hóa – khử và giải một số bài tập
có liên quan.
+Rèn luyện kỹ năng làm thí nghiệm, quan sát và giải thích hiện tượng phản ứng.
II. Trọng tâm
+Tính chất vật lý và tính chất hóa học của axit nitric.
+Biết phương pháp điều chế axit nitric trong phòng thí nghiệm và sản xuất axit nitric
trong công nghiệp .
+Rèn luyện kỹ năng viết phương trình phản ứng oxi hóa –khử
III. Chuẩn bị
Giáo viên:
Dụng cụ: Ống nghiệm, kẹp gỗ, ống
nhỏgiọt.Hoá chất: Dung dịch axit HNO
3
loãng,dung dịch HNO
3
đặc, đồng viên.
Học sinh:
Ôn lại các kiến thức của bài amoniac và
muối amoni.
Rèn luyện kỹ năng xác định số oxi hóa
và cân bằng phản ứng oxihóa-khử
`
IV. Tổ chức hoạt động dạy học:
1. Ổn định lớp
2. Kiểm tra bài cũ
Câu hỏi 1: Viết phương trình hóa học của sơ đồ của chuyển hóa sau:
+H
2
O +HCl +Xút +HNO
3
nung
Khí A dd A B khí A C D + H
2
O.
Học sinh được gọi lên làm bài.
Sau đó giáo viên nhận xét và sửa chữa những phương trình sai.
Khí A là ammoniac NH
3
NH
3
+ H
2
O NH
4
OH
NH
4
OH + HCl NH
4
Cl + H
2
O
NH
4
Cl +NaOH NH
3
+NaCl+ H
2
O
NH
3
+ HNO
3
NH
4
NO
3
t
o
NH
4
NO
3
N
2
O+ H
2
O
Hoạt động giáo viên Hoạt động học sinh Ghi bảng
Hoạt động 1: Tìm hiểu cấu tạo
phân tử và tính chất vật lí của
axit nitric
Giáo viên giảng: Trong các axit đã
biết, axit nitric là một hóa chất cơ
bản rất quan trọng. Để biết được
những tính chất của axit nitric và
những ứng dụng trong thực tế của
nó hôm nay ta qua bài “ AXIT
NITRIC VÀ MUỐI NITRAT”,
trước tiên ta tìm hiểu về AXIT
NITRIC.
Giáo viên: Dựa vào những kiến
thức đã học hãy viết công thức
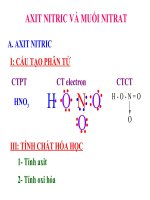
Bài 12:
AXITNITRIC VÀ MUỐI
NITRAT
A AXIT NITRIC
I.Cấu tạo hóa học
`
phân tử, công thức cấu tạo của axit
nitric và xác định hóa trị, số oxi hóa
của N trong hợp chất?
Giáo viên phân biệt hóa trị và số
oxihóa của N cho học sinh: Trong
phân tử HNO
3
, N có hóa trị 4 vì
xung quanh nguyên tử N có 4 liên
kết, nhưng N có số oxihóa là +5 và
được xác định do tổng số oxi hóa
của các nguyên tố trong hợp chất
bằng 0.
Và để tìm hiểu kĩ hơn về axit nitric
ta đi vào phần II-Tính chất vật lí.
Giáo viên cho học sinh quan sát lọ
axit và cho học sinh nêu nhận xét
về tính chất vật lí của axit nitric.
Giáo viên nói thêm một số thông
tin về axit nitric: axit nitric là chất
rất kém bền, ngay ở nhiệt độ
thường, trong điều kiện có ánh
sáng, nó phân hủy một phần và giải
phóng khí NO
2
. Khí này tan trong
trong dung dịch và làm dung dịch
có màu vàng.
CTPT: HNO
3
CTCT:
O
H – O –N
O
Hóa trị 4(học sinh có
thể nhầm là hóa trị 5)
Số oxi hóa là +5
Học sinh trả lời: axit
nitric là chất lỏng
không màu, bốc khói
mạnh trong không khí
ẩm,tan tốt trong nước
với bất kì tỉ lệ nào.
Axit nitric có khối
lượng riêng là 1,53
g/cm
3
, sôi ở 86
o
C.
O
H – O –N
O
Nitơ có số oxi hóa cao nhất của N
là +5 nhưng có hoá trị 4
II.Tính chất vật lý
+Là chất lỏng không màu, tan vô
hạn trong nước.
+D = 1,53 g/cm
3
+Nhiệt độ sôi là86
o
C
Hoạt động 2
: Tìm hi
ể
u tính
axit
của axit nitric.
Giáo viên:
Ở chương trình lớp 10 các em đã
học bài axit HCl, H
2
SO
4
. Từ kiến
thức đã học hãy nêu tính chất hóa
học chung của các axit?
HNO
3
cũng là một axit, và nó có
thể hiện đầy đủ tính chất hóa học
của một axit thông thường hay
không? Nếu có thì tính axit của
được thể hiện như thế nào?
-Làm quỳ tím hóa đỏ
-Tác dụng với kim
loại đứng trước H.
-Tác dụng với bazơ
Là axit mạnh, trong
dung dịch phân li
hoàn toàn thành H
+
và NO
3
-
. Dung dịch
III.Tính chất hóa học
1Tính axit
-Là axit mạnh.
-Phân li hoàn toàn thành H
+
và
NO
3
-
-Làm quỳ tím hóa đỏ.
-Tác dụng với oxit bazơ, bazơ và
muối.
`
Hãy viết một số phương trình phản
ứng chứng minh tính axit của
HNO
3
?
axit HNO
3
làm quỳ
tím hóa đỏ, tác dụng
được với oxit bazơ,
bazơ và muối.
(Học sinh viết ở phần
bảng ghi để làm ví
dụ)
HNO
3
+ CuO Cu(NO
3
)
2
+ H
2
O
HNO
3
+NaOH NaNO
3
+ H
2
O
HNO
3
+CaCO
3
Ca(NO
3
)
2
+CO
2
+H
2
O
Hoạt động 3:
Tìm hi
ể
u tính
oxi
hóa của axit nitric.
Giáo viên giảng: Giống như axit
sunfuric đặc, ngoài tính axit ra thì
axit nitric còn có tính oxi hóa
mạnh.
Để tìm hiểu kĩ hơn về tính oxi hóa
của axit nitric ta đi vào phần
2_Tính oxi hóa
Giáo viên đặt câu hỏi :
Dựa vào sách giáo khoa, hãy cho
biết axit nitric có thể phản ứng với
những kim loại nào?
Giáo viên giảng: Trong dung dịch
axit nitric có khả năng oxi hóa
mạnh hơn ion H
+
, nên axit nitric oxi
hóa được hầu hết các kim loại có
tính khử yếu như: Cu, Ag,…trừ Au,
Pt, để tạo muối nitrat và đưa kim
loại lên mức oxi hóa cao nhất.
Vậy khi tác dụng với kim loại có
tính khử yếu như Cu, Pb,
Ag,…ngoài sản phẩm là muối nitrat
thì còn có sản phẩm nào khác
không?
Giáo viên yêu cầu học sinh lên viết
một số phương trình chứng minh
HNO
3
oxi hóa được
hầu hết các kim
loại,kể cả những kim
loại yếu như Cu, Ag,
Pb,…trừ Au, Pt.
2.Tính oxi hóa
a)Với kim loại
-Phản ứng với hầu hết các kim loại
kể cả những kim loại có tính khử
yếu như Cu, Ag, Pb,…trừ Au,
Pt,…
+Tác dụng với
Cu, Pb,
Ag,…HNO
3
l
+2
tạo khí NO,còn HNO
3
đặc tạo khí
+4
NO
2
.
Vd:
0 +5 +2
+2
3Cu+8HNO
3(l)
Cu(NO
3
)
2
+2NO
+4H
2
O
`
tính oxi hóa của axit nitric. Xác
định số oxi hóa và cân bằng
phương trình phản ứng.
Cho học sinh một số câu thơ về cân
bằng phản ứng của HNO
3
và Cu.
-Khi tác dụng với những kim loại
có tính khử mạnh như Mg, Zn,
Al,…HNO
3
loãng có thể bị khử đến
N
2
O, N
2
, NH
4
NO
3,
Cho học sinh viết phương trình
minh họa.
(Cho Cu tác dụng với HNO
3
loãng,
đặc và Al, Zn tác dụng với HNO
3
loãng. Cho học sinh viết phương
trình ở phần ghi vở để làm ví dụ).
Giáo viên lưu ý học sinh: thực tế
Fe, Al, Cr bị thụ động trong dung
dịch HNO
3
đặc, nguội. Vì tạo nên
một màng oxit bền trên bề mặt các
kim loại này, bảo vệ kim loạ
i không
tác dụng với axit nitric mà các axit
khác chúng tác dụng dễ dàng.
Giáo viên giảng: Ngoài kim loại
thì axit nitric còn có thể oxi hóa
được những phi kim, vậy để tìm
hiểu xem sự oxi hóa phi kim có gì
khác với sự oxi hóa kim loại ta qua
phần b-Vói phi kim
HNO
3
có thể oxi hóa những phi
kim nào, cho ví dụ bằng phương
trình phản ứng?
Giáo viên giảng: Axit nitric đặc có
HNO
3
có thể tác dụng
với nhiều phi kim
như: C, S, P,…
0 +5 +2 +4
Cu+4HNO
3(đ)
Cu(NO
3
)
2
+2NO
2
3 Cu, 8 loãng, 2 NO; 1 Cu, 4 đặc
thì ra khí màu(NO
2
)
-Tác dụng với Mg, Al, Zn, HNO
3l
+1
0
có thể bị khử đến N
2
O, N
2
hoặc
-3
NH
4
NO
3
…
Vd:
0 +5 +3
8Al+30HNO
3(loãng)
8Al(NO
3
)
3
+1
+3N
2
O +15H
2
O
0 +5 +2
4Zn+10HNO
3(rất loãng)
4Zn(NO
3
)
2
-3
+NH
4
NO
3
+3H
2
O
b)Với phi kim
HNO
3
có thể tác dụng với nhiều
`
thể oxi hóa được nhiều phi kim như
C, S, P,…và đưa chúng lên mức oxi
hóa cao nhất.Tùy thuộc vào nồng
độ mà axit nitric bị khử đến NO
hoặc NO
2.
Ngoài ra axit nitric còn tác dụng
với nhiều hợp chất như H
2
S, HI,
SO
2
, FeO, muối sắt (II),…
Cho học sinh viết
phương trình để làm
ví dụ.
phi kim như: C, S, P,…
Vd:
0 +5 +6 +2
S+6HNO
3(đặc)
H
2
SO
4
+6NO
+4H
2
O
c)Với hợp chất
Tác dụng được với nhiều hợp chất
như: H
2
S, HI, SO
2
, FeO, muối sắt
(II),…
Vd:
-2 +5 0 +2
3H
2
S+2HNO
3
3S+2NO+4H
2
O
Hoạt động 4:
Tìm hi
ể
u
ứ
ng d
ụ
ng
và các phương pháp điều chế axit
nitric.
Hãy nêu một số ứng dụng của axit
nitric trong thực tế?
Với những ứng dụng quan trọng
trong thực tế như vậy thì việc điều
chế axit nitric có những đặc điêm
gì, ta qua phần điều chế.
Hãy nêu nguyên tắc điều chế axit
nitric trong phòng thí nghiệm?
Giáo viên giảng: Trong công
nghiệp người ta sản xuất axit nitric
từ ammoniac và trải qua 3 giai
đoạn:
-Oxi hóa ammoniac bằng oxi không
khí ở nhiệt độ 850-900
o
C, có mặt
xúc tác là Pt.
-Oxi hóa NO thành NO
2
.
-Chuyển hóa NO
2
thành HNO
3
Điều chế phân đạm,
sản xuất thuốc nổ,
thuốc nhuộm, dược
phẩm,…
IV.Ứng dụng
-Là hóa chất cơ bản quan trọng
-Điều chế phân đạm NH
4
NO
3
-Sản xuất thuốc nổ, phẩm nhuộm,
dược phẩm,…
V.Điều chế
1.Trong phòng thí nghiệm
t
o
NaNO
3
+H
2
SO
4 đ
HNO
3
+NaSHO
4
2.Trong công nghiệp
-Sản xuất từ ammoniac, gồm 3
giai đoạn:
+Oxi hóa NH
3
bằng oxi không khí
t
o
4NH
3
+5O
2
4NO+6H
2
O
Pt
∆H= -907KJ
+Oxi hóa NO thànhNO
2
`
bằng cách cho hỗn hợp nitơ đioxit
vừa tạo thành và oxi tác dụng với
nước sẽ thu được axit nitric.
4NO+O
2
2NO
2
+Chuyển hóa NO
2
thành HNO
3
4NO
2
+2H
2
O +O
2
4HNO
3