axit nitric và muối nitrat
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (152.29 KB, 7 trang )
SỞ GIÁO DỤC VÀ ĐÀO TẠO BÌNH ĐỊNH
Trường THPT Quốc Học Quy Nhơn
&
GIÁO ÁN DẠY HỌC
Bài 41: AXIT NITRIC VÀ MUỐI NITRAT
(tiết 1)
(tiết 1)
Tuần:… Tiết: 3 PPCT: 18 Lớp: 11NC
Giáo viên hướng dẫn: Nguyễn Thị Kim Chi
Giáo sinh thực tập : Phan Thị Kim Chi
Ngày soạn: 19/10/2013 Ngày dạy: 21/10/2013
I. MỤC TIÊU BÀI HỌC.
1. Kiến thức
· Học sinh biết :
- Cấu tạo phân tử, tính chất vật lý của axit nitric.
- Phương pháp điều chế axit nitric trong phòng thí nghiệm và trong công
nghiệp.
- Các ứng dụng của axit nitric.
· Học sinh hiểu:
- Tính axit gây ra bởi ion H
+
.
- Tính oxihóa mạnh gây ra bởi ion NO
3
-
.
- Từ cấu tạo và số oxihóa của N trong HNO
3
để suy ra tính chất hóa học của axit
nitric.
· Học sinh vận dụng:
- Nắm được tính chất của axit nitric để sử dụng an toàn.
- Viết được các phương trình phản ứng chứng minh tính axit và tính oxihoá mạnh
của HNO
3
.
- Giải các bài tập.
2. Kỉ năng.
- Rèn luyện kỉ năng viết ptpư oxi hóa – khử.
- Dự đoán sản phẩm tạo thành sau phản ứng.
- Lập luận logic: từ cấu tạo và số oxi hóa suy ra tính chất của axit nitric.
- Quan sát thí nghiệm, mô tả, giải thích hiện tượng, rút ra những kết luận.
3. Thái độ.
- Cần cẩn thận khi tiếp xúc với HNO
3
, đặc biệt là HNO
3
đặc.
- Thấy được tầm quan trọng của axit nitric trong cuộc sống.
- Có ý thức giữ dìn an toàn khi làm việc với hợp chất và bảo vệ môi trường.
4. Trọng tâm.
Tính chất hóa học của axit nitric.
II. CHUẨN BỊ
· Giáo viên:
- Sgk, giáo án
· Học sinh:
- Ôn lại phương pháp cân bằng phản ứng oxi hóa – khử
- Ôn lại tính chất của axit và xem trước bài axit.
1
III. PHƯƠNG PHÁP VÀ PHƯƠNG TIỆN DẠY HỌC
- Đàm thoại, nêu và giải quyết vấn đề.
IV. THIẾT KẾ CÁC HOẠT ĐỘNG DẠY HỌC
Thời
gian
Hoạt động thầy - trò Nội dung bài học
Hoạt động 1: kiểm tra bài cũ
Viết các phản ứng: HNO
3
+ NaOH →
HNO
3
+ CuO →
HNO
3
+ Na
2
CO
3
→
Hoạt động 2: vào bài mới
Ở những bài trước chúng ta đã được học các hợp chất của nitơ như amoniac có
tính bazơ và tính khử, muối amoni có tính axit, hôm nay chúng ta sẽ nghiên
cứu thêm một hợp chất nữa của nitơ xem nó có những tính chất gì ? Có gì
giống và khác với các chất trên ?
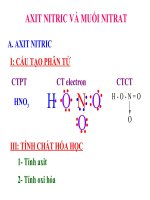
Hoạt động 3 : CẤU TẠO PHÂN TỬ
Viết công thức electron, công thức
cấu tạo của HNO
3
.
Xác định số oxi hóa, hóa trị của nitơ
?
I. CẤU TẠO PHÂN TỬ
CTPT: HNO
3
Số oxi hóa: +5; hóa trị: IV
Hoạt động 4: TÍNH CHẤT VẬT LÝ
Axit nitric là 1 loại axit cũng khá
quen thuộc với chúng ta, vậy em
hãy dựa vào sự hiểu biết của mình
để cho cô biết tính chất vật lý của
axit nitric?
Tại sao dd axit nitric thường có màu
vàng nâu?
Vậy khi bảo quản cần chú ý điều
gì ?
Cần cất giữ axit trong bình sẫm
II. TÍNH CHẤT VẬT LÝ
Là chất lỏng không màu, bốc khói trong
không khí ẩm
Không bền dễ bị nhiệt hoặc ánh sáng
phân hủy→ dd màu vàng.
2
H
O N
O
O
CT electron
N
O
O
O
H
+5
CTCT
màu, bọc bằng giấy đen, tránh ánh
sáng…
Axit HNO
3
có tan trong nước
không? Vì sao?
Phân tử phân cực nên tan tốt trong
nước.
Tan trong nước với bất kỳ tỉ lệ nào, D =
1,53g/cm
3
, t
s
= 86
0
C.
-
Hoạt động 5: TÍNH CHẤT HÓA HỌC
Em hãy dự đoán tính chất hóa học
của axit nitric ?
III. TÍNH CHẤT HÓA HỌC
- Tính axit.
- Tính oxi hóa.
Hoạt động 6: TÍNH AXIT
Tính axit của axit nitric như thế
nào? Vì sao?
Có vì oxi có độ âm điện lớn hút e về
phía mình, liên kết O- H bị phân cực
mạnh→ dễ tách H
+
→ tính axit
mạnh.
Hãy nêu tính chất chung của một
axit ? Viết phản ứng minh họa ?
Kết luận: HNO
3
có tính axit mạnh.
1. Tính axit.
Là một axit mạnh có đầy đủ tính chất
của một axit:
HNO
3
→ H
+
+ NO
3
-
Làm quỳ hóa đỏ, tác dụng với oxit bazơ,
bazơ, muối (của axit yếu hơn)
2HNO
3
+ MgO →Mg(NO
3
)
2
+ H
2
O
2HNO
3
+ Ca(OH)
2
→Ca(NO
3
)
2
+ H
2
O
HNO
3
+ CaCO
3
→ Ca(NO
3
)
2
+ CO
2
+
H
2
O
Hoạt động 7: TÍNH OXI HÓA
? Ngoài tính axit ra thi axit HNO
3
còn có tính chất gì? Vì sao? Tính
chất đó được biểu hiện như thế
nào?
- Gợi ý: dựa vào cấu tạo của
HNO
3
để giải thích ?
- Cã tÝnh oxi ho¸ m¹nh, v× nit¬
2. Tính oxi hóa
Tính oxi hóa mạnh
3
trong phân tử có số oxi hoá cao
nhất. Trong các phản ứng nó có
thể bị khử xuống các mức +4;
+3; +2; +1; 0; -3.
Hot ng 8: VI KIM LOI (tr Au, Pt)
Trong dd HNO
3
cú tớnh oxi húa do
cú H
+
v NO
3
-
, nhng kh nng oxi
húa ca NO
3
-
mnh hn nờn HNO
3
oxi húa c hu ht cỏc kim loi
(tr Au, Pt).
Tựy bn cht kim loi v nng
axit m to sn phm khỏc nhau:
+ HNO
3
c => NO
2
+ HNO
3
loóng => NO (kim loi cú
tớnh kh yu), N
2
O, N
2
, hoc
NH
4
NO
3
Vớ d:
Cu + 4HNO
3
Cu(NO
3
)
2
+ 2NO
2
+ 2H
2
O
3Cu +8HNO
3
loóng
3Cu(NO
3
)
2
+
2NO
+ H
2
O
Tng t hóy d oỏn sn phm v
hon thnh cỏc phng trỡnh sau:
Al + HNO
3 loóng
8Al(NO
3
)
2
+
3N
3
O
+ 15H
2
O
Zn + HNO
3rt loóng
4Zn(NO
3
)
2
+
NH
4
NO
3
+ 3H
2
O
- Al, Fe th ng vi HNO
3
c
B sung thờm: Al, Fe th ng vi
HNO
3
c nhng nu dựng hn hp
1HNO
3
:3HCl nc cng
thy hũa tan c Au, Pt.
a. Phn ng vi kim loi (tr Au, Pt)
Phn ng khụng gii phúng H
2
do
NO
3
-
cú kh nng oxi húa mnh hn H
+
.
Tựy bn cht kim loi v nng axit
m to sn phm khỏc nhau
PTTQ:
2
3 3 n 2 2
2 4 3
NO
M + HNO M(NO ) + NO,N O, + H O
N ,NH NO
(n l húa tr cao nht v bn ca kim
loi)
Chỳ ý:
- Al, Fe th ng vi HNO
3
c, ngui.
- Nc cng thy (1HNO
3
:3HCl) hũa
tan c Au, Pt.
4
Hoạt động 9: VỚI PHI KIM
Khi đun nóng, axit nitric tác dụng
được với nhiều phi kim như C, S,
P….
Hãy dự đoán sản phẩm và hoàn
thành các phương trình sau:
C, S + HNO
3(đặc)
Chú ý: axit đặc NO
2
axit loãng NO
Các phi kim oxi hóa bị oxi hóa đến
số oxh cao nhất.
Kết luận: HNO
3
tác dụng được với
nhiều số phi kim và đưa phi kim lên
số oxh cao nhất
b. Phản ứng với phi kim
HNO
3
đ oxi hóa được các phi kim như:
C, P, S,… đến số oxh cao nhất.
S + 6HNO
3(đặc)
H
2
SO
4
+ 6NO
2
+2 H
2
O
3C + 4HNO
3(loãng)
3CO
2
+ 4NO +
2H
2
O
Hoạt động 10: VỚI HỢP CHẤT
Axit HNO
3
có tính oxi hóa tác dụng
được với các hợp chất có tính khử
như HI, H
2
S…
Ví dụ :
3H
2
S + 2HNO
3
3S + 2NO +
4H
2
O
Kết luận: Axit HNO
3
oxihoá được
nhiều hợp chất.Tùy nồng độ axit mà
có sản phẩm khí tạo ra.Một số hợp
chất hữu cơ bị phá hủy ( vải,
giấy…) khi tiếp xúc với HNO
3
.
c. Tác dụng với hợp chất.
Axit HNO
3
oxihóa một số hợp chất có
tính khử: FeO, H
2
S, HI, SO
2
… chuyển
lên mức oxihóa cao hơn.
Một số hợp chất hữu cơ bị phá hủy
( vải, giấy…) khi tiếp xúc với HNO
3
.
Ví dụ:
3H
2
S + 2HNO
3
3S + 2NO + 4H
2
O
Hoạt động 11: ỨNG DỤNG
Dựa vào sgk và tìm trong thực tế
một số ứng dụng của axit nitric ?
+ Là hợp chất quan trọng trong
phòng thí nghiệm.
+Ứng dụng nhiều trong công
IV. ỨNG DỤNG. (SGK)
5
nghiệp: phân đạm, phẩm nhuộm,
thuốc nổ…
Hoạt động 12: ĐIỀU CHẾ
Dựa vào hình 2.9 sách giáo khoa
hãy nêu cách điều chế HNO3 trong
phòng thí nghiệm.
- Cho NaNO3 rắn hoặc KNO3 rắn
tác dụng với axit H2SO4đặc, nóng:
NaNO3 + H2SO4 HNO3 +
NaHSO4
Hơi HNO3 được dẫn vào bình làm
lạnh và ngưng tụ ở đó.
Trong công nghiệp, người ta điều
chế axit nitric từ nguyên liệu nào ?
có mấy giai đoạn ? viết các ptpư.
- Đi từ amoniac. Có 3 giai đoạn:
+ oxi hóa khí amoniac bằng oxi
không khí
+ oxi hóa NO thành NO
2
+ chuyển hóa NO
2
thành HNO
3
V. ĐIỀU CHẾ
1. Trong phòng thí nghiệm.(sgk)
2. Trong côngnghiệp. (sgk)
CŨNG CỐ: Qua bài này chúng ta cần nắm vững:Công thức cấu tạo, tính chất vật lí, tính
chất hóa học của HNO
3
- Tính axit mạnh
- Tính oxi hóa mạnh
Tính chất của axit nitric loãng và axit nitric đặc có gì khác nhau.
V. RÚT KINH NGHIỆM, BỔ SUNG
6
VI. NHẬN XÉT CỦA GIÁO VIÊN HƯỚNG DẪN
Ngày … tháng … năm 2013 Ngày…tháng… năm 2013
DUYỆT GIÁO ÁN CỦA GV HƯỚNG DẪN SINH VIÊN THỰC TẬP
(Ký, ghi rõ họ tên) (Ký, ghi rõ họ, tên)
Nguyễn Thị Kim Chi Phan Thị Kim Chi
7