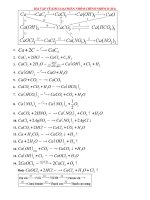Nhom IIA.EXE
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (757.66 KB, 16 trang )
KIỂM TRA BÀI CŨ
Viết phương trình thực hiện dãy chuyển hoá sau :
(Ghi rõ điều kiện phản ứng nếu có)
Na → NaOH → NaHCO
3
→ Na
2
CO
3
→ CO
2
(1) (2) (3) (4)
NaCl → Na
(5) (6)
ĐÁP ÁN
(1) 2Na + 2H
2
O → 2NaOH + H
2
↑
(2) NaOH + CO
2
→ NaHCO
3
(3) NaHCO
3
+ NaOH → Na
2
CO
3
+ H
2
O
(4) Na
2
CO
3
+ 2HCl → 2NaCl + H
2
O + CO
2
↑
(5) NaOH + HCl → NaCl + H
2
O
(6) NaCl → Na + Cl
2
↑
đpnc
Tiết 43 – Bài 26
KIM LOẠI KIỀM THỔ
VÀ HỢP CHẤT QUAN TRỌNG
CỦA KIM LOẠI KIỀM THỔ
A. KIM LOẠI KIỀM THỔ
I. VỊ TRÍ TRONG BẢNG TUẦN HOÀN, CẤU HÌNH
ELECTRON NGUYÊN TỬ
* Vị trí
- Kim loại kiềm thổ thuộc nhóm IIA của BTH
- Gồm các nguyên tố : Beri (Be), magie (Mg), canxi
(Ca), stronti (Sr), bari (Ba) và rađi (Ra).
* Cấu hình electron
Be : [He]2s
2
Mg : [Ne]2s
2
Ca : [Ar]2s
2
Sr : [Kr]2s
2
Ba : [Xe]2s
2
→ Là nguyên tố s. Cấu hình electron
ngoài cùng tổng quát : ns
2
.
II. TÍNH CHẤT VẬT LÍ
Nguyên
tố
Nhiệt
độ nóng
chảy
(
o
C)
Nhiệt
độ sôi
(
o
C)
Khối
lượng
riêng
(g/cm
3
)
Kiểu mạng tinh
thể
Be 1280 2770 1,85 Lục phương
Mg 650 1110 1,74 Lục phương
Ca 838 1440 1,55 LP tâm diện
Sr 768 1380 2,6 LP tâm diện
Ba 714 1640 3,5 LP tâm khối
II. TÍNH CHẤT VẬT LÍ
- Màu trắng bạc, có thể dát mỏng.
- Nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại
kiềm thổ tuy có cao hơn các kim loại kiềm nhưng vẫn
tương đối thấp.
- Khối lượng riêng tương đối nhỏ, nhẹ hơn nhôm (trừ Ba).
- Độ cứng cao hơn các kim loại kiềm nhưng vẫn tương
đối mềm.
Nhiệt độ nóng chảy, nhiệt độ sôi và khối
lượng riêng của các kim loại kiềm thổ không biến đổi
theo một quy luật nhất định như các kim loại kiềm là
do các kim loại kiềm thổ có kiểu mạng tinh thể
không giống nhau.
* Giải thích :
III. TÍNH CHẤT HOÁ HỌC
- Các nguyên tử kim loại kiềm thổ có năng lượng ion
hoá tương đối nhỏ, vì vậy kim loại kiềm thổ có tính
khử mạnh. Tính khử tăng dần từ Be đến Ba.
M → M
2+
+ 2e
- Trong các hợp chất các kim loại kiềm thổ có số oxi
hoá +2.
1. Tác dụng với phi kim
-
Với oxi → Oxit bazơ
2M + O
2
→ 2MO
0 +2
2Mg + O
2
→ 2MgO
0 0 +2 -2
III. TÍNH CHẤT HOÁ HỌC
1. Tác dụng với phi kim
-
Với oxi → Oxit bazơ
2M + O
2
→ 2MO
0 +2
-
Với phi kim khác → Muối
Mg + Cl
2
→ MgCl
2
0 0 +2 -1
M + Cl
2
→ MCl
2
0 +2
III. TÍNH CHẤT HOÁ HỌC
1. Tác dụng với phi kim
-
Với oxi : → Oxit bazơ
2M + O
2
→ 2MO
0 +2
-
Với phi kim khác : → Muối
M + Cl
2
→ MCl
2
0 +2
2. Tác dụng với dung dịch axit
-
Với axit HCl, H
2
SO
4
loãng : → Muối + H
2
↑
Mg + 2HCl → MgCl
2
+ H
2
↑
0 +1 +2 0
M + 2H → M + H
2
↑
0 + +2 0
Mg + H
2
SO
4
(loãng) → MgSO
4
+ H
2
↑
0 +1 +2 0
III. TÍNH CHẤT HOÁ HỌC
1. Tác dụng với phi kim
2. Tác dụng với dung dịch axit
-
Với axit HCl, H
2
SO
4
loãng : → Muối + H
2
↑
M + 2H → M + H
2
↑
0 + +2 0
-
Với axit HNO
3
, H
2
SO
4
đặc :
4Mg + 5H
2
SO
4
(đặc) → 4MgSO
4
+ H
2
S↑+4H
2
O
0 +6 +2 -2
4M + 10HNO
3
(loãng) → 10M(NO
3
)
2
+ NH
4
NO
3
+3H
2
O
0 +5 +2 -3
4Mg + 10HNO
3
(loãng) → 10Mg(NO
3
)
2
+ NH
4
NO
3
+3H
2
O
0 +5 +2 -3
4M + 5H
2
SO
4
(đặc) → 4MSO
4
+ H
2
S↑+4H
2
O
0 +6 +2 -2
* Kim loại kiềm thổ có thể khử N
+5
trong HNO
3
loãng xuống N
-3
, S
+6
trong H
2
SO
4
đặc xuống S
-2
III. TÍNH CHẤT HOÁ HỌC
1. Tác dụng với phi kim
2. Tác dụng với dung dịch axit
3. Tác dụng với nước
* Ở nhiệt độ thường Be không khử được nước, Mg
khử chậm. Các kim loại còn lại khử mạnh nước giải
phóng khí H
2
.
Ca + 2H
2
O → Ca(OH)
2
+ H
2
↑
CỦNG CỐ
1. Xếp các kim loại kiềm thổ theo chiều tăng của
điện tích hạt nhân, thì
A. bán kính nguyên tử giảm dần.
B. năng lượng ion hoá giảm dần.
C. tính khử giảm dần.
D. khả năng tác dụng với nước giảm dần.
2. Chỉ dùng thêm một thuốc thử nào cho dưới đây để có
thể nhận biết được ba lọ mất nhãn chứa các dung
dịch : H
2
SO
4
, BaCl
2
, Na
2
SO
4
A.Quỳ tím
B. Bột kẽm
C. Na
2
CO
3
D. Quỳ tím hoặc bột kẽm hoặc Na
2
SO
4
CỦNG CỐ
Cho 2 g một kim loại nhóm IIA tác dụng hết với dung
dịch HCl tạo ra 5,55g muối clorua. Kim loại đó là kim
loại nào sau đây ?
A. Be B. Mg D. Ba
THẢO LUẬN NHÓM
C.Ca
HƯỚNG DẪN GIẢI
R + 2HCl → MCl
2
+ H
2
↑
M
R
(g) (M
R
+ 71) (g)
2 (g) 5,55 (g)
→ 5,55 M
R
= 2 . (M
R
+ 71)
→ M
R
= 40 → R là Ca)
DẶN DÒ
- Học thuộc lí thuyết
-
Làm bài tập : 6 SGK(119)
- Làm bài tập : 6.15 – 6.17 SBT(48)
-
Chuẩn bị tiếp phần : Kim loại kiềm và hợp
chất quan trọng của kim loại kiềm thổ