MA TRẬN đề KIỂM TRA học kì II hóa học 10
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (98.65 KB, 3 trang )
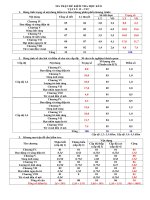
MA TRẬN ĐỀ KIỂM TRA HỌC KÌ II HÓA HỌC 10 ( LỚP THUẬN HÒA)
CẤP ĐỘ KIẾN
THỨC
BIẾT
HIỂU
CHƯƠNG IV:
PHẢN ỨNG OXI
HÓA – KHỬ
Câu 1, 2, 4
CHƯƠNG V:
8, 9, 10, 11, 15,
16, 18
NHÓM HALOGEN
6, 7
3, 5
3 câu
13, 17
CHƯƠNG VII:
Câu 19
1 câu
Câu 29
10 câu
2 câu
1 câu
Câu 24, 27, 28
3,33 điểm
11 câu
3 câu
Câu 30
1 câu
12 câu
3,67 điểm
2 câu
1 câu
12 câu
40,0%
TỔNG ĐIỂM
2,33 điểm
7 câu
TỐC ĐỘ PHẢN
ỨNG VÀ CÂN
BẰNG HÓA HỌC
TỈ LỆ
2 câu
12
Câu 14, 20, 21,
22, 23,25, 26
TỔNG ĐIỂM
7 câu
2 câu
7 câu
CHƯƠNG VI:
NHÓM OXI – LƯU
HUỲNH
VẬN DỤNG
4,0 điểm
0,67điểm
6 câu
40,0%
4,0 điểm
30 câu
20,0%
2,0 điểm
10 điểm
100%
10 điểm
ĐỀ KIỂM TRA HÓA HỌC 10 HỌC KÌ II
NĂM HỌC 2013 – 2014
Thời gian làm bài: 45 phút
Cho H: 1;
O: 16;
Cl: 35,5;
Fe: 56;
Zn : 65
Câu 1. Cho các phản ứng sau: Phản ứng nào là phản ứng oxi hóa – khử?
o
t
A. 2HgO →
2Hg + O2
o
o
t
B. CaCO3 →
CaO + CO2
o
t
t
C. Al(OH)3 →
Al2O3 + 3H2O
D. 2NaHCO3 →
Na2CO3 + CO2 + H2O
Câu 2. Theo quan niệm mới, quá trình oxi hóa là quá trình
A. Thu electron.
B. nhường electron.
C. kết hợp với oxi.
D. khử bỏ oxi.
Câu 3. Số mol electron cần dùng để khử 0,75 mol Al2O3 thành Al là
A. 0,5 mol.
B. 1,5 mol.
C. 3,0 mol.
D. 4,5 mol.
Câu 4. Trong phản ứng: 2Na + Cl2 → 2NaCl, các nguyên tử Na
A. bị oxi hóa.
B. Bị khử.
C. vừa bị oxi hóa, vừa bị khử.
D. không bị oxi hóa, không bị khử.
Câu 5. Cho phản ứng: M2Ox + HNO3 → M(NO3)x + ...
Phản ứng trên thuộc loại phản ứng trao đổi khi x có giá trị là bao nhiêu?
A. x = 1.
B. x = 2.
C. x = 1 hoặc x = 2.
D. x = 3.
Câu 6. Cho phản ứng: Zn + CuCl2 → ZnCl2 + Cu
Trong phản ứng này, 1 mol ion Cu2+
A. đã nhận 1 mol electron.
B. đã nhận 2 mol electron.
C. đã nhường 1 mol electron.
D. đã nhường 2 mol electron.
Câu 7. Trong các phản ứng dưới đây, phản ứng nào không phải là phản ứng oxi hóa – khử?
A. Fe + 2HCl → FeCl2 + H2↑
B. FeS + 2HCl → FeCl2 +H2S↑
C. 2FeCl3 + Cu → 2FeCl2 + CuCl2
D. Fe + CuSO4 → FeSO4 + Cu
Câu 8. Kim loại nào sau đây tác dụng với dung dịch HCl loãng và tác dụng với khí Cl 2 cho cùng loại
muối clorua kim loại?
A. Fe.
B. Cu
C. Zn
D. Ag
Câu 9. Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen (F2, Cl2, Br2, I2):
A. Ở điều kiện thường là chất khí
B. Có tính oxi hóa mạnh
C. Vừa có tính oxi hóa, vừa có tính khử
D. Tác dụng mạnh với nước
Câu 10. Dung dịch axit nào sau đây không thể chứa trong bình thủy tinh?
A. HCl.
B. HF.
C. HNO3.
D. H2SO4.
Câu 11. Dãy axit nào sau đây được sắp xếp đúng theo thứ tự tính axit giảm dần?
A. HI, HBr, HCl, HF.
B. HCl, HBr, HI, HF.
C. HBr, HI, HF, HCl.
D. HF, HCl, HBr, HI.
Câu 12. Trong phòng thí nghiệm, khí clo thường được điều chế bằng cách oxi hóa hợp chất nào sau
đây?
A. NaCl.
B. KClO3.
C. HCl.
D. KMnO4.
Câu 13. Đổ dung dịch AgNO3 vào dung dịch muối nào sau đây sẽ không có phản ứng?
A. NaF
B. NaCl
C. NaI
D. NaBr
Câu 14. Kim loại nào sau đây khi tác dụng với dung dịch H 2SO4 loãng và H2SO4 đặc đều cho cùng
một loại muối?
A. Fe
B. Cu
C. Al
D. Ag
Câu 15. Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm VIIA (halogen) là:
A. ns2np4
B. ns2np5
C. ns2np3
D. ns2np6
Câu 16. Ở trạng thái cơ bản, nguyên tử của các halogen có số electron độc thân là:
A. 1
B. 5
C. 3
D. 7
Câu 17. Không tìm thấy đơn chất halogen trong tự nhiên bởi chúng có:
A. Khả năng nhận electron
B. Tính oxi hóa mạnh
C. Số electron độc thân như nhau
D. Một lí do khác
o
Câu 18. Dung dịch HCl đặc nhất ở 25 C có nồng độ
A. 27%
B. 47%
C. 37%
D. 33%
Câu 19. Khí nào sau đây không cháy trong oxi không khí:
A. CO
B. CH4
C. H2
D. CO2
Câu 20. Lưu huỳnh tác dụng với axit sunfuric đặc, nóng: S + H2SO4 → 3SO2 + 2H2O
Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa
là
A. 2 : 1
B. 1 : 2
C. 1 : 3
D. 3 : 1
Câu 21. Dãy đơn chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. S, Br2, Cl2
B. Cl2, O3, S
C. Na, F2, S
D. Br2, O2, Ca
Câu 22. Cho phản ứng hóa học:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Câu nào sau đây diễn tả đúng tính chất các chất phản ứng?
A. Cl2 là chất oxi hóa, H2S là chất khử.
B. H2S là chất oxi hóa, Cl2 là chất khử.
C. H2S là chất khử, H2O là chất khử.
D. Cl2 là chất oxi hóa, H2O là chất khử.
Câu 23. Số oxi hóa của lưu huỳnh trong một loại hợp chất oleum H2S2O7 là
A. +2.
B. +6.
C. +4.
D. +8.
Câu 24. Hấp thụ hoàn toàn 2,24 lít SO2 (đktc) vào 100 ml dung dịch NaOH 1,5 M. Muối thu được
gồm:
A. Na2SO4
B. NaHSO3
C. Na2SO3
D. NaHSO3 và Na2SO3
Câu 25. Khí oxi điều chế được có lẫn hơi nước. Dẫn khí oxi ẩm đi qua chất nào sau đây để được khí
oxi khô?
A. Al2O3.
B. Dung dịch HCl. C. Dung dịch Ca(OH)2.
D. CaO.
Câu 26. Chất nào sau đây vừa có tính oxi hóa vừa có tính khử?
A. H2S.
B. O3.
C. SO2.
D. H2SO4.
Câu 27. Số mol H2SO4 cần dùng để pha chế 5 lít dung dịch H2SO4 2 M là
A. 10 mol.
B. 2,5 mol.
C. 5,0 mol.
D. 20mol.
Câu 28. Một hỗn hợp gồm 13 g kẽm và 5,6 g sắt tác dụng với dung dịch axit sunfuric loãng, dư.
Thể tích khí hiđro (đktc) được giải phóng sau phản ứng là
A. 4,48 lít.
B. 6,72 lít.
C. 2,24 lít.
D. 67,2 lít.
Câu 29: Cho các yếu tố sau: (1) nồng độ, (2) áp suất, (3) nhiệt độ, (4) diện tích tiếp xúc, (5) chất xúc
tác. Yếu tố ảnh hưởng đến tốc độ phản ứng là:
A. (1) (2) (3) (4) (5)
B. (1) (2) (3) (4)
C. (1) (3) (5)
D. (2) (3) (4) (5)
Câu 30: Đối với phản ứng có chất khí tham gia:
A. Khi áp suất tăng, tốc độ phản ứng tăng.
B. Khi áp suất tăng, tốc độ phản ứng giảm.
C. Khi áp suất giảm, tốc độ phản ứng tăng.
D.Áp suất không ảnh hưởng đến tốc độ phản
ứng
-----HẾT-----