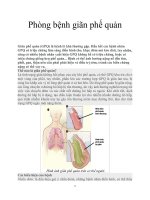
Bệnh học giãn phế quản
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.04 MB, 33 trang )
MỤC LỤC
Trang
2
1. Định nghĩa giãn phế quản
Bệnh giãn phế quản (GPQ) được định nghĩa là tình trạng phế quản bị giãn không hồi
phục do sự phá hủy các thành phần cơ và đàn hồi của thành phế quản[18, 29]. Mặc dù là
bệnh có khả năng gây ra các tình trạng nguy hiểm cho bệnh nhân nhưng thời gian trước đây
GPQ ít được quan tâm và tất cả các khuyến cáo về chẩn đoán, điều trị, dự phòng GPQ đều
dựa trên các khuyến cáo của bệnh xơ nang phổi bởi vì bệnh xơ nang phổi có cơ chế sinh
bệnh khá giống với GPQ[35]. Chỉ trong vài năm gần đây, GPQ mới được tìm hiểu nhiều và
các nhà khoa học nhận thấy rằng GPQ là một bệnh hoàn toàn không liên quan đến bệnh xơ
nang phổi, do đó bệnh GPQ còn được gọi là GPQ không xơ nang[25].
2. Dịch tễ học giãn phế quản
Mặc dù các nhà khoa học nhận thấy bệnh GPQ có xu hướng tăng lên tại nhiều quốc
gia, nhưng số liệu về số hiện mắc GPQ trên phạm vi toàn cầu hiện vẫn chưa thể chứng minh
điều này. Hầu như số liệu về GPQ chỉ được báo cáo tại các nước phát triển, còn tại các nước
đang phát triển vì thiếu việc chuẩn hóa trong chăm sóc y tế và việc tiếp cận kém với các dịch
vụ chăm sóc y tế nên việc thu thập số liệu về GPQ gặp rất nhiều khó khăn.
Một nghiên cứu tại Phần Lan báo cáo tỷ suất mắc mới GPQ tại nước này là
3,9/100.000 dân/năm trong dân số chung và 0,49/100.000 dân/năm ở những người có độ tuổi
< 15[4]. Tại Mỹ, thống kê cho thấy ước tính có khoảng 110.000 người mắc bệnh. Số liệu
thống kê cũng cho thấy bệnh phổ biến ở người lớn tuổi khi nhóm tuổi 18-34 chỉ có tỷ suất
mắc GPQ là 4,2 ca/100.000 dân còn nhóm tuổi > 75 có tỷ suất mắc lên đến 272 ca/100.000
dân[38]. Một nghiên cứu khác tại Mỹ còn cho thấy số nhập viện do GPQ không ngừng tăng
lên từ năm 1993 đến 2006 và đến nay số nhập viện đã là 16,5/100.000 dân[32]. Tại Anh ước
tính có từ 1,06 đến 1,3 ca/100.000 dân[6]. Một nghiên cứu tại New Zealand ước tính tỷ suất
mắc mới ở trẻ em là 3,7 ca/100.000 dân, và số mắc mới thay đổi tùy theo dân tộc với tỷ suất
mắc cao nhất ở trẻ em Thái Bình Dương là 17,8 ca/100.000 dân[37]. Tại Úc, một nghiên cứu
cho thấy trẻ em bản xứ Úc có tỷ suất mắc rất cao lên đến 1.470/100.000 dân, tuy nhiên tỷ
suất ước tính cho cả nước Úc cho đến nay vẫn chưa tính được[7]. Từ các nghiên cứu trên,
một nhận xét đưa ra là một số nhóm dân chẳng hạn như người bản xứ Alaska, người Maori
tại New Zealand, và người bản xứ Úc có tỷ lệ mắc bệnh rất cao. Về số tử vong do bệnh
3
GPQ, một nghiên cứu tại Anh và xứ Wales có phân tích tỷ lệ tử vong do GPQ và nhận thấy
tỷ lệ này tăng lên khoảng 3% mỗi năm (từ 2001 – 2007). Tuy nhiên việc ước tính số tử vong
gặp nhiều khó khăn vì đa số người mắc bệnh thường không đến khám tại bệnh viện[30].
3. Sinh bệnh học giãn phế quản
Việc nghiên cứu cơ chế sinh bệnh học của GPQ có lẽ phát triển mạnh trong giai đoạn
1930 – 1960. Nghiên cứu nổi bật nhất trong giai đoạn này chính là nghiên cứu của Reid vào
năm 1950 thông qua việc giải phẩu tử thi phát hiện các hình thái khác nhau của GPQ. Theo
Reid, GPQ có ba hình thái đặc trưng sau đây: 1) dạng ống với đặc trưng là phế quản giãn
theo kiểu duỗi thẳng, 2) dạng co giãn với đặc trưng phế quản lúc co lúc giãn không theo quy
luật và 3) dạng nang với đặc trưng phế quản bị giãn có dạng nang chùm[29]. Trong ba dạng
này, dạng ống sau này thông qua chụp cắt lớp độ phân giải cao (HRCT) được phát hiện là
dạng phổ biến nhất.
Đến năm 1952, Whitwell tiến hành một loạt các nghiên cứu trên 200 mẫu bệnh phẩm
phổi thu được sau phẫu thuật để tìm hiểu cơ chế bệnh sinh của GPQ[39]. Whitwell nhận
thấy có hiện tượng viêm nhiễm nghiêm trọng tại thành phế quản, chủ yếu là tại đường hô
hấp nhỏ. Hiện tượng phế quản giãn được mô tả là khiếm khuyết hoặc mất hẳn elastin và nếu
bệnh tiến triển có thể có tình trạng phá hủy cả cơ và sụn phế quản. Khi đó Whitwell không
biết tại sao GPQ lại có thể dẫn đến tình trạng mất mô như vậy. Ông cũng nhận thấy có các
biến đổi khác như xơ hóa thành phế quản, viêm phổi tại các nhánh phế quản ngoại biên hoặc
xẹp phổi. Whitwell căn cứ vào các đặc điểm này phân bệnh GPQ thành 3 loại là loại nang,
túi và xẹp. Trong 3 loại này ông quan sát thấy loại nang phổ biến nhất và loại này tương ứng
với thể hình ống trong phân loại của Reid.
Whitwell quan sát thấy dạng nang có đặc trưng là tồn tại các nang lympho trên thành
phế nang. Ông nhận thấy quá trình viêm nhiễm được bắt đầu tại đường hô hấp nhỏ. Quá
trình viêm nhiễm này làm phóng thích các chất trung gian chẳng hạn protease gây tổn
thương đường hô hấp lớn dẫn đến mất elastin và các thành phần khác chẳng hạn cơ và sụn
phế quản từ đó gây GPQ. Theo thời gian tiến triển của bệnh, các nang lympho lớn dần và
4
gây tắc nghẽn thông khí tại đường hô hấp nhỏ. Kết cục cuối cùng chính là hiện tượng viêm
nhiễm phát tán ra ngoài đường hô hấp xâm nhiễm vào hệ thống mô kẽ phổi gây viêm phổi
mô kẽ. Toàn bộ quá trình này có thể được tóm tắt bằng hình dưới đây
Hình 3.1. Các biến đổi về sinh bệnh học của GPQ dạng nang theo mô tả của
Whitwell. A) Ban đầu là nhiễm trùng tại đường hô hấp dưới. B) Nhiễm trùng dẫn đến phóng
thích các chất trung gian gây viêm chẳng hạn protease làm tổn thương đường hô hấp lớn gây
giãn phế quản. C) Hiện tượng nhiễm trùng tiếp tục gây viêm nhiễm tại đường hô hấp nhỏ
làm đường hô hấp nhỏ trở nên dày lên do sự kết hợp của hiện tượng xâm nhiễm qua trung
gian tế bào và sự hình thành các nang lympho trên thành phế quản dẫn đến tắc nghẽn thông
khí. D) Kết cục cuối cùng của quá trình này chính là sự phát tán viêm nhiễm ra ngoài đường
hô hấp vào mô kẽ gây viêm phổi mô kẽ.
(Nguồn: King PT (2009) "The pathophysiology of bronchiectasis". Int J Chron Obstruct Pulmon Dis 4,
411–9.[13])
Các tế bào tham gia vào quá trình viêm nhiễm này bao gồm bạch cầu trung tính, các
tế bào lympho và đại thực bào. Các bạch cầu trung tính chính là các tế bào tiết ra các chất
trung gian nhất là protease/elastase gây GPQ. Các tế bào lympho và đại thực bào thì đóng
vai trò xâm nhiễm vào thành phế quản. Các nghiên cứu trong giai đoạn sau thời Whitwell đã
5
xác minh được các tế bào lympho này là các tế bào T và chính chúng là “tác giả” gây ra các
nang lympho trên thành phế quản như Whitwell mô tả.
Các nghiên cứu sau Whitwell tiếp tục bổ sung kiến thức mới về sinh bệnh học của
GPQ khi phát hiện rằng sự phân bố tình trạng GPQ tùy thuộc vào các các căn nguyên khác
nhau, ví dụ viêm phổi do dị ứng với aspergillus luôn kết hợp với GPQ tại trung tâm phổi.
Căn cứ vào điều này, GPQ được mô tả là khu trú (chỉ xảy ra tại một thùy) hoặc lan tỏa (xảy
ra tại nhiều thùy khác nhau). Loại phổ biến nhất chính là loại lan tỏa và thường tập trung tại
các thùy dưới của phổi[10].
Dựa trên những phát hiện của Whitwell và các nghiên cứu khác, năm 1986 Cole đề ra
một mô hình nổi tiếng mang tên “vòng lẩn quẩn” để giải thích cơ chế bệnh sinh của
GPQ[9]. Theo mô hình của Cole, một tác động từ môi trường lên các đối tượng có tiền sử
cảm nhiễm về mặt di truyền với tác động đó sẽ làm giảm sự thanh thải qua con đường lông
mao – dịch nhầy dẫn đến sự cư trú kéo dài của các vi sinh vật tại các phế quản nhánh của
đường hô hấp. Các vi sinh vật này gây ra tình trạng viêm nhiễm mạn tính làm tổn thương các
mô và suy giảm khả năng di động của hệ thống lông mao đường hô hấp. Quá trình này lại
gây ra hiện tượng bội nhiễm (nhiễm cùng loại tác nhân nhiều lần) làm viêm nhiễm tăng lên
và gây tổn thương phổi trầm trọng hơn. Toàn bộ diễn biến sinh bệnh học của “vòng lẩn
quẩn” có thể được quan sát dựa trên lâm sàng khi bệnh nhân sẽ có những khoảng thời gian
với triệu chứng có thể kiểm soát được (giai đoạn ổn định) xen kẽ với các đợt kịch phát (giai
đoạn kịch phát) với các triệu chứng bệnh gia tăng dữ dội.
6
Hình 3.2. Mô hình giải phẫu bệnh giải thích cơ chế “vòng lẩn quẩn” của Cole. A) Cơ
chế thanh thải lông mao – dịch nhầy bình thường. B) Cơ chế thanh thải lông mao – dịch
nhầy bất thường trong GPQ
(Nguồn: Smith MP (2011) "Non-cystic fibrosis bronchiectasis". J R Coll Physicians Edinb, 41, 132–9[34])
Viêm nhiễm và
phá hủy thành
phế quản
Nhiễm trùng và
viêm nhiễm đường
hô hấp dai dẳng
Viêm nhiễm quá
mức đường hô hấp
Giảm thanh thải lông
mao – dịch nhầy
Nhiễm trùng đường
hô hấp mạn tính
Hình 3.3. Sơ đồ mô tả “vòng lẩn quẩn” của Cole
(Nguồn: Smith MP (2011) "Non-cystic fibrosis bronchiectasis". J R Coll Physicians Edinb, 41, 132–9[34])
Các nghiên cứu trong vài thập niên gần đây phát hiện thêm một khía cạnh mới củng
cố thêm giả thuyết về cơ chế bệnh sinh do Whitwell đưa ra. Khi đo chức năng phổi của các
trường hợp GPQ, các nhà khoa học nhận thấy rằng chức năng hô hấp của phổi giảm dần theo
thời gian thể hiện qua việc sụt giảm chỉ số thở ra gắng sức trong 1 giây đầu (FEV1)[17].
Điều này có vẻ trái ngược với bản chất của bệnh GPQ là phế quản bị giãn rộng trong suốt
diễn tiến bệnh. Lý giải điều này, các nghiên cứu chỉ ra rằng tình trạng tắc nghẽn thông khí
chủ yếu xảy ra tại đường hô hấp nhỏ nơi xảy ra tình trạng thành phế quản dày lên và chứa
đầy dịch nhầy. Như vậy có thể thấy lý giải của khoa học hiện đại và lý giải của Whitwell
hoàn toàn giống nhau khi Whitwell giả định rằng quá trình nhiễm trùng gây viêm nhiễm làm
hẹp đường hô hấp nhỏ và làm giãn đường hô hấp lớn.
7
4. Bệnh căn học giãn phế quản
Một số nghiên cứu cho thấy có từ 7 – 50% các ca bệnh GPQ là không có nguyên
nhân[20, 26], nhưng cũng có nghiên cứu cho thấy có đến 80% số trường hợp GPQ không có
nguyên nhân gây bệnh rõ ràng[17]. Các trường hợp còn lại có nguyên nhân gây bệnh rất đa
dạng khác nhau. Các nguyên nhân này thực ra chỉ có thể được gọi là yếu tố nguy cơ gây
bệnh bởi vì bệnh GPQ là bệnh mạn tính kéo dài do đó việc bệnh nhân nhớ lại nguyên nhân
khiến bản thân mắc bệnh thường không chính xác, dẫn đến không thể xác định căn nguyên
chính xác của bệnh.
Tại các nước chậm phát triển, nhiễm trùng chính là nguyên nhân gây GPQ phổ biến
nhất[5], trong khi đó tại các nước phát triển như Mỹ thì rối loạn miễn dịch, có thể là bệnh tự
miễn hoặc suy giảm miễn dịch mắc phải, lại là những nguyên nhân phổ biến nhất[20]. Việc
đánh giá và xác định nguyên nhân của bệnh rất quan trọng vì có thể quyết định cách điều trị
và tiên lượng của bệnh. Các nguyên nhân gây bệnh đã biết của GPQ có thể được phân thành
các nhóm sau đây[15]:
− Hậu nhiễm trùng: bao gồm nhiễm trùng đường hô hấp do virus từ nhỏ (ví dụ sởi, cúm, ho
gà), nhiễm trùng trước đó với Mycobacteria hoặc viêm phổi nặng do vi khuẩn, viêm phế
quản phổi do dị ứng Aspergillus fumigatus, hội chứng Swyer-James (là biểu hiện mạn
tính của bệnh viêm phế quản hoặc viêm phổi ở trẻ em, được mô tả là giảm tăng sinh phổi
một bên và giảm bắt sáng khi chụp hình ảnh phổi);
− Suy giảm miễn dịch: bao gồm các bệnh như nhiễm HIV, suy giảm globulin miễn dịch;
− Di truyền: bao gồm các bệnh như bệnh xơ nang phổi, rối loạn vận động lông mao hoặc
hội chứng bất động lông mao đi kèm hoặc không đi kèm hội chứng Kartagener (một tình
trạng bệnh lý rối loạn nhiễm sắc thể lặn được mô tả bởi tam chứng rối loạn vận động
lông mao, đảo phủ tạng và viêm xoang sàng - xoang hang), suy giảm Alpha-1−
−
−
−
antitrypsin;
Tổn thương hít vào hoặc thở ra;
Rối loạn mô liên kết: bao gồm các bệnh như viêm khớp dạng thấp, hội chứng Sjogren's;
Bệnh viêm ruột: bao gồm các bệnh như viêm ruột kết hoại tử, bệnh Crohn;
Tắc nghẽn phế quản trung tâm: bao gồm các bệnh như tắc nghẽn do ngoại vật, bệnh sỏi
phế quản, bệnh hẹp phế quản, các u bướu phế quản, viêm hạch lympho ngoại biên;
8
− Các bệnh khác: hội chứng Mounier-Kuhn’s (được mô tả bằng sự giãn bất thường khí
quản và phế quản chính), hội chứng Williams-Campbell (được mô tả bằng sự khiếm
khuyết hoặc suy yếu sụn phế quản, dẫn đến sụp phế quản), hội chứng móng vàng, bệnh
phổi tiềm ẩn, hội chứng Ehlers-Danlos, hội chứng Marfan, hội chứng Young (tình trạng
bệnh lý do di truyền được mô tả bởi tình trạng thiếu tinh trùng đi kèm nhiễm trùng xoang
phổi tái phát hoặc mạn tính).
Hình 4.4. Nội soi phế quản của một phụ nữ 73 tuổi mắc viêm phổi và giãn phế quản thùy
dưới phổi phải do ngoại vật. Hình ảnh cho thấy bướu lành tính làm tắc nghẽn phế quản thùy
dưới. Sau khi phẫu thuật gắp được hai mảnh hạt đậu trong phế quản bệnh nhân. Bệnh nhân
không nhớ đã ăn đậu cách đây 18 năm.
(Nguồn: Courtesy of Charles Marquette, MD)
9
Hình 4.5. Giãn phế quản trung tâm ở bệnh nhân viêm phế quản phổi do dị ứng aspergillus.
Trên hình có thể thấy nhiều phế quản thế hệ thứ ba và thứ tư bị giãn.
(Nguồn: Courtesy of Paul Stark, MD)
Hình 4.6. Hình chụp HRCT ngực bệnh nhân mắc xơ nang phổi cho thấy tình trạng giãn phế
quản dạng nang nhẹ. Thành phế quản dày lên tại thùy trên và phần trên của thùy dưới.
(Nguồn: Courtesy of Paul Stark, MD)
5. Triệu chứng lâm sàng của giãn phế quản
5.1. Triệu chứng cơ năng
Triệu chứng toàn thân
− Sốt: bệnh nhân chỉ sốt ở giai đoạn ứ đọng mủ và đàm trong phế quản do không khạc ra
được. Thân nhiệt bệnh nhân thường khoảng 38 0C, ít khi nào lên đến 39 – 40 0C. Ngoài
những đợt này thì bệnh nhân có thể không sốt.
10
− Bệnh nhân thường gầy yếu, mệt mỏi, nhức đầu, chán ăn. Ở trẻ em thường thấy chậm lớn,
chậm dậy thì, lồng ngực bên tổn thương bé hơn bên lành, cân nặng và chiều cao đều kém
so với trẻ cùng tuổi bình thường.
Triệu chứng ở cơ quan hô hấp
− Ho ra đàm: đây là triệu chứng lâm sàng chính yếu của bệnh. Có đến 80% số bệnh nhân
có triệu chứng này. Bệnh nhân thường ho vào buổi sáng do có nhiều đàm mủ ứ đọng
trong phế quản giãn vào những đợt bội nhiễm. Số lượng đàm khạc ra có thể thay đổi tùy
vào từng bệnh nhân, tuy nhiên số lượng trung bình vào khoảng 20 - 100 ml/ ngày, hay có
thể nhiều hơn trong đợt kịch phát (> 150 ml/ngày). Những trường hợp ho nhiều đàm còn
được gọi là loại GPQ “thể ướt”. Tính chất đàm thường có màu vàng ngà, có khi trắng,
đôi khi có màu xanh và thường có mùi hôi. Nếu để lắng sau 6 giờ đàm sẽ phân thành 4
lớp từ trên xuống dưới là: đàm bọt, đàm thành dịch nhầy trong, đàm mủ nhầy, đàm mủ
đặc.
− Ho ra máu: khoảng 20-50% bệnh nhân GPQ có triệu chứng ho ra máu. Những trường
hợp ho ra máu mà không có đàm được gọi là loại GPQ “thể khô”, trước đây loại này
thường bị nhầm với lao phổi. Số lượng máu ho ra thường ít nhưng có trường hợp ho ra
máu với số lượng lớn. Mức độ ho máu có thể được phân thành ho ra máu nhẹ (<
50ml/ngày), trung bình (50-200ml/ngày), nhiều (> 200ml/ngày), rất nặng (>200ml/ngày).
Một số bệnh nhân ho ra máu lẫn đàm (8% số trường hợp), nhất là vào những đợt bị bội
nhiễm. Ho ra máu có thể dưới hình thức tia máu đỏ tươi chứng tỏ có đợt viêm xảy ra
hoặc tia máu với số lượng nhiều chứng tỏ có hiện tượng xuất huyết hệ thống. Ho máu tái
phát nhiều lần và có thể kéo dài nhiều năm.
− Đau tức ngực, khó thở: khoảng 50-70% bệnh nhân có triệu chứng đau tức ngực và 20%
có triệu chứng khó thở[22]. Các triệu chứng này thường xuất hiện trong những đợt bội
nhiễm nặng. Hai triệu chứng này thường xuất hiện muộn, là biểu hiện của suy hô hấp do
tổn thương lan tỏa hai phổi.
5.2. Triệu chứng thực thể
− Khoảng 50% số bệnh nhân khi khám phổi có thể phát hiện nhiều ran ẩm, có khi có một
số ran khô và giảm tiếng rì rào phế nang ở khu vực có GPQ. Nếu có xẹp phổi thì thấy có
hội chứng đông đặc co kéo tương ứng với vùng phổi xẹp.
11
− Dấu hiệu “ngón tay dùi trống” và “móng tay hình mặt kính đồng hồ”: Dấu hiệu này có
thể gặp ở khoảng 2 – 3% số bệnh nhân bị bệnh GPQ. Thường gặp ở những bệnh nhân
mắc bệnh mạn tính, toàn trạng nặng, có các rối loạn về chức năng hô hấp và tim mạch.
Hình 5.7. Dấu hiệu ngón tay hình dùi trống trong bệnh giãn phế quản
(Nguồn: />
6. Chẩn đoán bệnh giãn phế quản
Việc chẩn đoán bệnh GPQ bao gồm 1) thăm hỏi tiền sử bệnh và khám thực thể, 2)
chẩn đoán xác định GPQ, 3) xác định độ nặng của bệnh và 4) chẩn đoán xác định nguyên
nhân gây bệnh[8, 24].
6.1. Thăm hỏi tiền sử bệnh và khám thực thể
Việc chẩn đoán GPQ trước hết phải dựa vào các dấu hiệu nghi ngờ trên lâm sàng.
Trên 90% bệnh nhân có ho kéo dài dai dẳng và 3/4 bệnh nhân có ho khạc ra đàm hằng ngày.
Đàm thường biến đổi màu với mủ vàng hoặc mủ xanh, thậm chí khi bệnh nhân có thể trạng
tốt. Một triệu chứng đặc trưng khác là bệnh nhân ho ra máu. Bệnh nhân thường có tiền sử
nhiễm trùng phổi tái phát và các triệu chứng hô hấp khác liên quan đến tắc nghẽn đường hô
hấp (khó thở và thở khò khè) và tắc nghẽn do dịch nhầy (đau ngực). Ngoài ra tổng trạng
bệnh nhân có thể suy nhược, mệt mỏi và kèm theo các triệu chứng hô hấp mạn tính làm ảnh
hưởng đến chất lượng cuộc sống về mặt sức khỏe của bệnh nhân. Khi nhân viên y tế khám
12
thực thể cho bệnh nhân có thể phát hiện các dấu hiệu ngón tay hình dùi trống (2-3%), thở
khò khè (21 – 34%) và ran ẩm (69,9 – 73%)[16].
6.2. Chẩn đoán xác định giãn phế quản
Trước đây, các kỹ thuật chụp hình ảnh học như chụp X – quang phổi, chụp phế quản
cản quang, chụp động mạch phế quản thường được sử dụng để xác định sự tồn tại và mức độ
của GPQ. Tuy nhiên trong thời gian gần đây, chụp HRCT trở thành tiêu chuẩn vàng trong
chẩn đoán xác định tình trạng GPQ[14].
Trên phim HRCT, các hình ảnh sau đây cho phép chẩn đoán xác định GPQ: 1)
Đường kính trong của phế quản lớn hơn động mạch kế bên phế quản (còn gọi là cấu trúc
“vòng nhẫn đặc trưng”), 2) Các phế quản không nhỏ dần (được định nghĩa là khi 1 phế quản
trên một đoạn dài 2 cm có đường kính tương tự phế quản đã phân chia ra phế quản đó) và 3)
Thấy phế quản ở cách màng phổi thành ngực từ 1 – 2 cm[14]. Ngoài ra trên phim HRCT còn
có thể phát hiện các hình ảnh ít đặc hiệu hơn như phế quản đi sát vào trung thất, thành phế
quản chạy song song hình đường ray tại khu vực ngoại biên phổi, các tiểu phế quản bị bịt
kín bởi dịch nhầy và có dạng hình V và Y (được gọi là cấu trúc cây nở hoa)[11].
Hình 6.8. Hình chụp HRCT cho thấy nhiều bóng mờ hình vòng (vòng nhẫn đặc
trưng) chứng tỏ phế quản bị giãn nở ở phổi phải, nhiều phế quản chứa đầy dịch tiết (mũi tên)
(Nguồn: Courtesy of Alan Barker, MD)
13
Hình 6.9. Hình chụp HRCT với mũi tên A chỉ cấu trúc cây nở hoa ở vùng ngoại biên
phổi và mũi tên B chỉ phế quản bị giãn nở.
(Nguồn: />
Như đã trình bày trong phần sinh bệnh học, năm 1950 Reid đề xuất phân loại GPQ
thành 3 thể khác nhau là GPQ hình ống, GPQ co giãn và GPQ hình nang. Trên phim HRCT
có thể phân biệt được 3 thể này rõ ràng trong đó:
GPQ hình ống có các đặc điểm sau:
−
−
−
−
−
Phế quản nở rộng và có dạng hình ống.
Phế quản nhánh tại vùng ngoại biên phổi không thu nhỏ.
Các nhánh phế quản tận bị bịt kín đột ngột do chất nhầy chèn đầy.
Các tiểu phế quản ít hơn so với bình thường.
Có thể thấy thành phế quản chạy song song dạng đường ray xe lửa
GPQ co giãn có các đặc điểm sau:
− Phế quản có hình dạng bất thường có lúc co thắt và có lúc giãn nở.
− Kiểu GPQ tương tự như giãn tĩnh mạch
GPQ hình nang có đặc điểm sau:
− Phế quản giãn nở tạo thành các chùm nang tròn chứa đầy khí hoặc dịch.
− Mức độ GPQ tăng dần từ trong ra ngoại biên phổi.
− Các tiểu phế quản tận thường bị bịt kín bởi các túi khí hoặc dịch.
14
Hình 6.10. Hình chụp HRCT cho thấy ba thể đặc trưng của bệnh GPQ. A) GPQ hình ống.
B) GPQ co giãn. C) GPQ hình nang.
(Nguồn: King PT (2009) "The pathophysiology of bronchiectasis". Int J Chron Obstruct Pulmon Dis 4, 411–9.[13])
Cho dù có nhiều ưu điểm, nhưng HRCT vẫn có một số hạn chế chẳng hạn như không
thể xác định được tình trạng GPQ chỉ bằng một lần chụp duy nhất. Ở bệnh nhân có tình
trạng kịch phát, HRCT có thể phát hiện tình trạng GPQ tạm thời trong lần chụp đầu nhưng ở
lần chụp sau tình trạng này có thể không còn. Để tránh việc phải chụp lại nhiều lần, cần chỉ
định chụp HRCT khi tình trạng lâm sàng của bệnh nhân ổn định và không trong giai đoạn có
cơn kịch phát.
Một hạn chế khác của kỹ thuật chụp hình ảnh này chính là việc đọc kết quả. Một tiêu
chí dùng để chẩn đoán xác định GPQ được trình bày ở trên là đường kính trong của phế
quản lớn hơn động mạch kế bên phế quản được đo lường thông qua tỷ số đường kính phế
quản/đường kính động mạch. Nếu tỷ số này > 1 thì khi đó được gọi là phế quản giãn bất
thường[3]. Tuy nhiên, tỷ số này trong thực tế chịu ảnh hưởng của nhiều yếu tố khác nhau
như tuổi[19] (nhạy với người trẻ tuổi, nhưng lại ít nhạy với người lớn tuổi), độ cao của khu
vực địa lý, hoặc tình trạng giảm oxy máu[12] làm sai lệch kết quả. Vì vậy, một bệnh nhân
trong thực tế có phế quản bị giãn nhưng khi chụp HRCT và tính tỷ số trên thì lại cho thấy
phế quản không bị giãn.
15
Một vấn đề cần phải xem xét trước khi chụp HRCT chính là mức độ phóng xạ. HRCT
có liều phóng xạ an toàn lên đến 8 mSv, cao gần 400 lần so với chụp X – quang phổi. Đối
với liều lượng như vậy cần phải cân nhắc khi chụp HRCT cho bệnh nhân là trẻ em và trẻ vị
thành niên bởi vì liều lượng đó có thể gây ra ung thư[36].
6.3. Đánh giá độ nặng của bệnh
Sau chẩn đoán xác định ban đầu, cần đánh giá độ nặng của bệnh để định hướng điều
trị và theo dõi cho bệnh nhân. Để đánh giá độ nặng của bệnh không chỉ dựa vào độ giãn phế
quản mà còn phải dựa vào nhiều yếu tố khác như màu sắc đàm, thể tích đàm 24 giờ v.v.
Bảng 6.11 dưới đây trình bày cách đánh giá độ nặng của bệnh:
Bảng 6.11. Các đặc điểm lâm sàng, vi sinh học và hình ảnh học dùng để đánh giá độ
nặng của bệnh GPQ
Đặc điểm
Độ nặng của bệnh
Nhẹ
Màu sắc đàm
Nhầy
Thể tích đàm 24 giờ < 5 ml
Tần số cơn kịch phát ≤ 3 lần/năm
Vừa
Mủ nhầy
Nặng
Mủ
≥ 25 ml
Nhiều lần
Độ nặng cơn kịch Sử dụng kháng sinh
Sử dụng kháng sinh
phát
đường uống
tiêm tĩnh mạch và các
Vi sinh học đàm
Không nhiễm trùng Khuẩn lạc hỗn hợp hoặc
biện pháp hỗ trợ
Pseudomonas
mạn tính
mắc nhiều tác nhân (ví dụ
Aeruginosa
H. influenzae, M.
catarrhalis, S.
pneumoniae, S. aureus)
Thùy phổi bị ảnh Một thùy
hưởng trên HRCT
Mức độ giãn phế Hình ống
quản
Tất cả các thùy
Hình co giãn
Hình nang
16
A
B
C
Hình 6.12. Màu sắc đàm soi dưới kính hiển vi. A) Nhầy. B) Mủ nhầy. C) Mủ
(Nguồn: Murray MP, Hill AT (2009) "Non-cystic fibrosis bronchiectasis". Clin Med, 2009, (9)[21])
Cơn kịch phát được định nghĩa là bệnh nhân đột ngột ho dữ dội, thay đổi màu sắc
đàm từ nhầy sang mủ nhầy hoặc mủ, thể tích đàm tăng lên trên mức ≥ 25 ml kèm theo sốt
hoặc suy nhược cơ thể. Nếu bệnh nhân trong một năm có số cơn kịch phát ≤ 3 được xếp vào
mức độ nhẹ còn nếu trong một năm xảy ra nhiều lần thì được xếp vào nhóm nặng.
Ở bệnh nhân đã được xác định mắc GPQ bằng chụp HRCT, thì hầu hết xét nghiệm vi
sinh học đàm đều có thể phát hiện nhiều tác nhân vi sinh vật gây bệnh, chỉ có một số ít
trường hợp có thể không phát hiện được vi khuẩn gây bệnh mà thôi[13]. Loại tác nhân gây
bệnh phổ biến nhất được phân lập là Haemophilus influenzae (29%–70% các trường hợp),
kế tiếp là Pseudomonas aeruginosa (12%–31%). Các nghiên cứu cho thấy số lượng khuẩn
lạc thay đổi tùy vào độ nặng của bệnh và mức độ bảo tồn chức năng phổi. Nếu chức năng
phổi suy giảm thì H. influenzae sẽ chiếm ưu thế và khi bệnh trở nặng thì xuất hiện thêm P.
aeruginosa[13]. Ngoài hai loại vi khuẩn trên, các tác nhân vi sinh khác có thể được phát
hiện khi cấy
đàm
là
Streptococcus
pneumoniae,
Haemophilus
parainfluenzae,
Staphylococcus aureus, và Moraxella catarrhalis.
Các nghiên cứu đều khuyến cáo thực hiện xét nghiệm cấy đàm bởi vì việc phát hiện
tác nhân gây bệnh và mô tả tính nhạy cảm kháng sinh của chúng sẽ giúp định hướng biện
pháp điều trị. Một điều cần lưu ý khi làm xét nghiệm cấy đàm là bệnh nhân GPQ còn có thể
mắc phải lao và các chủng Mycobacteria khác không gây lao, và đôi khi còn có cả vi nấm
17
chẳng hạn Aspergillus spp, do đó việc điều trị phải mang tính đặc hiệu đối với các trường
hợp này[22].
A
B
Hình 6.13. Hình ảnh HRCT thùy phổi bị ảnh hưởng. A) Một thùy. B) Nhiều thùy
(Nguồn: />
6.4. Các xét nghiệm tìm nguyên nhân gây bệnh
Có rất nhiều loại xét nghiệm để tìm nguyên nhân gây bệnh như tổng phân tích tế bào
máu, xét nghiệm đo nồng độ globulin miễn dịch v.v...Wilson đã đưa ra khuyến cáo về các
xét nghiệm hỗ trợ nhằm tìm nguyên nhân gây bệnh. Tùy theo từng loại nguyên nhân sẽ có
các xét nghiệm tương ứng để phát hiện các nguyên nhân đó[40]:
Nguyên
nhân Tỷ lệ mắc
gây bệnh
Hậu nhiễm
(%)
29 – 42
trùng
Bệnh mô liên
Phương pháp phát hiện
Kết quả bất thường dự kiến
Hỏi thăm tiền sử nhiễm trùng
được phát hiện
Có các bằng chứng cho thấy
Chụp hình ảnh phát hiện dấu tích nhiễm trùng trước đó
3–6
kết
của nhiễm trùng trước đó
Tiền sử bị bệnh mô liên kết có hoặc Kết quả tầm soát dương tính
không có kèm viêm mạch máu
kèm có hoặc không có bằng
Tầm soát các bệnh tự miễn trong đó chứng lâm sàng mắc bệnh mô
có viêm khớp dạng thấp, kháng thể liên kết
Viêm phế quản
1–7
kháng nhân tế bào
Tổng phân tích tế bào máu
Các tiêu chí để chẩn đoán bệnh
18
phổi do dị ứng
IgE toàn phần
nhân GPQ do mắc viêm phế
aspergillus
IgG và IgE đặc hiệu đối với quản phổi do dị ứng aspergillus
Aspergillus fumigatus
là:
Xét nghiệm thử A. fumigatus trên •
•
da
Có tiền căn hen suyễn
Tăng bạch cầu trong máu
Hô hấp ký (FEV1,dung tích sống
•
•
•
ngoại biên
Tăng IgE toàn phần
GPQ trung tâm trên HRCT
Xét nghiệm da thử A.
•
fumigatus dương tính
Tăng nồng độ IgE và IgG
gắng sức – FVC)
HRCT
đặc
Suy giảm miễn
1- 8
dịch
hiệu
đối
với
A.
Xét nghiệm nồng độ IgA, IgG, IgM
fumigatus
Nồng độ IgA, IgG, IgM đều
Xét nghiệm phân nhóm IgG
giảm sút
Xét nghiệm nồng độ kháng thể đặc Nồng độ phân nhóm IgG 2 thấp
hiệu kháng độc tố tetanus và vỏ đi kèm với nhiễm trùng bội
polysaccharide của Streptococcus
nhiễm vi khuẩn Gram (+) có vỏ
pneumoniae
bọc
và
Haemophilus
influenza type B
Xơ nang phổi
3 -4
Đáp ứng kháng thể nền giảm
xuống
Xét nghiệm di truyền học tế bào Đột biến CFTR dương tính
đột biến thụ thể điểu khiển trao Xét nghiệm mồ hôi dương tính
đổi màng trong xơ nang phổi
(CFTR)
Khiếm khuyết
2 -4
Xét nghiệm mồ hôi
Tiền sử có vấn đề về đường hô hấp Bất thường về nhu động của
chức năng lông
trên mạn tính, vô sinh ở nam
mao phổi
Xét nghiệm chức năng lông mao, không có bất thường về tần suất
xét nghiệm saccharin
long mao kèm theo có hoặc
Xét nghiệm nếm saccharin (bệnh
nhân không cảm được saccharin
sau 60 phút)
Bệnh viêm ruột
1
Tiền sử mắc bệnh
Thăm khám các triệu chứng đường
19
Hít vào vật thể
lạ
Vô căn
4
tiêu hóa
Nội soi phế quản nếu có tiền sử Phát hiện vật lạ trong đường hô
30 -45%
GPQ khu trú
Loại trừ các nguyên nhân trên
hấp
Chẩn đoán loại trừ
6.5. Chẩn đoán phân biệt
Trong chẩn đoán bệnh GPQ cần phân biệt với một số bệnh phổi có triệu chứng lâm
sàng tương tự nhưng cơ chế sinh bệnh học khác nhau. Việc chẩn đoán phân biệt có thể dựa
trên hình ảnh chụp X – quang phổi. Các bệnh cần phải chẩn đoán phân biệt bao gồm:
− Các bệnh phổi hậu nhiễm trùng như lao phổi, bệnh phổi do nhiễm phức hợp M. avium,
hội chứng Swyer-James.
− Các bệnh tắc nghẽn phổi chẳng hạn bướu phế quản sau, tắc nghẽn do ngoại vật.
− Giãn phế quản liên tục trong các bệnh phổi mô kẽ, bệnh xơ hóa phổi, hen suyễn, viêm
phế quản phổi do dị ứng aspergillus và hội chứng Kartagener.
Bệnh
Giãn phế quản
Hình ảnh học
Các biến đổi dạng nang + vòng nhẫn đặc trưng
Thành phế quản giãn và dày
Viêm phế quản phổi Có hình ảnh giãn phế quản tại trung tâm phổi + dấu hiệu đông
do dị ứng Aspergillus
đặc + thể hang tại vùng phổi trung tâm và vùng phổi trên
20
Bệnh xơ hóa phổi
Dấu hiệu đông đặc hoặc thể hang không rõ rệt ở vùng phổi trên
+ phế quản giãn và thành phế nang dày lên ở vùng phổi trên
Khí phế thủng
Tăng thâm nhiễm toàn bộ hoặc một phần phổi + khiếm khuyết
động mạch do thâm nhiễm nặng và khiếm khuyết mạch máu
quanh rốn phổi
Viêm phế quản
Dấu hiệu mạch máu phế quản + các đường thẳng nằm ngang
xuất phát từ rốn phổi phải không phân định ranh giới rõ rệt do
21
hiện tượng viêm mạn tính gây ra
Hậu nhiễm lao
Sưng hạch trung thất và hạch hai bên phổi + các hạt nhỏ không
đồng nhất + thể hang + tràn dịch màng phổi tại vùng phổi trên
7. Điều trị GPQ
Việc điều trị cho tất cả các bệnh nhân phải bao gồm hai khía cạnh là điều trị bảo tồn
và điều trị đợt kịch phát.
22
7.1. Điều trị bảo tồn
Mục đích chính trong điều trị bảo tồn GPQ chính là giảm triệu chứng, ngăn ngừa cơn
kịch phát, bảo tồn chức năng phổi và cải thiện chất lượng cuộc sống về mặt sức khỏe cho
bệnh nhân.
7.1.1. Tập thể dục và cải thiện chế độ dinh dưỡng
Mọi bệnh nhân mắc GPQ cần phải được chăm sóc với chế độ ăn giàu dinh dưỡng và
hợp lý đồng thời phải thường xuyên khuyến khích bệnh nhân tập thể dục. Các nghiên cứu
cho thấy các bài tập phục hồi chức năng phổi (một chương trình tập luyện với cường độ vừa
phải trong vòng 8 tuần) có khả năng tăng cường sức bền, khả năng thực hiện các bài tập dẫn
lưu tư thế cho bệnh nhân, và tăng thanh thải qua con đường lông mao phổi. Việc cải thiện
chế độ dinh dưỡng có thể làm cải thiện chỉ số BMI (chỉ số BMI tăng lên) từ đó tăng cường
thể lực cho bệnh nhân GPQ[2].
7.1.2. Phương pháp vận động trị liệu
Các phương pháp vận động trị liệu, phổ biến nhất là các bài tập dẫn lưu tư thế, đóng
vai trò quan trọng trong việc tăng khả năng thanh thải của đường hô hấp thông qua việc giúp
bệnh nhân tống đàm ra ngoài. Các bài tập được thực hiện 2 - 3 lần /ngày, mỗi lần khoảng 15
- 30 phút. Bệnh nhân sẽ được hướng dẫn cách ho, khạc đờm sâu và vỗ rung lồng ngực. Tùy
theo vị trí GPQ mà lựa chọn tư thế cho phù hợp với nguyên tắc vùng GPQ được đặt ở vị trí
cao nhất. Nếu vùng GPQ ở phía sau thì bệnh nhân được đặt nằm xấp, còn nếu vùng GPQ ở
phía trước thì bệnh nhân được đặt nằm ngửa. Sau đó dùng hai bàn tay khum lại, vỗ đều vào
ngực bệnh nhân, kết hợp rung và lắc ngực.
Hiện nay một số kỹ thuật vận động trị liệu mới được sử dụng thay cho phương pháp
dẫn lưu tư thế truyền thống như kỹ thuật thở chu kỳ chủ động (giữ hơi thở trong 20 – 30 giây
và sau đó thở ra sâu, lập lại thành chu kỳ), sử dụng thiết bị hỗ trợ như máy rung (thiết bị
được thiết kế như một chiếc còi, trên có chứa viên bi, tạo ra lực rung tác động sâu vào phổi
khi được thổi liên tục), áo rung (áo tạo áp lực thay đổi và gây ra lực rung đều đặn lên ngực
bệnh nhân) giúp dẫn lưu đàm trở nên dễ dàng hơn[27]. Tuy nhiên việc lựa chọn các biện
pháp nêu trên phải tùy thuộc vào sở thích của bệnh nhân.
7.1.3. Sử dụng thuốc giãn phế quản
23
Vai trò của các thuốc giãn phế quản trong điều trị GPQ cho đến nay vẫn chưa thể
kiểm chứng hoàn toàn, tuy nhiên các thuốc này có thể được dùng làm phương pháp điều trị
hỗ trợ vận động trị liệu và làm giảm triệu chứng khó thở. Nếu bệnh nhân bị tắc nghẽn đường
thở, các xét nghiệm chức năng phổi cần được tiến hành để xác định bệnh nhân có thể sử
dụng thuốc β2 – agonist đường hít và/hoặc các thuốc anticholinergic hay không. Tuy nhiên
cả hai thuốc này đều làm giảm triệu chứng khó thở cho dù có làm cải thiện chỉ số FEV1 hay
không. Bệnh nhân trước hết cần sử dụng thuốc trong thời gian ngắn nếu thấy hiệu quả cải
thiện về lâm sàng thì mới sử dụng trong thời gian dài.
Một số phác đồ sử dụng thuốc giãn phế quản bao gồm:
−
−
−
−
−
Salbutamol dạng hít: 200 μg/ 4-6 giờ hoặc phun 2,5 mg/6 - 8 giờ hoặc
Arformoterol dạng hít: phun 15 μg/12 giờ hoặc
Salbutamol/Ipratropium dạng hít: 200/40 μg/6 giờ hoặc
Ipratropium dạng hít: 40 μg/6 giờ hoặc
Tiotropium dạng hít: 18 μg (1 viên) hít 1 lần/ngày
7.1.4. Sử dụng thuốc lợi tiểu thẩm thấu
Việc sử dụng các thuốc lợi tiểu thẩm thấu chẳng hạn hypertonic saline hoặc mannitol
có thể cải thiện thanh thải qua lông mao thông qua việc gây kích thích ho, và cải thiện khả
năng dung nạp của bệnh nhân trước khi điều trị bằng thuốc giãn phế quãn salbutamol.
Hypertonic saline dạng phun được chứng minh là có khả năng giảm các chất trung gian viêm
nhiễm, giảm số lượng vi khuẩn trong đàm và cải thiện các chỉ số chất lượng cuộc sống ở
bệnh nhân[28]. Tuy nhiên hypertonic saline có thể gây co thắt ngực và khò khè ở một số
bệnh nhân.
7.1.5. Sử dụng macrolide đường uống dài ngày
Kết quả một số nghiên cứu gần đây cho thấy macrolide đường uống có lợi trong việc
điều trị GPQ ở bệnh nhân có hoặc không có Pesudomonas. Lợi ích của macrolide chính là
cải thiện tương đối chỉ số FEV1, giảm lượng đàm, và giảm số đợt kịch phát. Hiện nay liều
lượng, loại thuốc cụ thể, và thời gian điều trị các thuốc nhóm macrolide vẫn chưa được
nghiên cứu. Tuy nhiên, khi sử dụng macrolide cần đặc biệt cẩn thận nếu trong mẫu đàm cấy
có vi khuẩn Mycobacteria. Khi đó cần phải ngừng sử dụng macrolide để hạn chế tối đa nguy
24
cơ kháng thuốc của dòng vi khuẩn này[33]. Phác đồ hiện nay tạm thời được chấp nhận phổ
biến là azithromycin uống 250 mg/ngày hoặc uống 500 mg 3 lần/tuần.
7.1.6. Sử dụng kháng sinh dạng hít dài ngày
Hầu hết bệnh nhân GPQ đều bị nhiễm mạn tính với vi khuẩn trong giai đoạn ổn định.
Việc điều trị những bệnh nhân nhiễm vi khuẩn thường được tiến hành trong vòng 28 ngày
với các kháng sinh dạng hít, sau đó dừng điều trị 28 ngày và lại điều trị tiếp tục. Liệu trình
điều trị này đã chứng tỏ có khả năng làm giảm các chỉ số viêm nhiễm và làm giảm nguy cơ
các đợt kịch phát của bệnh[31]. Một lưu ý là trước khi sử dụng các kháng sinh dạng hít cần
phải tiến hành kháng sinh đồ để có thể lựa chọn loại thuốc kháng sinh phù hợp với tác nhân
gây nhiễm trùng.
Sử dụng kháng sinh dạng hít cũng được chứng minh có tác dụng cải thiện triệu chứng
hô hấp ở bệnh nhân GPQ nặng, tuy nhiên một số bệnh nhân có thể bị các tác dụng phụ như
ho, khò khè, mệt lả do đáp ứng với thuốc, và thậm chí dẫn đến kháng thuốc.
Một số phác đồ hiện nay được sử dụng là:
− Tobramycin dạng hít: phun 300 mg/12 giờ sử dụng trong 28 ngày và sau đó ngừng 28
ngày hoặc
− Colistimethate Sodium: liều tùy thuộc từng cơ sở y tế hoặc
− Aztreonam: phun 75 mg/8 giờ sử dụng trong 28 ngày và sau đó ngừng 28 ngày hoặc
− Gentamicin: phun 80 mg/12 giờ sử dụng trong 28 ngày và sau đó ngừng 28 ngày.
7.1.7. Sử dụng corticosteroids dạng hít
Hiện nay các thử nghiệm lâm sàng về sử dụng corticosteroid dạng hít trong GPQ đã
chứng minh được tác dụng làm giảm thể tích đàm trong 24 giờ và cải thiện chất lượng cuộc
sống về mặt sức khỏe của bệnh nhân, tuy nhiên costicosteroid không cải thiện chỉ số FEV1
hoặc số lần các cơn kịch phát. Các nghiên cứu này sử dụng costicosteroids liều cao
(fluticasone 500 μg 2 lần/ngày hoặc beclometasone 750 µg 2 lần/ngày) nhưng liều tối ưu
hiện nay vẫn cần phải nghiên cứu thêm. Việc điều trị costicosteroid có thể kéo dài trong
vòng 6 tháng, đặc biệt ở bệnh nhân có bằng chứng tắc nghẽn đường hô hấp và bệnh nhân
GPQ nặng.
25
7.2. Điều trị bệnh nhân trong đợt kịch phát
Điều trị kháng sinh khẩn cấp là khuyến cáo hàng đầu đối với bệnh nhân trong cơn
kịch phát. Hiện nay cơ chế tác động, sự lựa chọn kháng sinh, thời gian sử dụng, sử dụng một
thuốc hay hai thuốc và cách tốt nhất để đánh giá đáp ứng điều trị ở bệnh nhân vẫn còn đang
được các nhà khoa học nghiên cứu.
7.2.1. Sử dụng thuốc kháng sinh ngắn ngày
Cấy đàm tìm vi khuẩn phải được thực hiện ngay từ khi khởi phát cơn kịch phát và
tiến hành ngay lập tức điều trị kháng sinh theo kinh nghiệm dựa trên kết quả cấy đàm trước
đó nếu có. Chỉ nên thay đổi phác đồ điều trị nếu bệnh nhân không đáp ứng lâm sàng. Khi đó
phải dựa vào kết quả cấy đàm và kháng sinh đồ phát hiện vi khuẩn gây bệnh để sử dụng
đúng kháng sinh tương ứng với vi khuẩn đó.
Sau đây là bảng khuyến cáo sử dụng kháng sinh điều trị GPQ theo kinh nghiệm dựa
trên kết quả cấy kháng sinh đồ trước đó[21].
Vi khuẩn
Streptococcus
Thuốc hàng thứ nhất
Thuốc hàng thứ hai
Amoxicillin 500 mg 3 lần/ngày Clarithromycin 500 mg 2 lần/ngày
pneumoniaeor
hoặc
(β-lactamase-âm tính)
Amoxicillin 1g 3 lần/ngày hoặc
Haemophilus influenzae
3 g 2 lần/ngày đối với bệnh nặng
Co-amoxiclav 625 mg 3 lần/ngày
(β-lactamase-dương tính)
Moraxella catarrhalis
Doxycycline 100 mg 2 lần/ngày hoặc
Clarithromycin 500 mg 2 lần/ngày
Ciprofloxacin 500 mg 2 lần/ngày
hoặc
Ceftriaxone 1–2 g OD (Tiêm tĩnh
Staphylococcus aureus
MRSA điều trị đường uống
mạch)
Flucloxacillin 500 mg 4 lần/ngày
Clarithromycin 500 mg 2 lần/ngày
<50 kg: Rifampicin 450 mg 1 <50 kg: Rifampicin 450 mg 1
lần/ngày + trimethoprim 200 mg 2 lần/ngày + doxycycline 200 mg 2
lần/ngày
lần/ngày
≥50 kg: Rifampicin 600 mg 1 ≥50 kg: Rifampicin 600 mg 1
lần/ngày + trimethoprim 200 mg 2 lần/ngày + doxycycline 200 mg 2
MRSA
lần/ngày
lần/ngày
Vancomycin (Tiêm tĩnh mạch) Linezolid (uống hoặc Tiêm tĩnh