BẢNG MÔ TẢ CHƯƠNG V HÓA HỌC LỚP 8
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (73.17 KB, 8 trang )
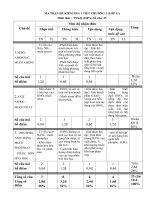
BẢNG MÔ TẢ CHƯƠNG 5
HÓA 8 “ HIDRO -- NƯỚC “
I.Chuẩn kiến thức kĩ năng :
1. Kĩ năng :
- Tính chất vật lí , tính chất hóa học và ứng dụng của hidro ,làm thí nghiệm điều chế hidro, thử khí hidro , phương pháp điều chế
hidro trong phòng thí nghiệm , biết cách thu khí hidro ,khái niệm phản ứng thế là gì ? Thía nghiệm chứng minh hidro khử CuO .
- Thành phần định tính và định lượng của nước , tính chất hóa học của nước và vai trò của nước trong đời sống và sản xuất , sự ô
nhiểm nguồn nước và cách bảo quản tiết kiệm nước .
- Định nghĩa axit , bazo, muối , thành phần cách gọi tên và phân loại axit , bazo , muối .
- Làm thí nghiệm tính chất hóa học của nước ,
2 . Kĩ năng :
- Quan sát thí nghiệm rút ra tính chất vật lí và hóa học của hidro m viết PTHH , tính thể tích chất tham gia và sản phẩm .
- Quan sát thí nghiệm rút ra điều chế hidro , viết PTHH , nhận biết phản ứng thế , tính thể tích hidro ở đktc .
- Quan sát thí nghiệm rút ra tính chất hóa học của nước , vier61 PTHH ,biết sử dụng quì tím , nhận biết axit , bazo ,muối cụ thể .
- Phân loại được axit, bazo , muối , viết được CTHH , đọc tên, phân biệt axit, bazo, muối bằng quì tím . Tính khối lượng axit, bazo,
muối tạo thành trong phản ứng .
- Biết cách làm thí nghiệm thực hành thí nghiệm , quan sát thí nghiệm , nêu hiện tượng và giải thích hiện tượng , viết PTHH.
II . Phát triển năng lực:
a. năng lực sử dụng ngôn ngữ hóa học.
b. Năng lực thực hành thí nghiệm hóa học.
c. Năng lực tính toán hóa học.
d. năng lực giải quyết vấn đề.
f. năng lực vận dụng kiến thức hóa học vào thực tiễn cuộc sống.
III. Bảng mô tả các mức yên cầu cần đạt cho mỗi loại câu hỏi / bài tập trong chủ đề
Nội dung
Loại câu hỏi / Nhận biết
Thông hiểu
Vận dụng thấp
Vận dụng cao
bài tập
Tính chất
Loại câu hỏi / 1.Biết tính chất vật lí
1.Viết được PTHH
1.So sánh khí H2 nặng 1.Giải thích hiện
hidro- ứng
bài tập định
hidro .
của khí H2 với 1 số
hay nhẹ hơn các khí
tượng bóng bay trong
dụng hidro
tính
2.Biết H2 tác dụng
oxit kim loại .
khác .
không khí trong các
được với nước ,oxit
ngày lễ lớn .
kim loại.
3.Biết ứngdụng H2
Điều chế
Hidro – phản
ứng thế Điều
chế Hidro –
phản ứng thế
4.Biết điều chế H2
trong PTN
5.Nhận biết phản ứng
thế
6.Biết cách thu khí H2
Nước
7.Biết thành phần định
tính và định lượng của
nước .
8.Biết tính chất hóa
học của nước .
9.Biết vai trò của nước
trong đời sống và sản
xuất ,biện pháp chống
ô nhiểm nguồn ,tiết
kiệm nước.
10.Biết khái niệm axit,
bazo, muối
-11.Biết phân loại axit,
bazo, muối.
Axit – Bazo –
Muối
Tính chất
Câu hỏi / bài
hidro- ứng
tập định lượng
dụng của hidro
Điều chế hidro
Phản ứng thế
Bài thực hành
sô 5
Câu hỏi gắn
với TNTH
-Biết mô tả thí
nghiệm ,nhận biết
2.Phân loại và xác
định được phản ứng
thế .
3.Hiểu và giải thích
cách thu khí H2vơi
cách thu khí oxi
4.Hiểu viết
PTHHcua3 nước với
lim loại ,1so oxit kim
loại.
5.Hiểu và xác định
nước tác dụng với
oxit nào , gọi tên chất
tạo thành
2.Viết PTHH biến hóa
thể hiện tính chất hóa
học của nước
3.Từ kiến thức đã học
điền CTHH để hoàn
thành PTHH.
-6.Hiểu viết được
CTHH từ tên gọi của
1 số axit, bazo, muối,
7.Ngược lại từ CTHH
gọi tên.
8.Từ kiến thức đã học
xác định oxit, axit,
bazo, muối.
- Giải thích hiện
tượng thí nghiệm
2.Tính số mol dư và
khối lượng dư
4.Tính được khối
lượng chất tạo thành
5.Tính được khối
lượng chất tạo thành
6.Tính được khối
lượng chất tạo thành
-Giải thích và phân tích
được kết quả TN để rút
3.Tính khối lượng
chất từ số mol dư
4.Tính khối lượng 1
chất từ số mol dư.
-Phất hiện 1 số hiện
tượng trong thực tiển
Bài thực hành
số 6
hiện tượng TN,dấu
hiệu hiện tượng TN
-Biết mô tả thí
nghiệm ,nhận biết
hiện tượng TN,dấu
hiệu hiện tượng TN
ra kết luận
- Giải thích hiện
tượng thí nghiệm
và sử dụng kiến thức
để giải thích
-Giải thích và phân tích
được kết quả TN để rút
ra kết luận
IV.Hệ thống câu hỏi / bài tập đánh giá theo các mức đã mô tả :
A. Biết :
1/ Nêu tính chất vật lí của hidro ?
2/ Tính chất hóa học của hidro ? Viết PTHH minh họa ?
3/ Ứng dụng của hidro ?
4/Nêu cách điều chế hidro trong PTN ?
5/ Phản ứng thế là gì ?
6/ Cho biết cách thu khí hidro bằng cách đẩy không khí ?
7/Cho biết thành phần định tính và định lượng của nước ?
8/Nước tác dụng được với chất nào ?
9/ Nước có vai trò gì trong đời sống và sản xuất ?Nêu biện pháp chống ô nhiểm nguồn nước ? Tiết kiệm nước ?
10/ Axit, bazo, muối là gì ?
11/ Axit, bazo, muối có mấy loại ?
12/ Cho 2- 3 viên kẽm vào ống nghiệm và cho vài giọt dung dịch HCl ta thấy hiện tượng gì ?
13/ Cho 4-5 viên Kẽm với 10ml dung dịch HCl rồi cho qua bột CuO đun đến 400oC ta thấy hiện tượng gì ?
14/ Cho viên Na vào cốc nước ta thấy có hiện tượng gì ? Cho quì tím vào quan sát màu ?
15/ Cho vôi bột vào ống nghiệm rồi cho nước vào quan sát hiện tượng ? cho quì tím vào quan sát sự thay đổi màu ?
16/ Đốt cháy P đỏ cho cháy với khí O2 rối cho nước vào lắc , sau đó cho quì tím vào quan sát sự thay đổi màu ?
B. Hiểu :
1/ Viết PTHH giữa khí hidro với sắt ( III) oxit, chì (II) oxit , thủy ngân (II) oxit ?
2/ Cho các phản ứng sau , cân bằng và xác định phản ứng :
a/ P + O2 → P2O5
b/ Zn + HCl → ZnCl2 + H2
c/ KmnO4 to
K2MnO4 + MnO2 + O2
3/ Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí phải đặt vị trí ống nghiệm như thế nào ?Vì sao ? Điều chế khí hodro có
làm thế được không ? Vì sao ?
4/ Viết phương trình phản ứng giữa K2O, K, BaO, SO2, SO3, với H2O ?
5/Trong các oxit sau : SO3, Na2O, Al2O3, CaO, P2O5, CuO, SO2 , oxit nào tác dụng được với nước ? Viết phương trình phản ứng và gọi
tên sản phẩm ?
6/ Gọi tên các axit sau : H2SiO3, H2SO3, H3PO3 , HNO2 ?
7/ Gọi tên các bazo sau : Cu(OH)2, Al(OH)3, Hg(OH)2 , Fe(OH)2 ?
8/ Viết CTHH của những muối sau : đồng ( II) sunfat, Kẻm Clorua, Bari Nitrat , Canxi hidro cacbonat , Natri đihidro photphat ?
9/ Gọi tên các axit, bazo, muối sau : H2SiO3, H3PO4, Mn(OH)2, Li OH, NaHCO3, CaCl2,
Al2 (SO4)3 . FeS ?
10/ Tại sao có sủi bọt có khí thoát ra ?
11/ Vì sao bột màu đen chuyển thành màu đỏ ?
12/ Vì sao quì tím thành xanh ?
13/ Tại sao dung dịch nóng lên ?Quì tím thành xanh?
14/ Vì sao khói trắng tan ra ? quì tím thành đỏ ?
C . Vận dụng thấp :
1/ Có những khí sau : SO2, O2, N2, CO2, CH4 .
a/ Những khí trên khí nào nặng hay nhẹ hơn khí hidro bao nhiêu lần ?
b/ Những khí trên khí nào nặng hay nhẹ hơn không khí bao nhiêu lần ?
2/ Những phản ứng hóa học nào dưới đây có thể được dùng để điều chế H2 trong phòng thí nghiệm
a/ Zn + H2SO4 → ZnSO4 + H2
b/ 2Al + 6HCl → 2AlCl3 + 3H2
c/ 2H2O
đp
2H2 + O2
3/ Cho PTHH : 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Để thu 3,36lit1 khí H2 ở đktc cần sử dụng tối thiểu bao nhiêu gam nhôm ?
4/ Trong phòng thí nghiệm có các kim loại Zn, Fe, HCl, H2SO4 loãng .
a/ Viết PTHH ?
b/ Phải dùng bao nhiêu gam Zn, Fe, để điều chế được 22,4lit1 khí H2 ở đktc ?
5/ Tính thể tích khí hidro và khí oxi ở đktc cần tác dụng với nhau để tạo ra được 1,8gam nước ?
6/ Người ta dùng nước để làm gì ?Tại sao?
D . Vận dụng cao :
1/ Trong các dịp lễ hội em thường thấy các trường thả bóng . Những quả bóng đó có thể được bơm bằng những khí gì ?Em hãy giải
thích vì sao khi bơm khí hidro vào thì quả bóng bay lên được , còn bơm không khí vào thì bóng không bay lên được ?
2/ Cho sơ đồ biến hóa sau , viết PTHH :
a/ Ca → CaO → Ca(OH)2
b/ N2 → N2O5 → HNO3
c/ K → K2O → KOH
3/ Điền các CTHH vào những chỗ trống để hoàn thành các phương trình phản ứng và cân bằng :
a/ K2O + H2O → -------b/ Ca + -------- → Ca(OH)2 + ------c/ -------- + H2O → KOH + H2
d/ BaO + ---------- → Ba(OH)2
4/ Tính số gam nước thu được khi cho 8,4 lít khí hidro tác dụng với 2,8 lít oxi ( các thể tích đo ở đktc ) ?
5/ Cho 22,4 gam sắt tác dụng với dung dịch loãng có chứa 24,5 gam H2SO4.
a/ Chất nào còn dư sau phản ứng và dư bao nhiêu gam ?
b/ Tính thể tích hidro thu được ở đktc ?
6/ Tính khối lượng nước ở trạng thái lỏng sẽ thu được khi đốt cháy hoàn toàn 112 lít khí hidro ở đktc với khí oxi ?
7/Trong thực tế tại sao có kim loại nguyên chất ?
HƯỚNG DẨN TRẢ LỜI
A. BIẾT :
1/ Hidro là chất khí ,không màu ,không mùi,không vị,ít tan trong nước,nhẹ nhất trong các chất khí .
2/ Hidro tác dụng với oxi → nước là hổn hợp nổ , nổ mạnh theo tỉ lệ 2:1 : 2H2 + O2 to 2H2O
Tác dụng với CuO → Cu nguyên chất và nước : CuO + H2 to Cu + H2O
3/ Ứng dụng của hidro là do nhẹ bơm vào các khí cầu , khử 1 số oxit kim loại .
4/ Trong phòng thí nghiệm điều chế hidro bằng cách cho kẽm tác dụng với dung dịch axit clohidric
Zn + 2HCl → ZnCl2 + H2
5/ Phản ứng thế là phản ứng hóa học trong đó giữa đơn chất và hợp chất ,nguyên tử của dơn chất thay thế nguyên tử của một nguyên
tố trong hợp chất .
6/ Thu khí hidro bằng cách đẩy nước hoặc đẩy không khí ra khỏi ống nghiệm .
7/ Thành phần định tính của nước là hợp chất tạo bởi 2 nguyên tố hidro và oxi , chúng hóa hợp với nhau theo tỉ lệ thể tích là 2 H và
1O còn theo khối lượng là 1 phần H và 8 phần O hoặc 2H và 16 O . Vậy CTHH của nước là H 2O .
8/ Tính chất hóa học của nước :
a/ Tác dụng với kim loại → dung dịch bazo và khí hidro : Na2O + H2O → 2NaOH
b/ Tác dụng với 1số oxit kim loại → dung dịch bazo:CaO + H2O→Ca(OH)2,làm quì tím →xanh.
c/ Tác dụng với 1 số oxit axit →dung dịch axit : P2O5 + 3H2O → 2H3PO4, làm quì tím →đỏ .
9/ Nước quan trọng trong đời sống và sản xuất : nước hòa tan nhiều chất dinh dưỡng cần thiết cho cơ thể , nước tham gia quá trình
hóa học trong cơ thể người và động vật , nước cần thiết cho đời sống hằng ngày , sản xuất nông nghiệp, công nghiệp ,xây dựng giao
thông vận tải …
- Bảo vệ nước tránh ô nhiểm nguồn nước : tránh rác thải sinh hoạt ,nông nghiệp , công nghiệp, tiết kiệm nước . Mỗi người góp phần
giữ nguồn nước không bị ô nhiểm , không vứt rác xuống ao hồ sông .xử lí nước thải sinh hoạt , nước thải công nghiệp trước khí chảy
vào hồ …
10/ Axit là hợp chất gồm 1 hay nhiều nguyên tử hidro liên kết gốc axit, các nguyên tử hi dro này có thể thay thế bằng nguyên tử kim
loại .
- Bazo là hợp chất gồm có 1 nguyên tử kim loại liên kết với 1 hay nhiều nhóm hidroxit ( - OH) .
-Muối là hợp chất có 1hay nhiều nguyên tử kim loại liên kết với 1 hay nhiều gốc axit .
11/ Axit có 2 loại là axit có oxi và axit không có oxi .
- Bazo có 2 loại là bazo tan ( kiềm ) và bazo không tan .
- Muối có 2 loại là muối trung hòa và muối axit .
12/ Có sủi bọt ,kẽm tan ra đồng thời có khí thoát ra ngoài .
13/ bột CuO màu đen dần chuyển thành màu đỏ là Cu và hơi nước .
14/ Natri cháy sáng chạy vòng trên mặt nước tan dần ra , dung dịch làm quì tím thành xanh .
15/ Vôi bột tan dần ra , tỏa nhiều nhiệt làm nóng lên , dung dịch làm quì tím thành xanh.
16/ Tạo nhiều khói trắng bám lên thành bình , cho nước vào lắc khói trắng tan dần thành dung dịch không màu làm quì tím thành
xanh .
B . HIỂU :
1/ Viết PTHH : 3H2 + Fe2O3 to 2Fe + 3H2O .
PbO + H2
to Pb + H2O .
HgO + H2 to Hg + H2O .
2/ Phản ứng thế là câu b/
3/ Thu khí hidro đặt ống nghiệm úp , thu khí oxi đặt ống nghiệm ngửa vì khí hidro nhẹ hơp không khí , còn khí oxi nặng hơn không
khí .
4/ Những chất tác dụng với nước là :
K2O + H2O → 2KOH
2K + H2O → 2KOH + H2
BaO + H2O → Ba(OH)2
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4 .
5/ a/ SO3 + H2O → H2SO4 : Axit sunfuric
b/ Na2O + H2O → 2NaOH : Natri hidroxit .
c/ CaO + H2O → Ca(OH)2 : Canxi hidroxit
d/ P2O5 + 3H2O→2H3PO4: Axit photphoric.
SO2 + H2O → H2SO3 : Axit sunfuro .
6/ H2SiO3 : Axit silicic
H2SO3 : Axit sunfuro
H3PO3 : Axit photphoro
HNO2 : Axit nitoro.
7/ Cu(OH)2 : đồng (II) hidroxit
Al(OH) 3 : Nhôm hidroxit .
Hg(OH)2 : Thủy ngân (II) oxit
Fe(OH)2 : Sắt (II) hidroxit .
8/ CuSO4, ZnCl2, Ba(NO3)2, Ca( HCO3)2 .
9/ H2SiO3 : Axit silicic
Fe(OH)3 : Sắt ( III) hidroxit .
NaHCO3 : Natri hidro cacbonat.
Al2(SO4)3 : Nhôm sunfat .
H3PO4 : Axit photphoric
Zn(OH) 2 : Kẽm hidroxit.
CaCl2 : Canxi clorua
FeS : Sắt (II) sunfua .
C . VẬN DỤNG THẤP :
1/ a) Khí nặng hơn khí H2 là SO2, O2,N2,CO2, CH4, nhẹ hơn H2 không có .
b) Khí nặng hơn không khí là SO2, O2, CO2 , Khí nhẹ hơn không khí là N2, CH4.
2/ Phản ứng điều chế H2 trong PTN là a/ và b/ .
3/ Số mol của hidro là : n =
3,36
= 0,15mol.
22, 4
2Al + 3H2SO4 → Al2(SO4)3 + 3 H2
2mol 3mol
3mol
Xmol
0,15mol
Số mol của Al : x =
2 x0,15
= 0,1mol.
3
Khối lượng của Al là : m = n.M = 0,1 .27 = 2,7gam .
4/ a/ Zn + 2HCl → ZnCl2 + H2
Zn + H2SO4 → ZnSO4 + H2.
Fe + 2HCl → FeCl2 + H2
Fe + H2SO4 → FeSO4 + H2.
Số mol của H2: n=2,24 : 22,4 = 0.1mol → Số mol của Zn là 0,1mol .
Khối lượng của Zn là : m = 0,1 . 65 = 6,5gam .
Số mol của Fe là 0,1mol → Khối lượng của Fe là : m= 0,1 . 56 = 5,6gam .
5/Số mol của nước : n = 1,8 : 18 = 0,1mol
PTHH : 2H2 + O2 → 2H2O
2mol 1mol
2mol
0,1mol 0,05mol 0,1mol
Số mol của H2 là 0,1mol → Thể tích H2 là : V = 0,1 . 22,4 = 2,24 lít
Số mol của O2 là 0,05mol → Thể tích của O2 là : V = 0,05 . 22,4 = 1,12 lít
6/ Nước dùng làm dung môi nên hòa tan nhiều kim loại . oxit kim loại , oxit phi kim tạo thành dung dịch axit, bazo .
D. VẬN DỤNG CAO :
1/ Trong các dịp lễ hội người ta thường thả bóng , những quả bóng thường được bơm bằng khí hidro . Từ tỉ khối của hidro so với
không khí ta thấy khí H2 nhẹ sấp xỉ = 1/15 không khí nên bong bay . Bơm không khí vào bóng không bay được vì không khí cộng
với khối lượng quả bóng sẽ có d/KK .> 1 nên bóng không được đẩy lên .
2/ a/ Ca + O2 → CaO
CaO + H 2O → Ca(OH)2
b/ 2N2 + 5O2 → 2N2O5
N2O5 + H2O → 2HNO3.
c/ 4K +O2 → 2K2O
K2O + H2O → 2KOH.
3/ a/ K2O + H2O → 2KOH
b/ Ca + H2O → Ca(OH)2 + H2.
c/ 2K + H2O → 2KOH + H2
d/ BaO + H2O → Ba(OH)2 .
4/ Số mol của H2 là : n = 8,4 : 22,4 = 0,375mol
Số mol của O2 là : n = 2,8 : 22,4 = 0,125mol
PTHH : 2H2 +
O2 →
2H2O
2mol
1mol
2mol
0,375mol 0,125mol 0,25mol
Số mol của H2 dư nên số mol của nước từ số mol của O2 chuyển qua . Do đó số mol của nước là 0,25mol . Vậy khối lượng của nước
là : m = 0,25 . 18 = 4,5gam .
5/ a) Số mol của sắt là : n = 22,4 :56 = 0,4 mol
Số mol của H2SO4 lả : n= 24,5 : 98 = 0,25mol
PTHH : Fe + H2SO4 → FeSO4 + H2
1mol
1mol
1mol
0,25mol 0,25mol
0,25mol
Số mol của Fe dư : 0,4 – 0,25 = 0,15mol
Khối lượng Fe là : m = 0,15 . 56 = 8,4gam .
b) Số mol của H2 là 0,25mol → Thể tích của H2 là : V = 0,25 . 22,4 = 5,6 lít .
6/ Số mol của H2 là : n = 112 : 22,4 = 5mol .
PTHH : 2H2 + O2 → 2H2O
2mol
1mol
2mol
5mol
5mol
Số mol của H2O là 5mol → Khối lượng của H2O là : m = 5 . 18 = 90gam
Thể tích của nước ở thể lỏng là 90ml .
7/ Trong thực tế người ta dùng H2 để khử 1 số quặng kim loại đào từ dưới mỏ lên luôn luôn có lẫn oxi như CuO, ZnO, PbO, FeO,
Fe2O3, Fe3O4…
Hết